سرطان الثدي
سرطان الثدي هو نوع من أنواع السرطان يظهر في أنسجة الثدي.[3] من علاماته تغير في شكل الثدي، وظهور كتلة في الثدي، تقشير الجلد، سائل قادم من الحلمة، حلمة مقلوبة حديثًا، أو بقع حمراء أو متقشرة.[4] في حالة انتشار المرض في الجسم تظهر العلامات التالية:آلام العظم، انتفاخ في الغدد الليمفية، ضيق في التنفس أو اصفرار في الجلد.[5]
| سرطان الثدي | |
|---|---|
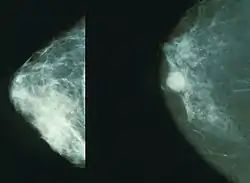 صورة أشعة سينية تبين شكل الورم السرطاني في الثدي (يمين) والثدي الطبيعي (يسار). صورة أشعة سينية تبين شكل الورم السرطاني في الثدي (يمين) والثدي الطبيعي (يسار). | |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| من أنواع | سرطان صدري ، وأمراض الثدي، ومرض |
| الموقع التشريحي | ثدي[1] |
| الأسباب | |
| عوامل الخطر | تدخين[2] |
| الإدارة | |
| أدوية | إيثينيل إيستراديول، وفليوكسي ميسترون، وفينبلاستين، وكابسيتابين، وديكسرازوكسان ، وإيداروبيسين، وميثوتركسيت، وكاربوبلاتين، وباكليتاكسيل، وميتوكسانترون، وفينورلبين، وترازتوزوماب، وأناستروزول، وتورميفين، وليتروزول، وإكسيميستان، وإيبيروبيسين، ودوسيتاكسيل، وتاموكسيفين، وثنائي إيثيل ستيلبوستيرول، وإرينوتيكان، وسيسبلاتين، وإستراديول، وسيكلوفوسفاميد، وكلورامبوسيل، وميثيل تستوستيرون، وميلفالان، وسارغراموستيم، وليوبرورلين، وفولفيسترانت ، ودوكسوروبيسين، وإيفوسفامايد، وتستولاكتون، وفلورويوراسيل، وأمينوغلوتيثيميد، وميجيستيرول، وناندرولون، وتاموكسيفين، وفينورلبين، وإيريبيولين
|
العوامل التي تزيد من احتمالية الإصابة بسرطان الثدي: نوع الجنس؛ النساء أكثر عرضة للإصابة بسرطان الثدي من الرجال، السمنة وعدم ممارسة الرياضة، شرب الكحول، العلاج بالهرمونات البديلة خلال فترة انقطاع الطمث، التعرض لإشعاع مؤين، البلوغ المبكر للفتاة، إنجاب الأطفال في عمر متأخر أو عدم إنجاب الأطفال، والتقدم في العمر.التاريخ السابق لسرطان الثدي، وتاريخ الأسرة.[4][6] يظهر عادة في 5-10% من الحالات الوراثية تغير في الجين سواء من الأب أو الأم بما في ذلك. تتضمن غدد الحليب وقنوات الحليب (غره أو بصيلة لبنية) BRCA1، BRCA2 .[4] عادة ما يتطور سرطان الثدي في الخلايا من بطانة القناة اللبنية والفصوص التي تزود القنوات باللبن.[4] تُعرف السرطانات الناشئة عن القنوات باسم سرطان القنوات الغازية، بينما تُعرف السرطانات النامية من الفصوص بأنها سرطانات مفصصة.[4] بالإضافة إلى ذلك، هناك أكثر من 18 نوعًا آخر من أنواع سرطان الثدي.[6] بعض أنواع السرطان، مثل سرطان مفصص الغازية، تتطور من ورم محتمل الخباثة.[6] يتم تأكيد تشخيص سرطان الثدي عن طريق أخذ خزعة من الورم المعني.[4] بمجرد إجراء التشخيص، يتم إجراء مزيد من الاختبارات لتحديد ما إذا كان السرطان قد انتشر إلى ما بعد الثدي وما هي العلاجات التي من المرجح أن تكون فعالة.[4]
لازال ميزان الفوائد مقابل أضرار فحص سرطان الثدي مثير للجدل. وفي عام 2013 أوضحت مؤسسة كوكرين بأنه غير معروف بعد ما إذا كانت أضرار استخدام جهاز تصوير الثدي الشعاعي لفحص الثدي أكبر من فوائده.[7] وفي عام 2009 وجدت المؤسسة الأمريكية للخدمات الوقائية بأن الفئة العمرية من 40-70 سنة [8] أكثر استفادة من غيرها وقد أوصت بالقيام بفحص الثدي كل سنتين للنساء من الأعمار 50-74 سنة[9] بجهاز الماموغرام. دواء تاموكسيفين ورالوكسيفين كعلاج وقائي للأشخاص الأكثر عرضة للإصابة بسرطان الثدي.[6] ومن الممكن أيضًا إجراء عملية استئصال لكلا الثديين للأشخاص ذوي العرضة الشديدة جداً للإصابة.[6] هناك عدد من الطرق لعلاج الأشخاص المصابين بسرطان الثدي مثل: الجراحة، علاج بالأشعة، العلاج الكيميائي، العلاج الهرموني والعلاج الموجه.[4] إجراء عملية المعالجة بالجراحة تتضم جراحة الثدي المحافظة أو استئصال الثدي حسب الحالة.[10][11] في حالة استئصال الثديين يمكن إعادة ترميمهما في وقت أخر في نفس عملية استئصالهما. علاج الأشخاص الذين انتشر السرطان في أجزاء أخرى من جسدهم يهدف إلى زيادة راحتهم وتحسين نوعية الحياة.
آثار سرطان الثدي على الشخص المصاب تختلف بعدة عوامل منها: نوع السرطان، درجة انتشاره في الجسم، وعمر المصاب. تعدّ معدلات البقاء في الدول المتقدمة [12] عالية في إنجلترا والولايات المتحدة تكون بين 80-90% معدل البقيا لخمس سنوات.[13][14] أما في الدول النامية تعدّ معدلات البقاء أقل منها في الدول المتقدمة، يعدّ سرطان الثدي أكثر شيوعاً في الدول المتقدمة.[6] عالمياً، يعدّ سرطان الثدي النوع الرائد عند النساء حيث يمثل 25% من حالات السرطان.[15] وفي عام 2012 سُجلت 1680000 حالة و522000 حالة وفاة وهو أكثر شيوعاً في البلاد المتقدمة [6] وتصيب النساء أكثر 100 مرة من الرجال.[12][16]
العلامات والأعراض

-ar.png.webp)
أول علامة ظاهرة لسرطان الثدي هي وجود كتلة ضمن أنسجة الثدي تختلف عن النسيج الطبيعي له. تُكتَشف في 80% من الحالات عندما تشعر المرأة بوجود هذه الكتلة[17] يكون الاكتشاف المبكر للسرطان عن طريق جهاز الماموغرام [18] ويمكن أن تشير انتفاخ العقد الليمفية في منطقة الإبط [17] أيضًا إلى سرطان الثدي.
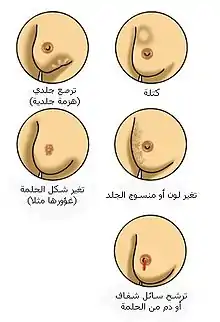
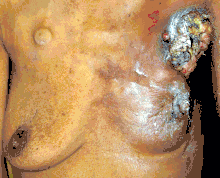
علامات أخرى - بجانب ظهور كتلة في الثدي - تدل على وجود سرطان الثدي: زيادة قساوة منطقة معينة في نسيج الثدي نسبة للنسيج الطبيعي، كبر أو صغر حجم ثدي عن الآخر، تغير في شكل أو موقع الحلمة أو تصبح الحلمة مسحوبة للداخل، تغير في جلد الثدي إلى مجعد أو منقر المظهر، ظهور طفح جلدي حول الحلمة أو عليها، خروج سائل من الحلمة، الشعور بألم متواصل في جزء من الثدي أو في منطقة الإبط، وظهور تورم تحت منطقة الإبط أو حول الترقوة.[19] لا يمكن الاعتماد على الشعور بألم في الثدي لتحديد ما إذا كان الشخص مصاب بسرطان الثدي أم لا، ولكن قد يكون مؤشراً مهماً لوجود مشكلات صحية أخرى في الثدي.[17][18][20]
داء باجيت في الثدي هو نوع من أنواع سرطان الثدي، يمثل تشخيصه تحدي كبير حيث تشبه أعراضه أعراض التهاب الثدي تتضمن حكة، ألم، انتفاخ، احمرار وسخونة في الثدي بالإضافة إلى انسحاب الحلمة للداخل وجلد الثدي يشبه ملمس قشر البرتقال [17] ، بما أن سرطان الثدي الالتهابي تظهر فيه كتلة فإن الكشف عنه يكون متأخر. تمثل متلازمة باجيت التي تصيب الثدي تغيرات في الجلد تشبهها في الاكزيما، مثل الاحمرار، تغير لون الجلد، سقوط خفيف للجلد المغطي للحلمة. عند تقدم المرض تصبح الأعراض تشمل وخز، حكة، زيادة حساسية الثدي، الشعور بالحرقة في الثدي وألم، من الممكن أيضًا أن يخرج سائل من الحلمة. تقريباً نصف النساء المصابات بمتلازمة بيجيت في الثدي يظهر لديهم كتلة في الثدي.[21]
في بعض الحالات النادرة يظهر في البداية ورم غدي ليفي (كتلة صلبة، متنقلة غير سرطانية)، يمكن أن يكون في الحقيقة ورماً ظهارياً ليفياً. يتكون الورم الظهاري الليفي في الستروما (نسيج ضام) الخاصة بالثدي، ويحتوي على غدد وأنسجة ضامة. لا يصنف الورم الظهاري الليفي بالطريقة المعتادة وإنما تصنف اعتماداً على مظهرها تحت المجهر كـورم حميد، أو خبيث أو بيني (حالة بين الحميد والخبيث).[22] أحياناً، يعدّ سرطان الثدي مرضاً نقيلياً؛ بمعنى أنه ينتشر إلى أجزاء أخرى من الجسم غير مكانه الأصلي.
أعراض سرطان الثدي المنتقل تختلف باختلاف المكان الذي انتقل إليه، يعد العظم، الكبد، الرئتين والدماغ [23] من المواقع الشائعة لانتقال سرطان الثدي. خسارة الوزن غير المبررة تعدّ أحياناً من مؤشرات سرطان الثدي، بالإضافة إلى ارتفاع درجة الحرارة أو القشعريرة واليرقان، من الممكن أن يكون ألم العظام أو المفاصل من مظاهر سرطان الثدي النقيلي أو أعراض عصبية أخرى.
تعد هذه الأعراض عامة حيث من الممكن أن تكون مظاهراً لمرض آخر.[24]، وأمراض الثدي الحميدة مثل التهاب الثدي، ووجود ورم غدي ليفي هي الأسباب الأكثر شيوعاً لظهور أعراض جديدة على محمل الجد من قبل كل من المرضى والأطباء بسبب احتمال وجود سرطان الثدي الأساسي في أي عمر تقريباً.[25]
العوامل التي تزيد من احتمالية الإصابة بسرطان الثدي
ويمكن تقسيم عوامل الخطر إلى فئتين:
- عوامل الخطر القابلة للتعديل (الأشياء التي يمكن للناس تغييرها في أنفسهم، مثل استهلاك المشروبات الكحولية)، و
- عوامل ثابتة المخاطر (الأشياء التي لا يمكن تغييرها، مثل السن والجنس البيولوجي).[26]
العامل الرئيسي للإصابة بسرطان الثدي هو نوع الجنس (النساء أكثر عرضة من الرجال)[27]، والتقدم في العمر (تزيد الاحتمالية بزيادة العمر)[28]، وقلة الانجاب أو عدمه [29] ، وقلة الرضاعة الطبيعية، زيادة نسبة هرمونات معينة في الجسم [30][31] ، وبعض الأنظمة الغذائية والسمنة، والوراثة وأظهرت الدراسات الحديثة أن التعرض للتلوث الضوئي يعدّ عاملاً من عوامل الإصابة بسرطان الثدي.[32]
نمط الحياة
يزيد تدخين التبغ من احتمالية الإصابة بسرطان الثدي، حيث كلما زادت الكمية وكان بدء التدخين بعمر مبكر، ترتفع احتمالية الإصابة بشكل أكبر [33] ، وأولئك المدخنين لمدى طويل تزيد الاحتمالية من 35%إلى 50%.[33] وقد تم ربط قلة ممارسة الرياضة إلى 10%من الحالات.[34] إن الجلوس لفترات طويلة يزيد من معدلات الوفيات من سرطان الثدي، لا تلغي ممارسة الرياضة احتمالية الإصابة بسرطان الثدي وإنما تقللها.[35] قد يكون هناك علاقة بين استخدام حبوب منع الحمل وتطور سرطان الثدي قبل انقطاع الطمث.[26][36] ولكن استخدام حبوب منع الحمل يتسبب في الإصابة بسرطان الثدي قبل انقطاع الطمث وهو موضوع مثير للجدل.[37] ولكن مازال موضوع ما إذا كان هناك حقاً صلة، فإن تأثيره ضعيف جداً.[37][38] للذين يحملون طفرات جينية أو لديهم تاريخ عائلي للإصابة بسرطان الثدي.[38] أظهرت الدراسات أن استخدام حبوب منع الحمل لا تؤثر لديهم على احتمالية الإصابة بسرطان الثدي.[39][40] العلاقة بين الرضاعة الطبيعية وسرطان الثدي لم تحدد بوضوح؛ أوجدت بعض الدراسات وجود علاقة في حين أن البعض الآخر لم يجد.[41] في الثمانينيات من القرن الماضي، تم افتراض فرضية أن الإجهاض سرطان الثدي التي افترضت أن الإجهاض المتعمد يزيد من احتمالية الإصابة بسرطان الثدي.[42] كانت هذه الفرضية تشكل موضوع بحث علمي واسع النطاق، حيث انتهت إلى أن الإجهاض غير مرتبط بزيادة احتمالية الإصابة بسرطان الثدي.[43] هناك علاقة بين النظام الغذائي وسرطان الثدي، يتضمن زيادة احتمالية الإصابة مع ارتفاع محتوى الدهون في النظام الغذائي [44] ، تناول الكحول،[45] والسمنة[46] ، حيث ترتبط جميعها بزيادة مستوى الكوليسترول في الجسم.[47] قد يلعب نقص تناول اليود في النظام الغذائي دوراً في ذلك أيضاً.[48] عوامل أخرى تزيد من احتمالية الإصابة بسرطان الثدي تشمل: الإشعاع [49] ، العمل بنظام المناوبة.[50] أيضا عدد من المواد الكيميائية بما في ذلك: مركبات ثنائي الفينيل متعدد الكلور، والهيدروكربونات العطرية متعددة الحلقات، والمذيبات العضوية[51] وعدد من المبيدات الحشرية.[52] على الرغم من أن كمية إشعاع جهاز الماموغرام (جهاز فحص الثدي) تعدّ قليلة، إلا انه يُقدر سنويا أن فحص النساء ضمن المرحلة العمرية 40-80 سنة من الممكن أن يسبب ما يقارب 225 حالة من الإصابة بسرطان الثدي المميت لكل مليون من النساء اللاتي يتم فحصهن أي ما يقارب 0.0255% من النساء اللاتي أجرين الفحص سنوياً.[53]
الوراثة
تلعب الوراثة دورا ثانويًا في معظم الحالات.[54] مع ذلك، يُعتقد أن الوراثة قد تكون السبب الرئيسي ل 5-10٪ من جميع الحالات.[55] للنساء اللواتي تم تشخيص أمهاتهن قبل ال50 لديهن خطر متزايد من 1.7 وأولئك الذين تم تشخيص الأم في سن 50 أو بعد زيادة خطر 1.4. .[56] للأشخاص الذين لهم واحد أو اثنين أول لا أحد من الأقارب مصابين بسرطان الثدي، تكون احتمالية اصابتهم بالمرض قبل سن ال 80 هو 13.3٪، و 21.1٪، 7.8٪على التوالي، وبلغت نسبة الوفيات من هذا المرض 4.2٪، و 7.6٪،2.3٪ على التوالي أيضا.[57] تكون احتمالية الإصابة بسرطان الثدي بين سن ال 40-50 للأشخاص الذين لهم أقرباء من الدرجة الأولى ضعف الأشخاص العاديين.[58] في أقل من 5٪ من الحالات، تلعب الوراثة دورا بالغ الأهمية من خلال التسبب في متلازمة سرطان الثدي-المبيض الوراثية، حيث يكون هناك طفرات في جينات معينة. تمثل هذه الطفرات نسبة تصل إلى 90٪ من مجموع التأثيرالجيني مع احتمالية الإصابة بسرطان الثدي بنسبة 60-80% في الأشخاص المصابين.[59] في عام 2012، أوضح باحثون أن هناك أربعة أنواع وراثية من سرطان الثدي، وأنه في كل نوع هناك تغيرات جينية مميزة تنتج عنها العديد من أنواع السرطان.[60]
الفيسيولوجيا المرضية

سرطان الثدي، مثل أنواع السرطان الأخرى، يحدث بسبب التفاعل بين عامل بيئي (خارجي) وقابلية الإصابة وراثيًا. الخلايا الطبيعية تنقسم عدة مرات حسب الحاجة ومن ثم تتوقف عن الانقسام. ثم تلتصق على خلايا أخرى وتبقى في مكانها في الأنسجة. تصبح الخلايا سرطانية عندما تفقد قدرتها على التوقف عن الانقسام، الالتصاق على الخلايا الأخرى، البقاء حيث تنتمي، والموت في الوقت المناسب. تقوم الخلايا الطبيعية بالانتحار (موت الخلايا المبرمج) عندما لم تعد هناك حاجه إليها. حتى ذلك الحين، تكون الخلايا الطبيعيه محمية من الانتحار عن طريق عدة مجموعات بروتينية ومسارات. أحد مسارات الحماية هو مسار (فسفوإينوزيتيد 3-كيناز/بروتين كيناز ب);مسار أخر وهو (راس/بروتين كيناز المنشط بالميتوجين/ايرك).أحيانًا الجينات المتعلقة بمسارات الحماية تتعرض لطفرات جينية بحيث تصبح هذه المسارات نشيطه بشكل دائم، فبالتالي تصبح الخلية غير قادرة على الانتحار عندما لم تعد هناك حاجة إليها. هذه خطوة من الخطوات التي تسبب السرطان بالاجتماع مع طفرات جينية أخرى. في الحالة الطبيعية، يعمل بروتين (بي أي تي ان) على إيقاف مسار (فسفوإينوزيتيد 3-كيناز/بروتين كيناز ب) عندما تكون الخلية جاهزة للانتحار. في بعض سرطانات الثدي، يتعرض الجين الخاص ببروتين (بي أي تي ان) لطفرة جينية، مما يؤدي إلى بقاء مسار (فسفوإينوزيتيد 3-كيناز/بروتين كيناز ب)في الحالة النشيطة وبالتالي لن تقوم الخلايا السرطانية بالانتحار.[66] الطفرات الجينية التي تؤدي إلى سرطان الثدي مرتبطة تجريبيا بالتعرض لهرمون الإستروجين.[67] إشارات عامل النمو غير الطبيعية خلال التفاعل بين الخلايا اللحمية والخلايا الظهارية قد تؤدي الي تسهيل نمو الخلايا الخبيثة.[68][69] في أنسجة الثدي الدهنية، زيادة تصنيع اللبتين يؤدي إلى زيادة تكاثر الخلايا والسرطان.[70] في الولايات المتحدة، من 10 إلى 20 في المئة من مرضى سرطان الثدي ومرضى سرطان المبيض لهم أحد من اقاربهم من الدرجة الأولى أو الثانية مصابا باحدى المرضين. ويطلق على قابلية العائلة للإصابة بهذه السرطانات متلازمة سرطان الثدي-المبيض الوراثية. الأكثر شهرة بهذه السرطانات، طفرات (بي ار سي أ)، تؤدي إلى خطر الإصابة بسرطان الثدي بين 60 و 85 في المئة، وخطر الإصابة بسرطان المبيض بين 15 و 40 في المئة. بعض الطفرات المرتبطة بالسرطان، مثل البروتين ب53، (بي ار سي أ 1)، و (بي ار سي أ2)، تحدث في آليات لتصحيح الأخطاء في الحمض النووي.هذه الطفرات إما موروثة أو مكتسبة بعد الولادة. ومن المفترض أنها تسمح بحوث مزيد من الطفرات، بالتالي تسمح بانقسام غير منضبط، وقلة الالتصاق، والانتشار الخبيث إلى أعضاء بعيدة.[49][71] ومع ذلك، هناك دليل قوي على اختلاف المخاطر المتبقية التي تذهب إلى ما وراء الطفرات الوراثية في جين (بي ار سي أ) بين العائلات الناقله للجين. يحدث هذا بسبب عوامل الخطر غير الملحوظة.[72] وهذا يؤشر إلى أن الأسباب البيئية وغيرها يؤدي إلى سرطان الثدي.[73] الطفرة الموروثة في الجينات (بي ار سي أ1) أو (بي ار سي أ2)، يمكن أن تتداخل مع إصلاح روابط الحمض النووي وتكسر حبل الحمض النووي المزدوج (وظائف معروفة للبروتين المشفر).وهذه المواد المسببة للسرطان تسبب التلف في الحمض النووي مثل روابط الحمض النووي وتكسر الحبل المزدوج التي غالبا ما تتطلب إصلاحات من خلال مسارات تحتوي على (بي ار سي أ1) و (بي ار سي أ2).[74][75] ومع ذلك، الطفرات في جينات (بي ار سي أ) تمثل 2 إلى 3٪ فقط من جميع سرطانات الثدي.[76] ليفين ات ال يقول أن السرطان قد لا يكون محتوم لجميع ناقلي طفرات (بي ار سي أ1) و (بي ار سي أ2).[77] ما يقرب من نصف متلازمات الثدي-المبيض الوراثية تتضمن جينات مجهولة. تسيطر (جاتا3) بشكل مباشر على إظهار مستقبلات هرمون الاستروجين والجينات الأخرى المرتبطة بتمايز الخلايا الظهارية، فقدان (جاتا3) يؤدي إلى فقدان القدرة على التمايز وتوقعات سير علاج سيئة بسبب غزو الخلايا السرطانية والسرطان النقيلي.[78]
التشخيص

من السهل تشخيص معظم أنواع سرطان الثدي عن طريق التحليل المجهري لعينة أو خزعة مأخوذة من المنطقة المصابة من الثدي. مع ذلك، هناك أنواع نادرة من سرطان الثدي تتطلب طرق تشخيص مخبرية متخصصة.
هناك طريقتين للفحص يعدان الأكثر استخداماً، الأولى الفحص البدني للثدي من قبل مقدم الرعاية الصحية والثانية عن طريق جهاز الماموغرام (التصوير الشعاعي للثدي)، يمكن لهاتين الطريقتين أن تقدمان احتمال تقريبي ما إذا كانت الكتلة سرطانية أم لا، أيضا من الممكن أن تكشفان عن بعض الأمراض الأخرى، مثل وجود كيس بسيط.[79] عندما تكون هذه الفحوصات غير حاسمة، يمكن لمقدم الرعاية الصحية أخذ عينة من السائل الموجود في الكتلة لتحليلها مجهرياً (هذه العملية تعرف باسم خزعة مسحوبة بالإبرة) للمساعدة في تثبيت التشخيص. يتم تنفيذ هذه العملية في عيادة أحد مقدمي الرعاية الصحية باستخدام مخدر موضعي إذا لزم الأمر. إذا وُجد السائل صافٍ فإنه من المستبعد جدا أن تكون الكتلة سرطانية، أما إذا وُجد في السائل دم يتم إرسال العينة لفحصها تحت المجهرللبحث عن ما إذا كان هناك خلايا سرطانية. يُعطي استخدام الطرق الثلاثة (الفحص البدني، التصوير الإشعاعي وأخذ خزعة) نتائج عالية الدقة في تشخيص سرطان الثدي. هناك خيارات أخرى لأخذ خزعة من الثدي للتشخيص مثل: خزعة اللبأ وخزعة الثدي بمساعدة الشافط؛[80] حيث يتم فيها إزالة جزء من الكتلة الموجودة في الثدي، أو خزعة شاملة؛ حيث يتم فيها إزالة الكتلة كاملة من الثدي. في كثير من الأحيان نتائج الفحص البدني من قبل مقدم الرعاية الصحية، واستخدام جهاز الماموغرام (التصوير الشعاعي للثدي)، والاختبارات الإضافية التي يمكن القيام بها في ظروف خاصة (مثلا لتصوير بالموجات فوق الصوتية أو التصوير بالرنين المغناطيسي) هي كافية لضمان إجراءخزعة شاملة كتشخيص نهائي وعلاج أولي لسرطان الثدي.
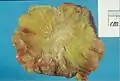 استئصال أنسجة الثدي الإنسان، والتي تبين وغير النظامية، كثيفة، منطقة النجمية البيضاء من السرطان 2 سم في القطر، داخل الأنسجة الدهنية الصفراء..
استئصال أنسجة الثدي الإنسان، والتي تبين وغير النظامية، كثيفة، منطقة النجمية البيضاء من السرطان 2 سم في القطر، داخل الأنسجة الدهنية الصفراء..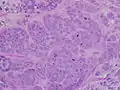 سرطان الأقنية الغازية عالية الجودة ، مع تشكيل الحد الأدنى من أنبوب صغير، تعدد الأشكال ملحوظ، و الانقسام بارزة، 40X المجال.
سرطان الأقنية الغازية عالية الجودة ، مع تشكيل الحد الأدنى من أنبوب صغير، تعدد الأشكال ملحوظ، و الانقسام بارزة، 40X المجال.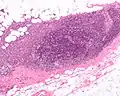 صورة مجهرية تظهر العقدة الليمفاوية غزت بواسطة الأقنية سرطان الثدي، مع تمديد الورم خارج العقدة الليمفاوية.
صورة مجهرية تظهر العقدة الليمفاوية غزت بواسطة الأقنية سرطان الثدي، مع تمديد الورم خارج العقدة الليمفاوية._expression_in_normal_breast_and_breast_carcinoma_tissue.jpg.webp) التعبير Neuropilin-2 في الثدي الطبيعي والأنسجة سرطان الثدي.
التعبير Neuropilin-2 في الثدي الطبيعي والأنسجة سرطان الثدي.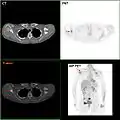 F-18 FDG PET / CT: A انبثاث سرطان الثدي للوح الكتف الأيمن
F-18 FDG PET / CT: A انبثاث سرطان الثدي للوح الكتف الأيمن
التصنيف
سرطان الثدي يصنف إلى عدة درجات، تختلف بطريقة تقدم المرض والاستجابة للمعالجة، وصف سرطان الثدي يتضمن جميع الدرجات وخصائصها
- التدريج: يقارن بين مظهر الخلايا السرطانية في الثدي ومظهر أنسجة الثدي الطبيعية. الخلايا الطبيعية في أي عضو مثل الثدي تتمايز، بمعني أنها تأخذ أشكال محددة حيث تعكس وظيفتها كجزء من هذا العضو. الخلايا السرطانية تفقد هذا التمايز. في السرطان، الخلايا التي تبطن قنوات الحليب بتنظيم وترتيب معين تصبح غيرمنظمة. يصبح انقسام الخلايا خارج عن السيطرة. أيضًا نواة الخلية تصبح غير منتظمة. صنف علم الأمراض الخلايا المتمايزة (مستوى منخفض)، متمايزة إلى حدما (مستوى متوسط)، وضعيفة التمايز (مستوى عالي) حيث تفقد الخلايا تدريجيًا قدرتها على التمايز كما في الخلايا الطبيعية. السرطان ذو الخلايا الأقل تمايزاً (تلك التي تكون الأنسجة فيها أقل شبهاً لأنسجة الثدي الطبيعية) لديه أسوأ توقعات طبية لسير المرض.[81]
- المراحل: يعتمد تطور سرطان الثدي على 3 فئات ضمن نظام معين هي: (1) حجم الورم، (2) ما إذا كان الورم قد انتشر إلى الغدد الليمفاوية في الإبط، (3) إذاكان الورم قد انتشر (أي انتشار إلى أجزاء أخرى من الجسم غير مكانه الأصلي وهو الثدي). إذا كان الورم كبير الحجم، وانتشار الورم قد وصل الغدد الليمفاوية، بالإضافى ة لانتشار السرطان في أجزاء أخرى من الجسم يكون لدى الشخص المصاب مراحل متقدمة كثيرة للمرض بحيث تكون التوقعات الطبية لسير المرض أسوأ.
- المراحل الرئيسية:
- المرحلة 0 هي مرحلة قبل سرطانية تتمثل بوجود إما سرطان الأقنية أو سرطان في غدد الثدي.
- المرحلة من 1-3 تكوّن سرطان ضمن الثدي أو الغدد الليمفية الخاصة بمنطقة الثدي.
- المرحلة 4 هي مرحلة سرطان الثدي النقيلي الذي لديه أسؤأ توقعات طبية للمرض.
 مرحلة T1 في سرطان الثدي
مرحلة T1 في سرطان الثدي مرحلة T2 في سرطان الثدي
مرحلة T2 في سرطان الثدي مرحلة T3 في سرطان الثدي
مرحلة T3 في سرطان الثدي
حيثما كان ذلك متاحاً، يجوز استخدام دراسات وفحوصات التصوير (الحصول على صور لداخل جسم الإنسان) كجزء من عملية التدريج في حالات معينة للبحث عن علامات انتشار السرطان في أماكن أخرى من الجسم. ومع ذلك، في الحالات التي يكون فيها الشخص مصاب بسرطان الثدي لكن احتمالية انتشاره لأجزاء أخرى من الجسم قليلة، ممكن أن تزيد إذا تم تصوير المريض بجهاز التصوير المقطعي بالإصدار البوزيتروني، ماسحا لأشعة المقطعية، أوماسحا للعظام، حيث أن هذه الفحوصات تعرض المريض لكمية كبيرة من الإشعاع المؤين الخطير.[82][83]
- وضع المستقبلات. خلايا سرطان الثدي لديها مستقبلات على سطحها وفي السيتوبلازم والنواة. الرسل الكيميائية مثل الهرمونات ترتبط بالمستقبلات، وهذا يسبب تغيرات في الخلية. من الممكن وجود ثلاثة مستقبلات هامة لخلايا سرطان الثدي: مستقبلات هرمون الاستروجين، مستقبلات هرمون البروجسترون، ومستقبلات هير2.
الخلايا السرطانية أي ار+ (أي الخلايا السرطانية التي تمتلك مستقبلات هرمون الاستروجين) تعتمد على هرمون الاستروجين لنموها، حيث يمكن علاجها بأدوية تمنع تأثير هرمون الاستروجين (مثل عقار تاموكسيفين)، وعموما لديهم أفضل توقعات طبية للمرض. سرطان الثدي (هير2+) عادة يكون أكثرعدوانية من سرطان الثدي (هير2-)،[84][85] ولكن الخلايا السرطانية (هير2+) تستجيب لأدوية مثل تراستوزوماب الذي هو عبارة عن أجسام مضادة وحيدة النسيلة (بالاشتراك مع العلاج الكيميائي التقليدي)، وهذا أدى إلى تحسين التوقعات الطبية للمرض بشكل كبير.[86] الخلايا التي لا تحتوي عل أي من الثلاث مستقبلات (مستقبلات هرمون الاستروجين، مستقبلات هرمون البروجستيرون، ومستقبلات هير2) تسمى ثلاثية-سلبية، على الرغم من أنها كثيرا ما تُظهرمستقبلات لهرمونات أخرى، مثل مستقبلات هرمون الاندروجين وهرمون البرولاكتين. فحوصات الحمض النووي. اختبار أنواع مختلفة من الأحماض النووية، بما في ذلك ميكرو أرس، تمت فيه المقارنة بين الخلايا الطبيعية للثدي وخلايا سرطان الثدي. التغييرات المعينة في خلايا سرطان الثدي يمكن أن تستخدم لتصنيف السرطان في العديد من الطرق، ويمكن أن تساعد في اختيارالعلاج الأكثر فعالية لهذا النوع من الحمض النووي.
 مرحلة 1A في سرطان الثدي
مرحلة 1A في سرطان الثدي مرحلة 1B في سرطان الثدي
مرحلة 1B في سرطان الثدي مرحلة 2A في سرطان الثدي
مرحلة 2A في سرطان الثدي مرحلة 2A في سرطان الثدي
مرحلة 2A في سرطان الثدي مرحلة 2B في سرطان الثدي
مرحلة 2B في سرطان الثدي مرحلة 2B في سرطان الثدي
مرحلة 2B في سرطان الثدي مرحلة 2B في سرطان الثدي
مرحلة 2B في سرطان الثدي مرحلة 3A في سرطان الثدي
مرحلة 3A في سرطان الثدي مرحلة 3A في سرطان الثدي
مرحلة 3A في سرطان الثدي مرحلة 3A في سرطان الثدي
مرحلة 3A في سرطان الثدي مرحلة 3B في سرطان الثدي
مرحلة 3B في سرطان الثدي مرحلة 3B في سرطان الثدي
مرحلة 3B في سرطان الثدي مرحلة 4 في سرطان الثدي
مرحلة 4 في سرطان الثدي
الوقاية
نمط الحياة
يمكن للنساء أن يقللن من خطر الإصابة بسرطان الثدي من خلال المحافظة على وزن صحي، وتقليل شرب الكحول، وممارسة الرياضة، وإرضاع أطفالهم طبيعياً.[87] هذه التعديلات على نمط الحياة قد يمنع 38٪ من حالات سرطان الثدي في الولايات المتحدة، و 42٪ في المملكة المتحدة، و 28٪ في البرازيل و 20٪ في الصين. قد تنعكس فوائد ممارسة الرياضة المعتدلة مثل المشي السريع على جميع الفئات العمرية بما في ذلك النساء بعد سن اليأس.[88] ويبدو أن الأحماض الدهنية غير المشبعة أوميغا 3 تقلل من احتمالية الإصابة.[89] أداء التمارين الرياضية قد يقلل أيضا من احتمالية الإصابة بأمراض القلب والسكري.[26] الاستهلاك العالي للاطعمة التي اساسها الصويا يمكن ان يقلل خطر الإصابة .[90]
الجراحة الوقائية
من أنواع الوقاية أيضاً، إزالة كلا الثديين قبل تشخيص السرطان أو قبل ظهور أي كتلة أو أمراض أخرى في الثدي (وهو إجراء يعرف باسم استئصال الثدي الوقائي الثنائي) يتم للأشخاص الذين يعانون من طفرات في جينات معينة، حيث تكون احتمالية الإصابة بسرطان الثدي لديهم كبيرة.[91][92] لا تعدّ الأدلة قوية بما يكفي لدعم هذه العملية (استئصال الثديين) في أي شخص ولكنها قوية كفاية للأشخاص الذين احتمالية الإصابة بسرطان الثدي لديهم كبيرة.[93] ويوصى إجراء اختبار لجينات معينة في أولئك الذين لديهم احتمالية الإصابة مرتفعة بسبب الوراثة (طفرات في جينات معينة) بعدالاستشارة الوراثية لكن لا ينصح فيها بشكل روتيني، [94] وذلك لأنها كالعديد من الأشكال المختلفة للتغيرات التي تحدث في جينات معينة، بدءا من الأشكال غيرالضارة (بوليمورفيزيمز) إلى حدوث طفرات انزياح خطيرة في الأشخاص المصابين بسرطان الثدي في أحدهما، لم يتضح بعد ما إذا كان استئصال الثدي الآخر (السليم) يعود بالفائدة.[93]
الأدوية
مستقبلات هرمون الاستروجين الانتقائية (مثل عقار تاموكسيفين) يقلل من احتمالية الإصابة بسرطان الثدي ولكن يزيد من خطر الإصابة بالجلطات الدموية وسرطان بطانة الرحم، ولكن لا يوجد تغيير في احتمالية الوفاة.[95][96] بالتالي لا ينصح باستخدامهم للوقاية من سرطان الثدي لدى النساء ذواتى احتمالية الإصابة المتوسطة بسرطان الثدي لكن من الممكن إعطائهم للنساء ذوات احتمالية إصابة عالية.[97] إن فوائد الحد من سرطان الثدي تستمر لمدة خمس سنوات على الأقل بعد توقف البرنامج العلاجي الذي يشمل هذه الأدوية.[98]
الفحص

يتم فحص نساء سليمات في محاولة للتوصل إلى تشخيص مبكر في ظل افتراض أن الكشف المبكر سيحسن النتائج. وقد تم استخدام عدد من اختبارات المسح بما في ذلك: الفحوصات السريرية والذاتية للثدي، واستخدام جهاز الماموغرام (تصوير الثدي الشعاعي)، والفحص الجيني، والموجات فوق الصوتية، والتصوير بالرنين المغناطيسي. الفحص السريري أو الذاتي يتضمن تحسس الثدي لاكتشاف كتل أوشواذ أخرى. يتم إجراء فحص الثدي السريري من قبل مقدمي الرعاية الصحية، في حين يتم إجراء الفحوصات الذاتية للثدي من قبل الشخص نفسه.[99] الأدلة غير كافية لدعم فعالية هذا النوع من فحوصات الثدي، مع مرور الوقت تكون الكتلة قد زاد حجمها بما فيه الكفاية ليتم العثور عليها من غير فحص حيث من المرجح ان تكون قد بدأت بالنمو من عدة سنوات.[100][101] يستخدم جهاز الماموغرام (فحص تصوير الثدي الشعاعي) الأشعة السينية لفحص الثدي وكشف ما إذا كان هناك أي كتلة. خلال الفحص بجهاز الماموغرام يكون الثدي مضغوط ويقوم متخصص بأخذ صور للثدي من زوايا متعددة. الماموغرام العام يأخذ صورللثدي بأكمله، في حين يركّز الماموجرام التشخيصي على ورم معين أو منطقة معينة مثيرة للقلق.[102] هناك عدد من الهيئات الوطنية توصي على فحص سرطان الثدي. للمرأة المتوسطة، توصي فرقة الخدمات الوقائية الأمريكية التصوير الشعاعي للثدي مرة كل سنتين في النساء الذين تتراوح أعمارهم بين 50 و 74، [9] ويوصي مجلس أوروبا التصوير الشعاعي للثدي للنساء اللاتي تتراوح أعمارهم بين 50 و 69 كل سنتين، [103] وفي كندا يوصى الفحص للذين تتراوح أعمارهم بين 50 و 74 كل 2 إلى 3 سنوات.[104] تشير هذه التقارير إلى أنه بالإضافة إلى الجراحة التي لا داعي لها والقلق، مخاطر تصوير الثدي بالأشعة السينية بكثرة يزيد نسبة احتمالية الإصابة بسرطان الثدي الناجمة عن الإشعاع.[105] أقر تعاون كوكرين (2013) على أن أفضل نوعية الأدلة لا يدل على انخفاض في سرطان معين، ولا انخفاض في معدل الوفيات من فحص التصوير الشعاعي للثدي.[7] عند إضافة تجارب أقل دقة للتحليل وُجد أن هناك انخفاض في معدل الوفيات بسبب سرطان الثدي بنسبة 0.05٪ (أي بانخفاض قدره 1 من 2000 حالة وفاة بسبب سرطان الثدي خلال 10 سنوات أو انخفاض نسبي بنسبة 15٪ من سرطان الثدي).[7] الفحص لأكثر من 10 سنوات، أسفر عن زيادة 30٪ في معدلات الإفراط بالتشخيص والعلاج أكثر من اللازم (3 إلى 14 لكل 1000)، وأكثر من النصف سوف يحصل على فحص واحد على الاقل بنتيجة ايجابية كاذبة.[7][106][107] وقد أدى ذلك إلى رأي مفاده أنه ليس من الواضح ما إذا كان التصوير الإشعاعي له نتائج جيدة أكثر ام اذى.[7] تنص كوكرين ان بسبب التحسينات الأخيرة في علاج سرطان الثدي، واحتمال الحصول على نتيجة ايجابية كاذبة من فحص سرطان الثدي الذي يؤدي إلى بدء علاج غير لازم، "أنه بالتالي لم يعد من المنطقي الخضوع لفحص الكشف عن سرطان الثدي في أي عمر[108] "، سواء التصوير بالرنين المغناطيسي كوسيلة من وسائل الفحص التي لم يعرف ما إذا كانت لديها أضرار أكثرأم فوائد مقارنةً بجهاز الماموغرام (التصوير الشعاعي للثدي).[109]
إدارة وتدبير المرض
إدارة سرطان الثدي تعتمد على عوامل مختلفة، بما في ذلك مرحلة السرطان وعمر المريض. يتم إعطاء علاج متزايد القوة للأشخاص المصابين بسرطان الثدي ذو التوقعات الطبية السيئة لسير المرض والأشخاص الذين تكون احتمالية عودة السرطان بعد العلاج عالية. عادة ما يتم علاج سرطان الثدي عن طريق الجراحة، والتي يمكن أن يتبعها العلاج الكيميائي أو العلاج الإشعاعي أو كليهما. إن استخدام طريقة علاج متعددة التخصصات هي الأفضل.[110] عادة ما يُعالج مستقبل الهرمون-إيجابي السرطان عن طريق إعطاء علاج حجب الهرمون لعدة سنوات. يمكن إعطاء الأجسام المضادة وحيدة النسيلة، أو غيرها من علاجات تعديل المناعة، كعلاج في حالات معينة من سرطان الثدي النقيلي أو بمراحل متقدمة من سرطان الثدي.
الجراحة

تنطوي الجراحة على إزالة الورم، بالإضافة إلى إزالة جزء من الأنسجة المحيطة به. يتم فحص واحد أو أكثر من الغدد الليمفية أثناء الجراحة؛ حيث يتم أخذ عينة من العقد الليمفية عن طريق أخذ خزعة. تشمل العمليات الجراحية الأساسية:
- استئصال الثدي: إزالة الثدي بأكمله
- Quadrantectomy: إزالة ربع من الثدي
- استئصال الورم: إزالة جزء صغير من الثدي.
بعد إزالة الورم، في حالة رغب المريض، يتم إجراء جراحة إعادة بناء للثدي، وهي نوع من أنواع الجراحة التجميلية، حيث يتم بعدها تحسين المظهر الجمالي للموقع المعالج. بدلا من ذلك، يمكن للمرأة استخدام ثدي صناعي لمحاكاة الثدي الطبيعي تحت الملابس، أو أن تختار بقاء الصدر مسطح. يمكن استخدام الحلمة / الهالة الصناعية في أي وقت بعد استئصال الثدي.
العلاج والمداواة
تسمى العقاقير المستخدمة بعد الجراحة وبالإضافة إليها: العلاج المساعد. يسمى العلاج الكيميائي أو أنواع أخرى من العلاج المستخدمة قبل الجراحة علاج المواد الجديدة المساعدة. الأسبرين قد يقلل من معدلا لوفيات الناجمة عن سرطان الثدي.[111] هناك حاليا ثلاث مجموعات رئيسية من الأدوية المستخدمة كمواد مساعدة (العلاج المساعد) لعلاج سرطان الثدي: مواد تحجب الهرمون، العلاج الكيميائي، والأجسام المضادة وحيدة النسيلة.
العلاج بحجب الهرمون بعض سرطانات الثدي تتطلب هرمون الاستروجين لمواصلة النمو. يمكن لخلايا السرطان التعرف عليه من خلال وجود مستقبلات هرمون الاستروجين ومستقبلات هرمون البروجسترون على سطحها (يُعرف كلاهما معاً بـمستقبلات الهرمون). يمكن علاج هذه السرطانات التي تعتمد على الهرمون بالأدوية التي إما تسد المستقبلات مثال عقار تاموكسيفين، أو بدلا من ذلك منع إنتاج هرمون الاستروجين عن طريق مثبطات انزيم الاروماتيز، مثل عقار ياناستروزول[112] أو يتروزول. يوصى استخدام عقار تاموكسيفين لمدة 10 أعوام.[113] تُعد مثبطات انزيم الارومتيز مناسبة فقط للنساء اللواتي انقطع الطمث لديهم؛[114] وذلك لأن انزيم الاروماتيزالنشط في النساء بعد سن اليأس تختلف عن النموذج السائد في النساء قبل انقطاع الطمث، وبالتالي تعدّ هذه العقاقيرغيرفعالة في تثبيط انزيم الاروماتيزالغالب في النساء قبل انقطاع الطمث.[115]
العلاج الكيميائي يستخدم العلاج الكيميائي في الغالب لحالات سرطان الثدي في المراحل 2-4، ويكون مفيد بشكل خاص لمرض مستقبلات الاستروجين السلبية. عادة ما يُعطى العلاج الكيميائي مع علاجات أخرى، لمدة من 3-6 أشهر. واحدة من التركيبات الأكثرشيوعا، هي إعطاء سيكلوفو سفاميد معد وكسوروبيسين. في بعض الأحيان يتم إضافة دواء التاكسين، مثل دوكيتاكسل (تاكسوتير) للعلاج الكيميائي. سيكلوفوسفاميد، ميثوتريكسات، والفلورويوراسيل هي تركيبة أخرى معروفة. معظم أدوية العلاج الكيميائي تعمل على تدمير خلايا السرطان التي تنمو سريعا و / أو تتكاثرسريعا، إماعن طريق التسبب في تلف الحمض النووي أو غيرها من الآليات. ومع ذلك، فإن هذه الأدوية تقوم بتدميرالخلايا الطبيعة سريعة النمو، والتي قد تتسبب في آثار جانبية خطيرة. على سبيل المثال، تلف في عضلة القلب هو من أكثرالمضاعفات الخطيرة للدوكسوروبيسين.
الأجسام المضادة وحيدة النسيلة تراستوزوماب، هو جسم مضاد وحيد النسيلة لمستقبلات هير2 (مستقبلات تنشط في بعض خلايا سرطان الثدي)، حسّن نسبة البقاء لمدة 5 سنوات مع سرطان الثدي للمراحل من 1-3 بنسبة 87٪ (اجمالي نسبة البقاء على قيد الحياة 95٪).[116] عند وجود محفزات نمو معينة، تتسبب مستقبلات هير2 فينمو الخلايا السرطانية وانقسامها. في حالة غياب عوامل التحفيز فإن الخلية تتوقف عن النمو. بين 25٪ و 30٪ من سرطانات الثدي تقوم فيها الخلايا السرطانية بصناعة البروتينات الخاصة بمستقبلات هير2 بكمية كبيرة جدا ،[117] هذا يؤدي إلى تقدم المرض لمراحل أسوأ أيضا تكون تنبؤات سير المرض الطبية أسوأ. عندما يتحد دواء تراستوزوماب مع هير2 (مسؤولة عن إبراز المتقبلات)في خلايا سرطان الثدي، يمنع هذا الاتحاد عوامل النمو من أن ترتبط بالمستقبلات وتحفزها، بالتالي يمنع نموالخلايا السرطانية بشكل فعال. مع ذلك، يعدّ دواء تراستوزوماب غالي، ويمكن أن يسبب استخدامه آثار جانبية خطيرة (حوالي 2٪ من المرضى الذين يستخدمونه يعانون من تلف كبير في القلب).[118] وعلاوة على ذلك، تراستوزومابلا يكون فعالإ في المرضى الذين يعانون من إنتاج هير2 بكميات كبيرة.
الإشعاع

يعطى العلاج الإشعاعي بعد الجراحة لمنطقة الورم والغدد الليمفاوية في نفس المنطقة، لتدمير الخلايا السرطانية المجهرية التي من لم يتم التخلص منها أثناء الجراحة.[119][120] من الممكن أن يتم نقل الإشعاع في العلاج الإشعاعي بطريقتين، العلاج بالإشعاع الخارجي أو العلاج بالإشعاعي الموضعي (العلاج الإشعاعي الداخلي). يعطى العلاج الإشعاعي التقليدي بعد القيام بعملية لسرطان الثدي. ويمكن أيضا إعطاء الإشعاع أثناء القيام بالعملية.عُرفت أكبر تجربة عشوائية لاختبار هذا الإجراء ب (تار-جيت)[121] التي وجدت أن العلاج الإشعاعي أثناء العملية يعطي فعالية لمدة 4 سنوات تساوي فاعلية العلاج بالإشعاع الخارجي المعتاد لمدة بضعة أسابيع.[122] يقلل الإشعاع من خطر رجوع المرض بنسبة 50-66٪ عند إعطاء الجرعة الصحيحة، [123] ويعدّ الإشعاع ضروري عند ما يتم معالجة سرطان الثدي عن طريق إزالة الكتلة فقط (استئصال الورم).
توقعات سير العلاج
توقعات سير العلاج يعطي بالعادة احتمالية البقاء على قيد الحياة أو البقاء على قيد الحياة الخالية من الأمراض. وتستند هذه التوقعات على تجربة مع مرضى سرطان الثدي بتصنيف مماثل. توقعات سير العلاج هي تقدير، حيث أن المرضى الذين يعانون من نفس التصنيف سوف يبقون على قيد الحياة لفترات مختلفة من الزمن، لكن التصنيفات ليست دائما دقيقة. عادة يتم احتساب معدل البقاء على قيد الحياة كمتوسط عدد أشهر (أو سنوات) حيث أن 50 ٪ من المرضى ما زالوا على قيد الحياة، أو النسبة المئوية من المرضى الذين هم على قيد الحياة بعد 1، 5، 15، و 20 عاما. توقعات سير العلاج مهمة لقرارات العلاج لأن المرضى ذوي توقعات سير علاج جيدة عادة يقدم لهم علاجات أقل قوة، مثل استئصال الورم والإشعاع أو العلاج الهرموني، في حين عادة ما يتم تقديم للمرضى ذوي توقعات سيرعلاج سيئة معالجة أكثر قوة، مثل استئصال الثدي أو واحد أو أكثر من ادوية العلاج الكيميائي.
عوامل توقع سير العلاج
تنعكس عوامل توقع سير العلاج في مخطط تصنيف لسرطان الثدي بما في ذلك (1) المرحلة، (أي حجم الورم، والموقع، سواء كان المرض قد انتشر إلى الغدد الليمفاوية وأجزاء أخرى من الجسم)، (2) والدرجة، (3) وتكرار المرض، (4) والعمر (5) وصحة المريض. مؤشر نوتنغهام لتوقع سير العلاج هو أداة تشخيصية تستخدم بشكل شائع. مرحلة سرطان الثدي هو أهم عنصر من طرق التصنيف التقليدية لسرطان الثدي، لأنه له تأثير أكبر على توقع سير العلاج من العناصرالأخرى. تصنيف المرحلة يأخذ في الاعتبار الحجم، مدى انتشار المرض في المنطقة، ووضع العقدة الليمفاوية وما إذا كان سرطان الثدي النقيلي موجودا. كلما كانت المرحلة اعلى في التشخيص تكون توقعات سير العلاج أكثر سوءا. ويزداد تصنيف المرحلة كلما زاد غزو المرض إلى العقد الليمفاوية، جدار الصدر أو الجلد أو غير ذلك، أيضا كلما زادت عدوانية الخلايا السرطانية. ويقل تصنيف المرحلة عند وجود مناطق خالية من السرطان وعندما يكون سلوك الخلية اقرب إلى وضعها الطبيعي (التدرج). الحجم ليس عاملا في تصنيف المرحلة ما لم يكن السرطان غازي (يغزو المناطق المجاورة). على سبيل المثال، إن سرطان القنوات الموضعي الذي يشمل كامل الثدي يبقى تصنيفه في مرحلة الصفر، وبالتالي توقعات سير العلاج ممتازة حيث تكون نسبة البقاء على قيد الحياة 98% لمدة 10 سنوات خالية من المرض.[124]
- سرطانات المرحلة الأولى (سرطان القنوات الموضعي وسرطان الفصيص (الغدد) الموضعي) توقعات سير العلاج لها ممتازة ويتم بشكل عام علاجها باستئصال الورم والإشعاع في بعض الأحيان.[125] ينبغي أن تعالج سرطانات هير2+ بدواء التراستوزوماب (هيرسيبتين).[126] العلاج الكيميائي غير شائع بالنسبة للأنواع الأخرى من سرطانات المرحلة الأولى.
- سرطانات المرحلة 2 و 3 ذات توقعات سير العلاج أسوأ واحتمالية عودة المرض أكبر، تعالج بشكل عام من خلال الجراحة (استئصال الورم أو استئصال الثدي مع أو بدون إزالة العقدة الليمفاوية)، العلاج الكيميائي (زائد تراستوزوماب لسرطانات هير+2)، وأحيانا الإشعاع (خصوصا بعد السرطانات الكبيرة، متعددة العقد الإيجابية أو استئصال الورم).
- المرحلة 4، السرطان النقيلي (أي ينتشر في اماكن بعيدة عن مكانه الأصلي وهو الثدي) لديه توقعات سير علاج سيئة ويعالج من خلال مجموعة مختلفة من جميع العلاجات من جراحة وإشعاع وعلاج كيميائي والعلاجات المستهدفة. معدل البقاء على قيد الحياة لمدة 10 سنوات هو 5٪ دون علاج و 10٪ مع العلاج الأمثل.[127]
ويتم تحديد درجة سرطان الثدي عن طريق المقارنة بين خلايا سرطان الثدي وخلايا الثدي الطبيعية. كلما كانت خلايا السرطان أقرب إلى وضعها الطبيعي كان نموها أبطأ وتوقعات سير العلاج أفضل. إذ لم تكن الخلايا متمايزة بشكل جيد، سوف تظهر غير ناضجة، وسوف تنقسم بسرعة أكبر، وسوف تميل إلى الانتشار. الخلايا جيدة التمايز تأخذ درجة 1، المعتدلة التمايز تأخذ درجة 2، بينما تأخذ قليلة أو الغير متمايزة درجة أعلى 3 أو 4 (اعتمادا على المقياس المستخدم). أكثر نظام درجات استخداما على نطاق واسع هو مخطط نوتنغهام[128]؛ حيث يقدم التفاصيل في مناقشة درجة سرطان الثدي. وجود مستقبلات هرموني الاستروجين والبروجستيرون في الخلايا السرطانية مهم في العلاج التوجيهي. وأولئك الذين لا تكون نتيجة اختبارهم لهذه المستقبلات المحددة ايجابية لا يكونوا قادرين على الاستجابة للعلاج الهرموني، وهذا يمكن أن يؤثر على فرصهم في البقاء على قيد الحياة اعتمادًا على ما تبقى من خيارات للعلاج، ونوع السرطان بالتحديد، ومدى تقدم المرض بالإضافة إلى مستقبلات الهرمون، هناك غيرها من بروتينات سطح الخلية التي قد تؤثر على توقعات سير المرض والعلاج. وضع بروتين هير2 يوجه مسار العلاج. المرضى الذين يعانون من خلايا سرطان إيجابية ل هير2 لديهم مرض أكثر عدوانية ويمكن ان تعالج من خلال 'العلاج المستهدف"، تراستوزوماب (هيرسيبتين)، والأجسام المضادة وحيدة النسيلة التي تستهدف هذا البروتين وتحسن توقعات سير المرض بشكل ملحوظ. النساء الأصغر سنا تميل إلى أن تكون توقعات سير المرض لها اسوأ من النساء في سن انقطاع الطمث بسبب عدة عوامل. قد تتغير صدورهن مع دورات الحيض، قد يكونوا مرضعات لاطفال، وقد لا يكونوا على علم بالتغيرات التي تحدث في صدورهم. ولذلك، النساء الأصغر سنا عادة ما تكون في مرحلة أكثر تقدما عند تشخيصها. قد يكون هناك أيضا عوامل بيولوجية تساهم في ارتفاع خطر عودة المرض للنساء الشابات المصابات بسرطان الثدي.[129][130] ارتفاع كثافة الثدي بالصور المأخوذه بجهاز الماموغرام، هو علامة لزيادة احتمالية الإصابة بسرطان الثدي، قد لا تعني زيادة احتمالية الوفاة بين مرضى سرطان الثدي، وفقا لتقرير عام 2012 لدراسة شملت 9232 امرأة من قبل المعهد الوطني للسرطان بما أنه يتم الكشف عن سرطان الثدي في الذكور في مراحل متأخرة، فالنتائج عادة ما تكون أسوأ.[131]
الجوانب النفسية
التأثير العاطفي لتشخيص مرض السرطان، والأعراض، والعلاج، والقضايا ذات الصلة يمكن أن تكون كبيرة. وترتبط معظم المستشفيات الكبيرة مع مجموعات لدعم السرطان التي توفر بيئة لمساعدة المرضى على التعامل مع المرض والنظر في قصص الناجين من مرض السرطان. لا يعيش كل مرضى سرطان الثدي تجربة المرض بنفس الطريقة. عوامل مثل السن يمكن أن يكون لها تأثير كبير على طريقة المريض في التعايش مع تشخيص سرطان الثدي. النساء في مرحلة ما قبل انقطاع الطمث عندما يصبن بسرطان الثدي الإيجابي لمستقبلات هرمون الاستروجين يجب ان يواجهن مشاكل انقطاع الطمث المبكر الناجم عن العديد من انظمة العلاج الكيميائي المستخدمة لعلاج سرطان الثدي، وخاصة تلك التي تستخدم هرمونات إبطال وظيفة المبيض.[132] من ناحية أخرى، أشارت دراسة صغيرة عام 2007 أجراها باحثون في كلية الصحة العامة في جامعة جورجيا أن هناك حاجة إلى اهتمام أكبر في تعزيز أداء ونفسية الناجين من مرض السرطان ذوي سن متقدم، حتى عندما لا يكون لديهم مضاعفات طبية واضحة ذات صلة بالسرطان.[133] وجدت الدراسة أن الناجيات من سرطان الثدي الأكبر سنا أظهرن مؤشرات متعددة من التناقضات في نوعية حياتهم ذات الصلة بالصحة ، وأقل صحة نفسة اجتماعية من المجموعة المقارن بها.لم يسجل الناجون أعراض الاكتئاب أو القلق أكثر من المجموعة المقارن بها ، إلا أنهم سجلوا أقل في القياسات الإيجابية للصحة النفسية الاجتماعية، وسجلوا مزاج أكثر اكتئابا وأيام متضررة من التعب. بما ان احتمالية الإصابة بسرطان الثدي لدى النساء أكثر من 50 عاما بارتفاع وأن معدلات البقاء على قيد الحياة بارتفاع أيضا، أصبح سرطان الثدي مشكلة من مشاكل الشيخوخة التي تتطلب مزيد من البحوث والتوسع في خدمات دعم السرطان المتخصصة بحيث تكون مصممة خصيصا لفئات عمرية محددة.[133]
علم الأوبئة

no data
<2
2–4
4–6
6–8
8–10
10–12
|
12–14
14–16
16–18
18–20
20–22
>22
|
في جميع أنحاء العالم، سرطان الثدي هو السرطان الأكثر شيوعا في النساء. يؤثر على حوالي 12 % من النساء في العالم . (الشكل الأكثر شيوعا من السرطان هو سرطان الجلد الغير غازي الغير قتامي، عادة تكون السرطانات الغير غازية سهلة الشفاء ، تسبب وفيات قليلة جدا، ويتم استبعادها بشكل مستمر من إحصاءات السرطان.) يشكل سرطان الثدي 22.9٪ من السرطانات الغازية في النساء [135] و 16٪ من جميع سرطانات الإناث.[136] في عام 2012، شكل 25.2٪ من السرطانات التي شخصت في النساء، مما يجعله السرطان الأكثر شيوعا في الإناث.[137]
في عام 2008، تسبب سرطان الثدي بـ 458503 حالة وفاة في جميع أنحاء العالم (13.7٪ من وفيات السرطان من النساء و 6.0٪ من مجموع وفيات السرطان من الرجال والنساء معا).[135] سرطان الرئة، السبب الثاني الأكثر شيوعا للوفاة المتعلقة بالسرطان لدى النساء، سبب 12.8٪ من وفيات السرطان في النساء (18.2٪ من مجموع وفيات السرطان من الرجال والنساء معا)[135] حالات الإصابة بسرطان الثدي تختلف إلى حد كبير في جميع أنحاء العالم: فهي أقل في البلدان الأقل تطورا وأكثر في البلدان الأكثر تطورا. في مناطق العالم الإثني عشر، معدلات الإصابة السنوية في سن موحد لكل 100000 امرأة هي كما يلي: في شرق آسيا، 18 عاما; جنوب وسط آسيا، 22؛ أفريقيا جنوب الصحراء، 22؛ جنوب شرق آسيا، 26؛ شمال أفريقيا وغرب آسيا، 28؛ أمريكا الجنوبية والوسطى، 42؛ أوروبا الشرقية، 49؛ جنوب أوروبا، 56؛ أوروبا الشمالية، 73؛ أوقيانوسيا، 74؛ أوروبا الغربية، 78؛ وفي أمريكا الشمالية، 90.[[138]
عدد الحالات في جميع أنحاء العالم قد زاد بشكل ملحوظ منذ 1970م، وهي ظاهرة تعزى جزئيا إلى أنماط الحياة الحديثة.[139][140] يرتبط سرطان الثدي ارتباطا وثيقا مع العمر بنسبة 5٪ فقط من جميع سرطانات الثدي التي تحدث في النساء تحت سن 40 عاما.[141] كان هناك أكثر من 000,41 حالة سرطان ثدي تم تشخيصها حديثا مسجلة في انكلترا في عام 2011، حوالي 80٪ من هذه الحالات كانت في النساء في سن 50 أو أكثر.[142] بالرجوع إلى احصائيات عام 2005 يوجد حوالي 2.8 مليون امراة مصابة بسرطان الثدي.[143]
التاريخ
بسبب وضوحه، كان سرطان الثدي شكل من السرطان الذي يكون في معظم الأحيان موضح في الوثائق القديمة.[144] لأن تشريح الجثث كان نادرا، كانت سرطانات الأعضاء الداخلية بشكل خاص غير مرئية في الطب القديم. سرطان الثدي، يمكن تحسسه من خلال الجلد، وفي حالته المتقدمة في كثير من الأحيان تتطور إلى آفات كمئية: الورم يصبح نخريا (يموت من الداخل، مما يتسبب بظهور الورم منفصل)، يتقرح من خلال الجلد، وجود ذرف كريه الرائحة، وسائل قاتم.[144] تم اكتشاف أقدم دليل على سرطان الثدي في مصر في عام 2015، ويعود إلى الأسرة السادسة.[145] دراسة بقايا جثة المرأة في مقبرة قبة الهوا أظهرت الضرر النموذجي المدمر بسبب انتشار السرطان النقيلي.[145] ووصفت أوراق البردي لإدوين سميث 8 حالات أورام أو قرح من الثدي التي كانت تعالج بالكي. الكتابة تقول عن هذا المرض بأنه "لا يوجد علاج له".[146] لعدة قرون، وصف الأطباء حالات مماثلة خلال ممارساتهم الطب، مع ذكر نفس النتيجة. الطب القديم، منذ زمن الإغريق خلال القرن 17، استند على مذهب الأختلاط ، حيث أعتقد أن سبب سرطان الثدي عموما هو وجود عدم توازن في السوائل الأساسية التي تسيطرعلى الجسم، وخصوصا وجود فائض من الصفرة السوداء.[147] وبدلا من ذلك ، غالبا ما رأى المرضى أنها عقاب إلهي.[148] في القرن 18، اقترحت مجموعة واسعة من التفسيرات الطبية، بما في ذلك قلة النشاط الجنسي، والنشاط الجنسي أكثر من اللازم، الإصابات الجسدية للثدي، حليب الثدي رائب، وأشكال مختلفه من الانسدادات اللمفاوية سواء داخلية أو بسبب ملابس مقيدة.[149] وفي القرن 19، قال الجراح الإسكتلندي جون رودمان أن الخوف من السرطان تسبب بالسرطان، وأن هذا القلق، المتعلم عن طريق الأم على سبيل المثال، جعل ميل سرطان الثدي بأن يسري في العائلة.[149] على الرغم من أن سرطان الثدي كان معروفا في العصور القديمة لكنه كان غير شائعا حتى القرن 19، عندما أدت التحسينات في المرافق الصحية ومكافحة الأمراض المعدية المميتة في زيادة كبيرة في معدل العيش. في السابق، كانت معظم النساء تموت شابة جدا للإصابة بسرطان الثدي المتقدم.[149] بالإضافة إلى ذلك، الحمل المتكرر وفي وقت مبكر والرضاعة الطبيعية ربما خفضت معدل الإصابة بسرطان الثدي في النساء اللواتي بقين على قيد الحياة إلى منتصف العمر.[149] لأن الطب القديم يعتقد أن السبب كان جهازي بدلا من محلي، ولأن العملية الجراحية زادت من معدل الوفيات، كانت العلاجات تُفضل أن تكون دوائية بدلا من جراحية. المستحضرات العشبية والمعادن، وخصوصا استخدام الزرنيخ السام، كانت شائعة نسبيا. تم إجراء عملية استئصال الثدي لعلاج سرطان الثدي في وقت مبكر ك 548 قبل الميلاد، عندما اقترحت من قبل طبيب المحكمة إيتيوس من أميدا لثيودورا.[144] لم تجرى حتى حقق الأطباء فهم أكبر لنظام الدورة الدموية في القرن 17 حيث انهم يستطيعون ربط انتشار سرطان الثدي إلى العقد الليمفاوية في الإبط. وكان الجراح الفرنسي جان لويس بيتي (1674-1750) وبعد ذلك الجراح الإسكتلندي بنيامين بيل (1749-1806) أول من أزال الغدد الليمفاوية، أنسجة الثدي، وعضلات الصدر الأساسية.[150]
اكمل عملهم الناجح من قبل ويليام ستيوارت هالستيد الذي بدأ بإجراء عمليات استئصال ثدي جذرية في عام 1882، ساعده إلى حد كبير التقدم في التكنولوجيا الجراحية العامة، مثل تقنية التعقيم والتخدير. استئصال الثدي الجذري لهالستيد غالبا ما تضمن إزالة كلا الثديين، والعقد اللمفاوية المرتبطة بها، وعضلات الصدر الأساسية. هذا في كثير من الأحيان أدى إلى الألم على المدى الطويل والعجز، ولكن كان ينظر إليها على أنها ضرورية لمنع السرطان من العودة. قبل مجيء استئصال الثدي الجذري لهالستيد، كانت معدلات البقاء على قيد الحياة لمدة 20 سنة 10٪ فقط؛ زادت عملية جراحة هالستيد النسبة إلى 50٪. [[151] كامتداد لعمل هالستيد، جيروم ايربن روّج لعمليات جذرية لاستئصال الثدي ، بازالة المزيد من الأنسجة، وحتى عام 1963، عندما تبين أن معدلات البقاء على قيد الحياة لمدة عشر سنوات تساوي عملية استئصال الثدي الجذري الاقل ضررا.[152]
ظلت عمليات استئصال الثدي الجذرية المعيار للرعاية الصحية في أمريكا حتى 1970م، ولكن في أوروبا، كثيرا ما اتبعت إجراءات تتجنب الثدي تكون بعد العلاج الإشعاعي، واعتمدت بشكل عام في 1950. وأحد أسباب هذا الاختلاف اللافت للنظر في المنهجية قد يكون هيكل المهن الطبية: الجراحين الأوروبيين، ينحدرون من الجراح الحلاق، كان لهم تقديرا أقل من الأطباء. في أمريكا، كان الجراح ملك مهنة الطب بالإضافة إلى ذلك، كان هناك أكثر بكثير نساء أوروبيات جراحات: كان أقل من واحد في المئة من جراحي الاورام الامريكين من الإناث، ولكن بعض عنابر سرطان الثدي الأوروبية زادت الطاقم الطبي الذي كان نصفه من الإناث الجراحين. شركات التأمين الصحية في الولايات المتحدة كانت تدفع للجراحين لإجراء عمليات استئصال الثدي الجذرية أكثر من ما كانت تدفعه لإجراء العمليات الجراحية الأكثر تعقيدا التي تتجنب الثدي. تم تطوير أنظمة تدريج سرطان الثدي في 1920م و 1930م . خلال 1970م، الفهم الجديد للسرطان النقيلي أدى إلى إدراك السرطان كمرض جهازي ومحلي، ووضعت إجراءات أكثر اقتصادا للاعضاء التي أثبتت فعاليتها على حد سواء. العلاج الكيميائي الحديث ظهر بعد الحرب العالمية الثانية.[153]
الجراح الفرنسي برنار بيرلهي (1737-1804) حقق أول تجربة نقل للسرطان عن طريق حقن خلاصة من سرطان الثدي إلى حيوان. نساء بارزات توفوا من سرطان الثدي تشمل آن النمسا، والدة لويس الرابع عشر في فرنسا. ماري واشنطن، والدة جورج، وراشيل كارسون عالمة البيئة.[154] أجريت أول دراسة لحالة مضبوطة في علم الأوبئة لسرطان الثدي من قبل جانيت لين-كليبون، التي نشرت دراسة مقارنة في عام 1926 بين 500 حالة سرطان ثدي و 500 مريضا مضبوطين من نفس الخلفية ونمط الحياة لوزارة الصحة البريطانية.[155] في 1980م و 1990م، الآلاف من النساء الذين أكملوا العلاج المعياري بنجاح، طالبن وتلقوا جرعة عالية من زرع نخاع العظام، ظانين أنه سيؤدي إلى تحسين البقاء على المدى الطويل. ومع ذلك، اثبت انه غير فعال تماما، وأن 15-20٪ من النساء لقوا حتفهم بسبب العلاج القياسي.[156] تقاريرعام 1995 من دراسة لصحة الممرضات، واستنتاجات عام 2002 من مبادرة صحة المرأة أثبتت التجربة بشكل قاطع أن العلاج بالهرمونات البديلة تزيد بنسبة كبيرة من حالات الإصابة بسرطان الثدي.
المجتمع والثقافة
قبل القرن ال20، كان الناس يخشون سرطان الثدي وإذا أرادوا الحديث عنه كانوا يتحدثون بأصوات خافتة، كما لو كان شيء مخجل. كان حينها يمكن عمل شيء بسيط لمحاولة معالجة المرض باستخدام تقنيات جراحية بدائية، لذا كانت النساء تميل للمعاناة من المرض بصمت بدلا من طلب الرعاية والعلاج. عند تقدم الجراحة وارتفاع معدلات البقاء على قيد الحياة على المدى الطويل، بدأ الوعي للمرض ينتشر بين النساء وزادت إمكانية نجاح العلاج. كانت أحد أولى الحملات المنظمة للسيطرة على سرطان الثدي هي "جيش مجال المرأة"، التي تديرها الجمعية الأمريكية لمكافحة السرطان (في وقت لاحق جمعية السرطان الأمريكية) في الثلاثينيات والأربعينيات من القرن الماضي . في عام 1952، اُنشئت أول مجموعة دعم للنظير أطلق عليها "الوصول إلى الشفاء"، بدأت هذه المجموعة في تقديم الزيارات في المستشفى للنساء اللواتي نجون من سرطان الثدي بعد عملية استئصال الثدي.[157] كانت حركة مكافحة سرطان الثدي في 1980 و 1990 من أكبرالحركات النسوية وأكبر حركة صحة المرأة في القرن 20.[158] هذه السلسلة من الحملات السياسية والتعليمية كانت مستوحاة جزئيا من الحملات السياسية الفعالة اجتماعيا للإيدز، أسفرت عن قبول على نطاق واسع في الآراء الثانية قبل الجراحة، والإجراءات الجراحية الأقل غزواً، وجماعات الدعم، وتحسنات أخرى في رعاية المرضى.[159]
الشريط الوردي

الشريط الوردي هو رمز لاظهار الدعم للتوعية بسرطان الثدي الشريط الوردي هو الرمز الأبرز للتوعية بمرض سرطان الثدي. يمكن بيع الشرائط الوردية الغير مكلفة الصنع لجمع التبرعات، مثل مبدأ الخشخاش في يوم الذكرى. يمكن ارتداؤه لتكريم أولئك الذين تم تشخيصهم بسرطان الثدي، أو لتحديد المنتجات التي يود الصانع أن يبيعها للمستهلكين المهتمين في سرطان الثدي، عادة تكون فئة المستهلكين هم النساء المتعلمات ذواتى البشرة البيضاء، في منتصف العمر، من الطبقة الوسطى والطبقة العليا.[160]
ويرتبط الشريط الوردي مع كرم الأفراد، والإيمان في التقدم العلمي، وايمان الشخص بقدرته على القيام بأي شيء. كما تشجع المستهلكين على التركيزعلى الرؤية النهائية لعلاج سرطان الثدي، وليس على مسار محفوف بين المعرفة الحالية وأية علاجات قد تكتشف في المستقبل.[161] إن ارتداء الشريط الوردي تعرض لانتقادات من قبل المعارضين لهذه الممارسة كنوع من السلاكتيفسم؛ لأنه لا يوجد لديه تأثير عملي إيجابي. كما أنه وُصف بالنفاق، لأن بعض الناس ترتدي الشريط الوردي لإظهار حسن النية تجاه النساء المصابات بسرطان الثدي، ولكن بعد ذلك يعارضوا الأهداف العملية لهذه الممارسة، مثل حقوق المرضى والتشريعات لمكافحة التلوث.[162][163] يقول النقاد أن الشعور بالسعادة والرضى عند ارتداء الشرائط الوردية تصرف المجتمع عن حقيقة عدم إحراز تقدم طبي في منع وعلاج سرطان الثدي.[164] وانتقد أيضا لتعزيز الصور النمطية بين الجنسين وعرض النساء وصدورهن.[164] أطلقت مؤسسة مبادرة سرطان الثدي حملة " Think Before You Pink "، وقالت إن الشركات قد تحيد الحملة الوردية للترويج للمنتجات التي تسبب سرطان الثدي، مثل المشروبات الكحولية.[165]
ثقافة سرطان الثدي
ثقافة سرطان الثدي، أو ثقافة الشريط الوردي، هي مجموعة من الأنشطة والمواقف والقيم التي تحيط وتشكل سرطان الثدي عامةً. القيم السائدة هي الإيثار، البهجة، الاتحاد، والتفاؤل. وضوح أنهم عانوا بشجاعة ما هو الا جواز سفر إلى الثقافة. توضع المرأة المصابة بسرطان الثدي في قالب ثقافي يقيد استجابتها العاطفية والاجتماعية إلى خطاب مقبول اجتماعيا: هي استخدام الصدمات العاطفية الناجمة عن التشخيص بالإصابة بمرض سرطان الثدي والمعاناة من العلاج الممتد إلى تحويل نفسها لإنسان أكثر قوة وأكثر سعادة والشعور بالامتنان لأنه أُتيحت لها الفرصة لتصبح شخصا أفضل. أصبح علاج سرطان الثدي طقس من الطقوس العابرة بدلا من مرض.[166] لتتناسب في هذا القالب، على المرأة المصابة بسرطان الثدي جعل مظهرها أنوثي وطبيعي ، وتقليل اضطرابها بأن قضيتها الصحية تؤثرعلى أشخاص آخرين. يجب إسكات الغضب والحزن والسلبية.[166] كما هو الحال مع معظم النماذج الثقافية، الأشخاص الذين يتكيفون مع النموذج يُعطون وضع اجتماعي، في هذه الحالة الناجين من مرض السرطان.النساء الذين يرفضون هذا النموذج، يعاقبون وينبذون ويتم فضحهم.[166]
الاهداف الرئيسية أو أهداف ثقافة سرطان الثدي هي الحفاظ على هيمنة سرطان الثدي كقضية بارزة في صحة المرأة، لتعزيز مظهر أن المجتمع "يفعل شيئا ما" لقضية سرطان الثدي، ولتوسيع والحفاظ على القوة الاجتماعية والسياسية والمالية للنشاطات المتعلقة بسرطان الثدي.[167]
إبراز وتشديد
بالمقارنة مع أمراض أو أنواع أخرى من السرطان، يتلقى سرطان الثدي حصة أكبر نسبيا من الموارد والاهتمام. في عام 2001 إيانجيبسون، رئيس مجلس العموم البريطاني ذكرت كل مجموعات الأحزاب على السرطان " لقد تم انحراف مسيرة العلاج بسبب حجم الضغط، ليس هناك شك في ذلك. الذين يعانون من سرطان الثدي يحصلون على معاملة أفضل من حيث المساحات السرير، والمرافق والأطباء والممرضات".[168] سرطان الثدي أيضا يتلقى أكثر بكثير من غيره من التغطية الإعلامية، على قدم المساواة مع السرطانات المنتشرة، مع دراسة أجراها الائتلاف البروستاتي يظهر أنه يتم تغطية 2.6 من قصص سرطان الثدي لكل واحد من سرطان البروستات.[169] لما لسرطان الثدي من انتشار واسع نسبيا وارتفاع معدلات البقاءعلى قيد الحياة، تنحازالبحوث نحو سرطان الثدي.[168] بعض النقاط، مثل الإجهاد الناجم عن السرطان، قد درست قليلا إلا في النساء المصابات بسرطان الثدي. هناك نتيجة للوضوح العالي لسرطان الثدي هي أن النتائج الإحصائية يمكن في بعض الأحيان أن يساء تفسيرها، مثلا لادعاء بأن واحدة من بين ثماني نساء سيتم تشخيصها بالإصابة بسرطان الثدي، أيضا ادعاء اعتمد على افتراض غير واقعي أنه لن تموت أي امرأة قبل سن ال 95 بسبب مرض آخر.[170] وهذا يحجب حقيقة الواقع، وهي أن النساء من الممكن أن تموت بسبب أمراض القلب أو السكتة الدماغية أكثر بعشر مرات من سرطان الثدي.[171]
التركيزعلى فحص سرطان الثدي يمكن أن يضر المرأة من خلال تعريضها لكمية من الإشعاع، الخزعات، والجراحة. ثلث الحالات التي تم تشخيصها بسرطان الثدي من الممكن أن تتراجع من تلقاء نفسها.[172] استخدام جهاز الماموغرام (فحص التصوير الشعاعي) للثدي يكشف بكفاءة عن السرطانات غير المهددة للحياة، سرطان الثدي الذي لا تظهر له أي أعراض أو ورم ما قبل سرطاني، حتى عند البحث عن سرطانات خطيرة. وفق الجيلبرت ويلش من معهد دار تموثل لسياسة الصحية والممارسة السريرية، اتخذت البحوث على التصويرالإشعاعي للثدي "النهج بالسكتة الدماغية الذي ينص على أن أفضل اختبار هو الذي يجد معظم أنواع السرطانات" بدلا من تلك التي تجد السرطانات الخطيرة فقط.
الحمل
إن سرطانات الثدي التي تحدث خلال فترة الحمل تكون بنفس معدل حدوث سرطانات الثدي لدى النساء غير الحوامل. ثم يصبح سرطان الثدي أكثر شيوعا بعد ال 5 أو 10 سنوات التي تلي الحمل، ولكن بعد ذلك يصبح أقل شيوعا نسبة للعامة من السكان.[173] وتعرف هذه السرطانات بـ "سرطان الثدي مابعد الولادة" ويكون لديه أسوأ نتائج بما في ذلك زيادة احتمالية انتشار المرض في أماكن أخرى من الجسم وزيادة معدلات الوفيات.[174] إن ظهور أنواع أخرى من السرطانات أثناء أو بعد فترة وجيزة من الحمل تكون بنفس معدل ظهورها لدى النساء في سن مماثلة.[175]
يعدّ تشخيص سرطان ما في امرأة حامل صعبا، ويرجع ذلك إلى أن أي أعراض يفترض عادة أن تكون انزعاج طبيعي من الحمل.[175] ونتيجة لذلك، يتم عادة اكتشاف السرطان في مرحلة متأخرة إلى حد ما في كثير من النساء الحوامل. تعدّ بعض إجراءات التصوير، مثل التصوير بالرنين المغناطيسي، الأشعة المقطعية، الموجات فوق الصوتية، وجهاز الماموغرام (تصوير الثدي بالأشعة السينية) مع وجود درع حماية للجنين آمنة أثناء الحمل؛ أما البعض الآخر، مثل التصوير المقطعي بالإصدار البوزيتروني فلا يعد آمن أثناء الحمل .[175]
العلاج هوعموما نفسه للنساء غير الحوامل.[175] مع ذلك، يتم تجنب الإشعاع خلال فترة الحمل، خاصة إذا كانت كمية الإشعاع المقدر أن تصل الجنين تتجاوز 100 وحدة. وفي بعض الحالات، يتم تأجيل بعض أو كل العلاجات حتى بعد الولادة إذا كان تشخيص السرطان في وقت متأخر من الحمل. تعدّ الولادة في وقت مبكر لتسريع البدء بعلاج السرطان إجراء شائع. تعدّ الجراحة آمنة بشكل عام أثناء الحمل، ولكن بعض العلاجات الأخرى، خاصة بعض أدوية العلاج الكيميائي خلال الأشهر الثلاثة الأولى، يزيد من خطر حدوث التشوهات الخلقية للجنين أو فقدان الحمل (الإجهاض التلقائي وموت الجنين داخل الرحم).[175] لا يُفضل القيام بالإجهاض الاختياري، أيضا لا يُحسن من احتمالية شفاء الأم.[175] من الممكن أن يؤثر العلاج الإشعاعي على قدرة الأم على إرضاع طفلها لأنه يقلل من قدرة الثدي على إنتاج الحليب ويزيد من خطر الإصابة بـالتهاب الثدي. أيضا، عند بدء إعطاء علاج كيميائي بعد الولادة، العديد من الأدوية تمر عبر حليب الثدي للطفل، والتي من الممكن أن تضر بالطفل.[175] وفي ما يتعلق بالحمل في المستقبل للنساء الناجيات من سرطان الثدي، [176] غالبا ما يكون هناك خوف من رجوع المرض لهن بسببه. لكن، كثير منهن مازالوا ينظرون للحمل والأمومة كعناصر تمثل الحياة الطبيعية والسعادة وتحقيق الحياة
الهرمونات
منع الحمل
في الناجيات من سرطان الثدي، ينبغي استخدام وسائل منع الحمل غير الهرمونية كخيارات الخط الأول. أساليب تعتمد على البروجستيرون مثل جهاز مستودع ميدروكسيبر وجيسترون اسيتيت، اللولب المحتوي على البروجستيرون أو حبوب البروجستيرون، لديهم أدلة ضعيفة لكن محتملة لزيادة احتمالية عودة السرطان ولكن يمكن استخدامهم إذا كانت الآثار الإيجابية تفوق هذا الخطر المحتمل.[177]
الهرمونات البديلة لانقطاع الطمث
في الناجيات من سرطان الثدي، من المستحسن أن تكون أولى الخيارات غير هرمونية، مثل البايفوسفونيت أو معدِلات مستقبلات هرمون الاستروجين الانتقائية لهشاشة العظام، وهرمون الاستروجين المهبلي للأعراض المحلية. لاحظت بعض الدراسات أن العلاج بالهرمونات البديلة بعد سرطان الثدي تكون مطمئنة. إذا كان العلاج بالهرمونات ضروري بعد الشفاء من سرطان الثدي، العلاج بهرمون الاستروجين فقط أو علاج بهرمون الاستروجين بالإضافة لوضع جهاز داخل الرحم معبأ بالبروجسترون قد تكون خيارات أكثر أمانا من إعطاء برنامج علاجي مشترك.[178]
الأبحاث
يتم تقييم العلاجات باستمرار في تجارب عشوائية، لتقييم ومقارنة الأدوية الفردية، مزيج من الأدوية، والتقنيات الجراحية والإشعاعية. تشمل التحقيقات الأنواع الجديدة من العلاجات الموجهه بالإضافة إلى لقاحات السرطان. تُذكر أحدث الأبحاث سنوياً في اللقاءات العلمية مثل لقاء الجمعية الأمريكية لعلم الأورام السريرية، وندوة سان انطونيو لسرطان الثدي،[179] ومؤتمر الأورام سانت غالنفيس انتغالن، سويسرا.[180] يتم مراجعة هذه الدراسات من قبل الجمعيات المهنية ومنظمات أخرى، حيث توضع على شكل مبادئ توجيهية لمجموعات محددة من العلاجات وفئة المخاطر.[181][182]
عملية استخدام البرد القارس لتدمير الأنسجة، بدأت دراسة هذه العملية اعتبارامن عام 2014 لمعرفة ما إذا كان يمكن أن تكون بديلا عن استئصال الورم في السرطانات الصغيرة.[183] هنا كأدلة مؤقتة في أولئك المصابين بالأورام التي تقل عن 2 سم.[183] ويمكن أيضا أن تستخدم في الأشخاص المصابين الذين لايمكن إجراء الجراحة لهم.[184] أقرت نشرة أخرى أن هذه العملية تبدو واعدة لسرطان الثدي المبكر صغير الحجم.[185]
خطوط خلايا سرطان الثدي
يستند جزء كبير من المعرفة الحالية بسرطان الثدي على دراسات داخل الجسم ودراسات مختبرية أجريت على خطوط الخلايا المستمدة من سرطان الثدي. توفر هذه مصدرا غير محدود من المواد المتجانسة ذاتية التكاثر، خالية من الخلايا اللحمية، وغالبا ما يمكن زراعتها بسهولة في وسط قياسي. أول خط من خلايا الثدي تم وصفه، بي تي 20، تم اشهاره في عام 1958. ومنذ ذلك الحين، وعلى الرغم من العمل المتواصل في هذا المجال، كان عدد الخطوط التي تم الحصول عليها منخفض (حوالي 100). في الواقع، كانت المحاولات لزراعة خطوط خلايا الثدي السرطانية من الأورام الأولية فاشلة إلى حد كبير. وكان هذا الضعف في كثير من الأحيان بسبب الصعوبات التقنية المرتبطة باستخراج الخلايا السرطانية القابلة للحياة والنمو من الخلايا اللحمية المحيطة بها . معظم خطوط خلايا سرطان الثدي المتاحة صادرة من السرطان النقيلي، ومعظمهم من الانتقال الجنبي لسرطان الثدي. قدم هذا الانتقال أعداد كبيرة من الخلايا السرطانية القابلة للحياة مع تلوث ضئيل أو معدوم من قبل الخلايا الليفية والخلايا اللحمية المحيطة. قد تم اشهار عدد كبير من خطوط بي سي سي المستخدمة حاليا في أواخر السبعينات. عدد قليل منهم، وهم ام سي اف7، تي47 دي، ام دي أ-ام بي-231، تمث لأكثر من ثلثي ملخصات الدراسات التي ذكرت خطوط خلايا سرطان الثدي، حيث أقرتها دراسة استقصائية من ميدلاين.
عوامل النسخ
عوامل نسخ (ان اف أ تي) متورطة في سرطان الثدي، وأكثر تحديدا في عملية حركة الخلية لتكوين ورم خبيث (نقيلي). في الواقع عوامل نسخ ان اف أ تي1 (ان اف أ تي سي2) وان اف أ تي5 هي عوامل موالية للغزو ومؤيدة لمهاجرة سرطان الثدي [186][187] وعوامل ان اف أ تي3 (ان اف أ تي سي4) هو المانع لحركة الخلية.[188] (ان اف أ تي 1) ولايبوكالين 2 ينظم ان إظهار مستقبل (تي واي أ ك ر) والجزيئات التي ترتبط به لزيادة انتشار خلايا سرطان الثدي.[189] يثبط عامل (ان اف أ تي3) ليبوكالين2 للتقليل من انتشار السرطان.[188]
علامات التمثيل الغذائي
عمليا، أكثر العلامات الأيضية فائدة في سرطان الثدي هي مستقبلات هرموني الاستروجين والبروجستيرون التي يتم استخدامها للتنبؤ بمدى الاستجابة للعلاج الهرموني. علامات جديدة لسرطان الثدي تشمل (بي ار سي أ1) و (بي ار سي أ2)[190] لتحديد المرضى الأكثر احتمالية للإصابة بسرطان الثدي، هير2 [191] و (اس سي دي1)[192] للتنبؤ بمدى الاستجابة للمركبات العلاجية، ومفعّل اليوروكيناز بلاسمينوجين (بي أ1-1)[193] و (اس سي دي1)[194] لتقييم التنبؤات الطبية لسير العلاج.
الحيوانات الأخرى
- سرطان حلمي تسمية لسرطان الثدي في الحيوانات.
- أنماط انبثات سرطان الثدي في الفئران
انظر أيضًا
- جراحة الثدي المحافظة
- ميتوجين سرطان الثدي المتكرر
- العلاج الكيميائي لسرطان الثدي
المراجع
- مُعرِّف أنطولوجيا مرض: http://www.disease-ontology.org/?id=DOID:1612 — تاريخ الاطلاع: 15 مايو 2019 — الرخصة: CC0
- https://pubmed.ncbi.nlm.nih.gov/29162146
- "Breast Cancer"، NCI، مؤرشف من الأصل في 27 أبريل 2015، اطلع عليه بتاريخ 29 يونيو 2014.
- "Breast Cancer Treatment (PDQ®)"، NCI، 23 مايو 2014، مؤرشف من الأصل في 5 أبريل 2015، اطلع عليه بتاريخ 29 يونيو 2014.
- Saunders؛ Jassal (2009)، Breast cancer (ط. 1.)، Oxford: Oxford University Press، ص. Chapter 13، ISBN 978-0-19-955869-8، مؤرشف من الأصل في 01 مارس 2020.
- World Cancer Report 2014، World Health Organization، 2014، ص. Chapter 5.2، ISBN 978-92-832-0429-9.
- Gøtzsche PC, Jørgensen KJ (04 يونيو 2013)، "Screening for breast cancer with mammography."، The Cochrane database of systematic reviews، 6: CD001877، doi:10.1002/14651858.CD001877.pub5، PMID 23737396.
- Nelson؛ Tyne؛ Naik؛ Bougatsos؛ Chan؛ Nygren؛ Humphrey (نوفمبر 2009)، "Screening for Breast Cancer: Systematic Evidence Review Update for the US Preventive Services Task Force [Internet]."، PMID 20722173.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة) - Siu (12 يناير 2016)، "Screening for Breast Cancer: U.S. Preventive Services Task Force Recommendation Statement"، Annals of Internal Medicine، doi:10.7326/M15-2886.
- American College of Surgeons (سبتمبر 2013)، "Five Things Physicians and Patients Should Question"، اختر بحكمة: an initiative of the اختر بحكمة، American College of Surgeons، مؤرشف من الأصل في 14 أبريل 2015، اطلع عليه بتاريخ 02 يناير 2013
- "Breast Cancer Treatment (PDQ®)"، NCI، 26 يونيو 2014، مؤرشف من الأصل في 25 أبريل 2015، اطلع عليه بتاريخ 29 يونيو 2014.
- "World Cancer Report" (PDF)، الوكالة الدولية لأبحاث السرطان، 2008، مؤرشف من الأصل (PDF) في 14 مايو 2018، اطلع عليه بتاريخ 26 فبراير 2011.
- "Cancer Survival in England: Patients Diagnosed 2007–2011 and Followed up to 2012" (PDF)، Office for National Statistics، 29 أكتوبر 2013، مؤرشف من الأصل (PDF) في 1 فبراير 2016، اطلع عليه بتاريخ 29 يونيو 2014.
- "SEER Stat Fact Sheets: Breast Cancer"، NCI، مؤرشف من الأصل في 28 مايو 2019، اطلع عليه بتاريخ 18 يونيو 2014.
- World Cancer Report 2014، World Health Organization، 2014، ص. Chapter 1.1، ISBN 92-832-0429-8.
- "Male Breast Cancer Treatment"، المعهد الوطني للسرطان، 2014، مؤرشف من الأصل في 4 أبريل 2015، اطلع عليه بتاريخ 29 يونيو 2014.
- دليل ميرك للتشخيص والعلاج (فبراير 2003)، "Breast Disorders: Breast Cancer"، مؤرشف من الأصل في 29 مارس 2015، اطلع عليه بتاريخ 05 فبراير 2008.
{{استشهاد ويب}}: صيانة CS1: extra punctuation (link) صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - American Cancer Society (2007)، "Cancer Facts & Figures 2007" (PDF)، مؤرشف من الأصل (PDF) في 10 أبريل 2007، اطلع عليه بتاريخ 26 أبريل 2007.
- Watson M (2008)، "Assessment of suspected cancer"، InnoAiT، 1 (2): 94–107، doi:10.1093/innovait/inn001.
- إي ميديسين (23 أغسطس 2006)، "Breast Cancer Evaluation"، مؤرشف من الأصل في 1 ديسمبر 2008، اطلع عليه بتاريخ 05 فبراير 2008.
- المعهد الوطني للسرطان (27 يونيو 2005)، "Paget's Disease of the Nipple: Questions and Answers"، مؤرشف من الأصل في 21 ديسمبر 2010، اطلع عليه بتاريخ 06 فبراير 2008.
- answers.com، "Oncology Encyclopedia: Cystosarcoma Phyllodes"، مؤرشف من الأصل في 16 مارس 2017، اطلع عليه بتاريخ 10 أغسطس 2010.
- Lacroix M (ديسمبر 2006)، "Significance, detection and markers of disseminated breast cancer cells"، Endocrine-Related Cancer، Bioscientifica، 13 (4): 1033–67، doi:10.1677/ERC-06-0001، PMID 17158753.
- Interpreting Signs and Symptoms، Lippincott Williams & Wilkins، 2007، ص. 99–، ISBN 978-1-58255-668-0.
- دليل ميرك للتشخيص والعلاج (فبراير 2003)، "Breast Disorders: Overview of Breast Disorders"، مؤرشف من الأصل في 4 فبراير 2015، اطلع عليه بتاريخ 05 فبراير 2008.
{{استشهاد ويب}}: صيانة CS1: extra punctuation (link) صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Hayes,؛ Ricahrdson؛ Frampton (15 نوفمبر 2013)، "Population attributable risks for modifiable lifestyle factors and breast cancer in New Zealand women"، IMJ، 43 (11): 1198–1204، doi:10.1111/imj.12256، PMID 23910051.
{{استشهاد بدورية محكمة}}: صيانة CS1: extra punctuation (link) - Reeder JG, Vogel VG (2008)، "Breast cancer prevention."، Cancer treatment and research، 141: 149–64، doi:10.1007/978-0-387-73161-2_10، PMID 18274088.
- "Am I at risk?"، Breast Cancer Care، مؤرشف من الأصل في 22 يونيو 2015، اطلع عليه بتاريخ 22 أكتوبر 2013.
- Collaborative Group on Hormonal Factors in Breast Cancer (أغسطس 2002)، "Breast cancer and breastfeeding: collaborative reanalysis of individual data from 47 epidemiological studies in 30 countries, including 50302 women with breast cancer and 96973 women without the disease."، Lancet، 360 (9328): 187–95، doi:10.1016/S0140-6736(02)09454-0، PMID 12133652.
- Yager JD, Davidson NE (2006)، "Estrogen carcinogenesis in breast cancer"، New Engl J Med، 354 (3): 270–82، doi:10.1056/NEJMra050776، PMID 16421368.
- Santoro, E., DeSoto, M., and Hong Lee, J (فبراير 2009)، "Hormone Therapy and Menopause"، National Research Center for Women & Families، مؤرشف من الأصل في 22 يونيو 2012.
{{استشهاد ويب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Light Pollution as new risk factor for human Breast and Prostate Cancers- Haim,Abraham; Portnov, Biris P. ,2013,ISBN 978-94-007-6220-6
- Johnson KC, Miller AB, Collishaw NE, Palmer JR, Hammond SK, Salmon AG, Cantor KP, Miller MD, Boyd NF, Millar J, Turcotte F (يناير 2011)، "Active smoking and secondhand smoke increase breast cancer risk: the report of the Canadian Expert Panel on Tobacco Smoke and Breast Cancer Risk (2009)."، Tobacco control، 20 (1): e2، doi:10.1136/tc.2010.035931، PMID 21148114.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Lee IM, Shiroma EJ, Lobelo F, Puska P, Blair SN, Katzmarzyk PT (01 يوليو 2012)، "Effect of physical inactivity on major non-communicable diseases worldwide: an analysis of burden of disease and life expectancy"، The Lancet، 380 (9838): 219–29، doi:10.1016/S0140-6736(12)61031-9، PMC 3645500، PMID 22818936.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "Sedentary Time and Its Association With Risk for Disease Incidence, Mortality, and Hospitalization in Adults: A Systematic Review and Meta-analysis"، Annals of Internal Medicine، 162 (2): 123–32، 2015، doi:10.7326/M14-1651، PMID 25599350.
- Kahlenborn C, Modugno F, Potter DM, Severs WB (أكتوبر 2006)، "Oral contraceptive use as a risk factor for premenopausal breast cancer: a meta-analysis."، Mayo Clinic proceedings. Mayo Clinic، 81 (10): 1290–302، doi:10.4065/81.10.1290، PMID 17036554.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Veljković M, Veljković S (سبتمبر 2010)، "[The risk of breast cervical, endometrial and ovarian cancer in oral contraceptive users]."، Medicinski pregled، 63 (9–10): 657–61، doi:10.2298/mpns1010657v، PMID 21446095.
- Casey PM, Cerhan JR, Pruthi S (يناير 2008)، "Oral contraceptive use and risk of breast cancer."، Mayo Clinic proceedings. Mayo Clinic، 83 (1): 86–90, quiz 90–1، doi:10.4065/83.1.86، PMID 18174010، مؤرشف من الأصل في 6 فبراير 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Iodice S, Barile M, Rotmensz N, Feroce I, Bonanni B, Radice P, Bernard L, Maisonneuve P, Gandini S (أغسطس 2010)، "Oral contraceptive use and breast or ovarian cancer risk in BRCA1/2 carriers: a meta-analysis."، European journal of cancer (Oxford, England : 1990)، 46 (12): 2275–84، doi:10.1016/j.ejca.2010.04.018، PMID 20537530.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Gaffield ME, Culwell KR, Ravi A (أكتوبر 2009)، "Oral contraceptives and family history of breast cancer."، Contraception، 80 (4): 372–80، doi:10.1016/j.contraception.2009.04.010، PMID 19751860.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Yang L, Jacobsen KH (ديسمبر 2008)، "A systematic review of the association between breastfeeding and breast cancer."، Journal of Women's Health، 17 (10): 1635–45، doi:10.1089/jwh.2008.0917، PMID 19049358، مؤرشف من الأصل في 16 مارس 2020.
- Russo J, Russo IH (1980)، "Susceptibility of the mammary gland to carcinogenesis. II. Pregnancy interruption as a risk factor in tumor incidence"، Am J Pathol، 100 (2): 505–506، PMC 1903536، PMID 6773421،
In contrast, abortion is associated with increased risk of carcinomas of the breast. The explanation for these epidemiologic findings is not known, but the parallelism between the DMBA-induced rat mammary carcinoma model and the human situation is striking. ... Abortion would interrupt this process, leaving in the gland undifferentiated structures like those observed in the rat mammary gland, which could render the gland again susceptible to carcinogenesis.
- Beral V, Bull D, Doll R, Peto R, Reeves G (27 مارس 2004)، "Breast cancer and abortion: collaborative reanalysis of data from 53 epidemiological studies, including 83?000 women with breast cancer from 16 countries."، Lancet، 363 (9414): 1007–16، doi:10.1016/S0140-6736(04)15835-2، PMID 15051280.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Blackburn GL, Wang KA (سبتمبر 2007)، "Dietary fat reduction and breast cancer outcome: results from the Women's Intervention Nutrition Study (WINS)."، The American journal of clinical nutrition، 86 (3): s878–81، PMID 18265482.
- Boffetta P, Hashibe M, La Vecchia C, Zatonski W, Rehm J (أغسطس 2006)، "The burden of cancer attributable to alcohol drinking"، International Journal of Cancer، 119 (4): 884–7، doi:10.1002/ijc.21903، PMID 16557583.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - BBC report Weight link to breast cancer risk نسخة محفوظة 13 مارس 2007 على موقع واي باك مشين.
- Kaiser J (29 نوفمبر 2013)، "Cancer. Cholesterol forges link between obesity and breast cancer."، Science، 342 (6162): 1028، doi:10.1126/science.342.6162.1028، PMID 24288308.
- Aceves C, Anguiano B, Delgado G (أبريل 2005)، "Is iodine a gatekeeper of the integrity of the mammary gland?"، Journal of Mammary Gland Biology and Neoplasia، 10 (2): 189–96، doi:10.1007/s10911-005-5401-5، PMID 16025225.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - American Cancer Society (2005)، "Breast Cancer Facts & Figures 2005–2006" (PDF)، مؤرشف من الأصل (PDF) في 13 يونيو 2007، اطلع عليه بتاريخ 26 أبريل 2007.
- Wang XS, Armstrong ME, Cairns BJ, Key TJ, Travis RC (مارس 2011)، "Shift work and chronic disease: the epidemiological evidence."، Occupational medicine (Oxford, England)، 61 (2): 78–89، doi:10.1093/occmed/kqr001، PMC 3045028، PMID 21355031.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Brody JG, Rudel RA, Michels KB, Moysich KB, Bernstein L, Attfield KR, Gray S (يونيو 2007)، "Environmental pollutants, diet, physical activity, body size, and breast cancer: where do we stand in research to identify opportunities for prevention?"، Cancer، 109 (12 Suppl): 2627–34، doi:10.1002/cncr.22656، PMID 17503444.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ferro, Roberto (01 يناير 2012)، "Pesticides and Breast Cancer"، Advances in Breast Cancer Research، 01 (03): 30–35، doi:10.4236/abcr.2012.13005.
- Hendrick RE (أكتوبر 2010)، "Radiation doses and cancer risks from breast imaging studies."، Radiology، 257 (1): 246–53، doi:10.1148/radiol.10100570، PMID 20736332.
- Boris Pasche (2010)، Cancer Genetics (Cancer Treatment and Research)، Berlin: Springer، ص. 19–20، ISBN 1-4419-6032-5.
- Gage M, Wattendorf D, Henry LR (01 أبريل 2012)، "Translational advances regarding hereditary breast cancer syndromes"، Journal of surgical oncology، 105 (5): 444–51، doi:10.1002/jso.21856، PMID 22441895.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Colditz, Graham A.؛ Kaphingst؛ Hankinson؛ Rosner (19 فبراير 2012)، "Family history and risk of breast cancer: nurses' health study"، Breast Cancer Research and Treatment، 133 (3): 1097–1104، doi:10.1007/s10549-012-1985-9، ISSN 0167-6806، PMC 3387322، PMID 22350789، مؤرشف من الأصل في 31 مايو 2019.
- "Familial breast cancer: collaborative reanalysis of individual data from 52 epidemiological studies including 58,209 women with breast cancer and 101,986 women without the disease."، Lancet، 358 (9291): 1389–99، 27 أكتوبر 2001، doi:10.1016/S0140-6736(01)06524-2، PMID 11705483.
- Nelson HD, Zakher B, Cantor A, Fu R, Griffin J, O'Meara ES, Buist DS, Kerlikowske K, van Ravesteyn NT, Trentham-Dietz A, Mandelblatt JS, Miglioretti DL (01 مايو 2012)، "Risk factors for breast cancer for women aged 40 to 49 years: a systematic review and meta-analysis."، Annals of Internal Medicine، 156 (9): 635–48، doi:10.1059/0003-4819-156-9-201205010-00006، PMC 3561467، PMID 22547473.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Kolata, Gina (23 سبتمبر 2012)، "Genetic Study Finds 4 Distinct Variations of Breast Cancer"، The New York Times، مؤرشف من الأصل في 29 يونيو 2018، اطلع عليه بتاريخ 23 سبتمبر 2012.
- "Understanding Breast Changes – National Cancer Institute"، مؤرشف من الأصل في 27 مايو 2010.
- "Lobular carcinoma in situ: Marker for breast cancer risk"، MayoClinic.com، مؤرشف من الأصل في 2 يناير 2014.
- "Breast Cancer Treatment"، National Cancer Institute، مؤرشف من الأصل في 25 أبريل 2015.
- Afonso N, Bouwman D (أغسطس 2008)، "Lobular carcinoma in situ"، Eur. J. Cancer Prev.، 17 (4): 312–6، doi:10.1097/CEJ.0b013e3282f75e5d، PMID 18562954، مؤرشف من الأصل في 2 يناير 2016.
- Anothaisintawee T, Wiratkapun C, Lerdsitthichai P, Kasamesup V, Wongwaisayawan S, Srinakarin J, Hirunpat S, Woodtichartpreecha P, Boonlikit S, Teerawattananon Y, Thakkinstian A (2013)، "Risk factors of breast cancer: a systematic review and meta-analysis"، Asian Pacific Journal of Public Health، 25 (5): 368–387، doi:10.1177/1010539513488795، PMID 23709491.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Adrian Lee؛ Carlos Arteaga (14 ديسمبر 2009)، "32nd Annual CTRC-AACR San Antonio Breast Cancer Symposium" (PDF)، Sunday Morning Year-End Review، مؤرشف من الأصل (PDF) في 13 أغسطس 2013.
- Cavalieri E, Chakravarti D, Guttenplan J, Hart E, Ingle J, Jankowiak R, Muti P, Rogan E, Russo J, Santen R, Sutter T (أغسطس 2006)، "Catechol estrogen quinones as initiators of breast and other human cancers: implications for biomarkers of susceptibility and cancer prevention"، Biochimica et Biophysica Acta، 1766 (1): 63–78، doi:10.1016/j.bbcan.2006.03.001، PMID 16675129.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Haslam SZ, Woodward TL (يونيو 2003)، "Host microenvironment in breast cancer development: epithelial-cell-stromal-cell interactions and steroid hormone action in normal and cancerous mammary gland."، Breast Cancer Res.، 5 (4): 208–15، doi:10.1186/bcr615، PMC 165024، PMID 12817994.
- Wiseman BS, Werb Z (مايو 2002)، "Stromal effects on mammary gland development and breast cancer"، Science، 296 (5570): 1046–9، doi:10.1126/science.1067431، PMC 2788989، PMID 12004111.
- Jardé T, Perrier S, Vasson MP, Caldefie-Chézet F (يناير 2011)، "Molecular mechanisms of leptin and adiponectin in breast cancer"، Eur. J. Cancer، 47 (1): 33–43، doi:10.1016/j.ejca.2010.09.005، PMID 20889333.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Dunning AM, Healey CS, Pharoah PD, Teare MD, Ponder BA, Easton DF (أكتوبر 1999)، "A systematic review of genetic polymorphisms and breast cancer risk"، Cancer Epidemiology, Biomarkers & Prevention، 8 (10): 843–54، PMID 10548311، مؤرشف من الأصل في 16 مارس 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Begg CB, Haile RW, Borg A, Malone KE, Concannon P, Thomas DC, Langholz B, Bernstein L, Olsen JH, Lynch CF, Anton-Culver H, Capanu M, Liang X, Hummer AJ, Sima C, Bernstein JL (يناير 2008)، "Variation of breast cancer risk among BRCA1/2 carriers"، JAMA، 299 (2): 194–201، doi:10.1001/jama.2007.55-a، PMC 2714486، PMID 18182601.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Patel KJ, Yu VP, Lee H, Corcoran A, Thistlethwaite FC, Evans MJ, Colledge WH, Friedman LS, Ponder BA, Venkitaraman AR (فبراير 1998)، "Involvement of Brca2 in DNA repair"، Mol. Cell، 1 (3): 347–57، doi:10.1016/S1097-2765(00)80035-0، PMID 9660919.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Marietta C, Thompson LH, Lamerdin JE, Brooks PJ (مايو 2009)، "Acetaldehyde stimulates FANCD2 monoubiquitination, H2AX phosphorylation, and BRCA1 phosphorylation in human cells in vitro: implications for alcohol-related carcinogenesis"، Mutat. Res.، 664 (1–2): 77–83، doi:10.1016/j.mrfmmm.2009.03.011، PMC 2807731، PMID 19428384.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Theruvathu JA, Jaruga P, Nath RG, Dizdaroglu M, Brooks PJ (2005)، "Polyamines stimulate the formation of mutagenic 1,N2-propanodeoxyguanosine adducts from acetaldehyde"، Nucleic Acids Res.، 33 (11): 3513–20، doi:10.1093/nar/gki661، PMC 1156964، PMID 15972793.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Wooster R, Weber BL (يونيو 2003)، "Breast and ovarian cancer"، N. Engl. J. Med.، 348 (23): 2339–47، doi:10.1056/NEJMra012284، PMID 12788999.
- Levin B, Lech D, Friedenson B (2012)، "Evidence that BRCA1- or BRCA2-associated cancers are not inevitable"، Mol. Med.، 18: 1327–37، doi:10.2119/molmed.2012.00280، PMC 3521784، PMID 22972572.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Kouros-Mehr H, Kim JW, Bechis SK, Werb Z (أبريل 2008)، "GATA-3 and the regulation of the mammary luminal cell fate."، Current opinion in cell biology، 20 (2): 164–70، doi:10.1016/j.ceb.2008.02.003، PMC 2397451، PMID 18358709.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Saslow D, Hannan J, Osuch J, Alciati MH, Baines C, Barton M, Bobo JK, Coleman C, Dolan M, Gaumer G, Kopans D, Kutner S, Lane DS, Lawson H, Meissner H, Moorman C, Pennypacker H, Pierce P, Sciandra E, Smith R, Coates R (2004)، "Clinical breast examination: practical recommendations for optimizing performance and reporting"، CA: a cancer journal for clinicians، 54 (6): 327–344، doi:10.3322/canjclin.54.6.327، PMID 15537576.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Yu YH, Liang C, Yuan XZ (2010)، "Diagnostic value of vacuum-assisted breast biopsy for breast carcinoma: a meta-analysis and systematic review."، Breast cancer research and treatment، 120 (2): 469–79، doi:10.1007/s10549-010-0750-1، PMID 20130983.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Merck Manual, Professional Edition, Ch. 253, Breast Cancer. نسخة محفوظة 12 أبريل 2015 على موقع واي باك مشين.
- American Society of Clinical Oncology، "Five Things Physicians and Patients Should Question" (PDF)، Choosing Wisely: an initiative of the اختر بحكمة، American Society of Clinical Oncology، مؤرشف من الأصل في 8 أغسطس 2012، اطلع عليه بتاريخ 14 أغسطس 2012
- Carlson RW, Allred DC, Anderson BO, Burstein HJ, Carter WB, Edge SB, Erban JK, Farrar WB, Goldstein LJ, Gradishar WJ, Hayes DF, Hudis CA, Jahanzeb M, Kiel K, Ljung BM, Marcom PK, Mayer IA, McCormick B, Nabell LM, Pierce LJ, Reed EC, Smith ML, Somlo G, Theriault RL, Topham NS, Ward JH, Winer EP, Wolff AC (2009)، "Breast cancer. Clinical practice guidelines in oncology"، Journal of the National Comprehensive Cancer Network : JNCCN، 7 (2): 122–192، PMID 19200416.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Kumar, Vinay؛ Abul Abbas (2010)، Robbins and Cotran Pathologic Basis of Disease، Philadelphia: Saunders, an imprint of Elsevier inc.، ص. 1090، ISBN 978-1-4160-3121-5.
- Sotiriou C, Pusztai L (فبراير 2009)، "Gene-expression signatures in breast cancer"، N. Engl. J. Med.، 360 (8): 790–800، doi:10.1056/NEJMra0801289، PMID 19228622.
- Romond EH, Perez EA, Bryant J, Suman VJ, Geyer CE, Davidson NE, Tan-Chiu E, Martino S, Paik S, Kaufman PA, Swain SM, Pisansky TM, Fehrenbacher L, Kutteh LA, Vogel VG, Visscher DW, Yothers G, Jenkins RB, Brown AM, Dakhil SR, Mamounas EP, Lingle WL, Klein PM, Ingle JN, Wolmark N (أكتوبر 2005)، "Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer"، N. Engl. J. Med.، 353 (16): 1673–84، doi:10.1056/NEJMoa052122، PMID 16236738.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - American Institute for Cancer Research/ World Cancer Research Fund, Food, Nutrition, Physical Activity and the Prevention of Cancer: a Global Perspective نسخة محفوظة 16 يونيو 2012 على موقع واي باك مشين.
- Eliassen AH, Hankinson SE, Rosner B, Holmes MD, Willett WC (أكتوبر 2010)، "Physical activity and risk of breast cancer among postmenopausal women"، Arch. Intern. Med.، 170 (19): 1758–64، doi:10.1001/archinternmed.2010.363، PMC 3142573، PMID 20975025.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Zheng JS, Hu XJ, Zhao YM, Yang J, Li D (2013)، "Intake of fish and marine n-3 polyunsaturated fatty acids and risk of breast cancer: meta-analysis of data from 21 independent prospective cohort studies"، BMJ، 346: f3706، doi:10.1136/bmj.f3706، PMID 23814120.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Wu؛ Yu؛ Tseng؛ Pike (15 يناير 2008)، "Epidemiology of soy exposures and breast cancer risk."، British journal of cancer، 98 (1): 9–14، doi:10.1038/sj.bjc.6604145، PMID 18182974.
- Hartmann LC, Schaid DJ, Woods JE, Crotty TP, Myers JL, Arnold PG, Petty PM, Sellers TA, Johnson JL, McDonnell SK, Frost MH, Jenkins RB (1999)، "Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer"، N Engl J Med، 340 (2): 77–84، doi:10.1056/NEJM199901143400201، PMID 9887158.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Meijers-Heijboer H, van Geel B, van Putten WL, Henzen-Logmans SC, Seynaeve C, Menke-Pluymers MB, Bartels CC, Verhoog LC, van den Ouweland AM, Niermeijer MF, Brekelmans CT, Klijn JG (2001)، "Breast cancer after prophylactic bilateral mastectomy in women with BRCA1 and BRCA2 mutations"، N Engl J Med، 345 (3): 159–164، doi:10.1056/NEJM200107193450301، PMID 11463009.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Lostumbo؛ Carbine؛ Wallace (10 نوفمبر 2010)، "Prophylactic mastectomy for the prevention of breast cancer."، The Cochrane database of systematic reviews (11): CD002748، doi:10.1002/14651858.CD002748.pub3، PMID 21069671.
- "Risk Assessment, Genetic Counseling, and Genetic Testing for BRCA-Related Cancer in Women: U.S. Preventive Services Task Force Recommendation Statement"، Annals of Internal Medicine، 160: 271–281، 24 ديسمبر 2013، doi:10.7326/M13-2747.
- Nelson HD, Smith ME, Griffin JC, Fu R (16 أبريل 2013)، "Use of medications to reduce risk for primary breast cancer: a systematic review for the U.S. Preventive Services Task Force."، Annals of Internal Medicine، 158 (8): 604–14، doi:10.7326/0003-4819-158-8-201304160-00005، PMID 23588749.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Cuzick J, Sestak I, Bonanni B, Costantino JP, Cummings S, DeCensi A, Dowsett M, Forbes JF, Ford L, LaCroix AZ, Mershon J, Mitlak BH, Powles T, Veronesi U, Vogel V, Wickerham DL (25 مايو 2013)، "Selective oestrogen receptor modulators in prevention of breast cancer: an updated meta-analysis of individual participant data."، Lancet، 381 (9880): 1827–34، doi:10.1016/S0140-6736(13)60140-3، PMID 23639488.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Moyer VA (24 سبتمبر 2013)، "Medications for Risk Reduction of Primary Breast Cancer in Women: U.S. Preventive Services Task Force Recommendation Statement."، Annals of Internal Medicine، doi:10.7326/0003-4819-159-10-201311190-00718، PMID 24061472.
- Cuzick J, Sestak I, Bonanni B, Costantino JP, Cummings S, DeCensi A, Dowsett M, Forbes JF, Ford L, LaCroix AZ, Mershon J, Mitlak BH, Powles T, Veronesi U, Vogel V, Wickerham DL (31 مارس 2013)، "Selective oestrogen receptor modulators in prevention of breast cancer: an updated meta-analysis of individual participant data"، The Lancet، 381 (9880): 1827–34، doi:10.1016/S0140-6736(13)60140-3، PMID 23639488، مؤرشف من الأصل في 21 أكتوبر 2013.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "Screening"، Centers for Disease Control and Prevention، مؤرشف من الأصل في 8 مارس 2019، اطلع عليه بتاريخ 17 نوفمبر 2015.
- "Screening for Breast Cancer"، US Preventative Services Task Force، ديسمبر 2009، مؤرشف من الأصل في 19 فبراير 2015، اطلع عليه بتاريخ 24 ديسمبر 2012.
- Kösters JP, Gøtzsche PC (2003)، "Cochrane Database of Systematic Reviews"، Cochrane Database Syst Rev (2): CD003373، doi:10.1002/14651858.CD003373، PMID 12804462.
- "Breast Cancer and Mammograms"، WebMD، مؤرشف من الأصل في 5 سبتمبر 2015، اطلع عليه بتاريخ 24 ديسمبر 2012.
- Biesheuvel C, Weigel S, Heindel W (2011)، "Mammography Screening: Evidence, History and Current Practice in Germany and Other European Countries."، Breast care (Basel, Switzerland)، 6 (2): 104–109، doi:10.1159/000327493، PMID 21673820.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Tonelli M, Connor Gorber S, Joffres M, Dickinson J, Singh H, Lewin G, Birtwhistle R, Fitzpatrick-Lewis D, Hodgson N, Ciliska D, Gauld M, Liu YY (22 نوفمبر 2011)، "Recommendations on screening for breast cancer in average-risk women aged 40–74 years."، Canadian Medical Association Journal، 183 (17): 1991–2001، doi:10.1503/cmaj.110334، PMC 3225421، PMID 22106103.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "Breast Cancer: Screening"، United States Preventive Services Task Force، مؤرشف من الأصل في 16 يونيو 2013.
- Welch HG, Passow HJ (30 ديسمبر 2013)، "Quantifying the Benefits and Harms of Screening Mammography."، JAMA internal medicine، 174 (3): 448–54، doi:10.1001/jamainternmed.2013.13635، PMID 24380095.
- Gøtzsche PC, Nielsen M (2011)، "Screening for breast cancer with mammography"، Cochrane Database Syst Rev (1): CD001877، doi:10.1002/14651858.CD001877.pub4، PMID 21249649.
- "Screening for breast cancer with mammography"، Cochrane Nordic، 27 أغسطس 2015، مؤرشف من الأصل في 31 يوليو 2018، اطلع عليه بتاريخ 15 أكتوبر 2015.
- "Screening for breast cancer: U.S. Preventive Services Task Force recommendation statement."، Annals of internal medicine، 151 (10): 716–26, W–236، 17 نوفمبر 2009، doi:10.1059/0003-4819-151-10-200911170-00008، PMID 19920272، مؤرشف من الأصل في 19 فبراير 2015.
- Saini KS, Taylor C, Ramirez AJ, Palmieri C, Gunnarsson U, Schmoll HJ, Dolci SM, Ghenne C, Metzger-Filho O, Skrzypski M, Paesmans M, Ameye L, Piccart-Gebhart MJ, de Azambuja E (أغسطس 2011)، "Role of the multidisciplinary team in breast cancer management: results from a large international survey involving 39 countries"، Annals of Oncology، 23 (4): 853–9، doi:10.1093/annonc/mdr352، PMID 21821551.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Holmes MD, Chen WY, Li L, Hertzmark E, Spiegelman D, Hankinson SE (2010)، "Aspirin Intake and Survival After Breast Cancer"، Journal of Clinical Oncology، 28 (9): 1467–72، doi:10.1200/JCO.2009.22.7918، PMC 2849768، PMID 20159825.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ting Bao, Michelle A Rudek (2011)، "The Clinical Pharmacology of Anastrozole"، European Oncology & Haematology، 7 (2): 106–8، مؤرشف من الأصل في 14 أكتوبر 2018.
- Burstein؛ Temin؛ Anderson؛ Buchholz؛ Davidson؛ Gelmon؛ Giordano؛ Hudis؛ Rowden؛ Solky, AJ؛ Stearns, V؛ Winer, EP؛ Griggs, JJ (27 مايو 2014)، "Adjuvant Endocrine Therapy for Women With Hormone Receptor-Positive Breast Cancer: American Society of Clinical Oncology Clinical Practice Guideline Focused Update."، Journal of clinical oncology : official journal of the American Society of Clinical Oncology، 32 (21): 2255–69، doi:10.1200/JCO.2013.54.2258، PMID 24868023.
- Early Breast Cancer Trialists' Collaborative Group (23 يوليو 2015)، "Aromatase inhibitors versus tamoxifen in early breast cancer: patient-level meta-analysis of the randomised trials"، The Lancet، doi:10.1016/S0140-6736(15)61074-1.
- Petit T, Dufour P, Tannock I (يونيو 2011)، "A critical evaluation of the role of aromatase inhibitors as adjuvant therapy for postmenopausal women with breast cancer"، Endocr. Relat. Cancer، 18 (3): R79–89، doi:10.1530/ERC-10-0162، PMID 21502311.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Jahanzeb M (أغسطس 2008)، "Adjuvant trastuzumab therapy for HER2-positive breast cancer"، Clin. Breast Cancer، 8 (4): 324–33، doi:10.3816/CBC.2008.n.037، PMID 18757259.
- "Entrez Gene: ERBB2 v-erb-b2 erythroblastic leukemia viral oncogene homolog 2, neuro/glioblastoma derived oncogene homolog (avian)"، مؤرشف من الأصل في 26 أكتوبر 2009، اطلع عليه بتاريخ 17 نوفمبر 2015.
- "Herceptin (trastuzumab) Adjuvant HER2+ Breast Cancer Therapy Pivotal Studies and Efficacy Data"، Herceptin.com، مؤرشف من الأصل في 18 يوليو 2011، اطلع عليه بتاريخ 08 مايو 2010.
- Massarut S, Baldassare G, Belleti B, Reccanello S, D'Andrea S, Ezio C, Perin T, Roncadin M, Vaidya JS (2006)، "Intraoperative radiotherapy impairs breast cancer cell motility induced by surgical wound fluid"، J Clin Oncol، 24 (18S): 10611، مؤرشف من الأصل في 16 يناير 2013.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Belletti B, Vaidya JS, D'Andrea S, Entschladen F, Roncadin M, Lovat F, Berton S, Perin T, Candiani E, Reccanello S, Veronesi A, Canzonieri V, Trovò MG, Zaenker KS, Colombatti A, Baldassarre G, Massarut S (مارس 2008)، "Targeted intraoperative radiotherapy impairs the stimulation of breast cancer cell proliferation and invasion caused by surgical wounding"، Clin. Cancer Res.، 14 (5): 1325–32، doi:10.1158/1078-0432.CCR-07-4453، PMID 18316551.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Jayant S Vaidya، "TARGIT IORT for breast cancer"، Jayantvaidya.org، مؤرشف من الأصل في 18 نوفمبر 2016، اطلع عليه بتاريخ 15 أكتوبر 2015.
- Vaidya JS, Joseph DJ, Tobias JS, Bulsara M, Wenz F, Saunders C, Alvarado M, Flyger HL, Massarut S, Eiermann W, Keshtgar M, Dewar J, Kraus-Tiefenbacher U, Sütterlin M, Esserman L, Holtveg HM, Roncadin M, Pigorsch S, Metaxas M, Falzon M, Matthews A, Corica T, Williams NR, Baum M (يوليو 2010)، "Targeted intraoperative radiotherapy versus whole breast radiotherapy for breast cancer (TARGIT-A trial): an international, prospective, randomised, non-inferiority phase 3 trial"، Lancet، 376 (9735): 91–102، doi:10.1016/S0140-6736(10)60837-9، PMID 20570343.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "Radiation Therapy"، Breastcancer.org، مؤرشف من الأصل في 24 أبريل 2019، اطلع عليه بتاريخ 17 نوفمبر 2015.
- "Breast Cancer: Breast Disorders: Merck Manual Professional"، Merck.com، مؤرشف من الأصل في 12 أبريل 2015، اطلع عليه بتاريخ 08 مايو 2010.
- "Surgery Choices for Women with Early Stage Breast Cancer" (PDF)، National Cancer Institute and the National Research Center for Women & Families، أغسطس 2004، مؤرشف من الأصل (PDF) في 13 أغسطس 2013.[وصلة مكسورة]
- Gonzalez-Angulo AM, Litton JK, Broglio KR, Meric-Bernstam F, Rakkhit R, Cardoso F, Peintinger F, Hanrahan EO, Sahin A, Guray M, Larsimont D, Feoli F, Stranzl H, Buchholz TA, Valero V, Theriault R, Piccart-Gebhart M, Ravdin PM, Berry DA, Hortobagyi GN (ديسمبر 2009)، "High risk of recurrence for patients with breast cancer who have human epidermal growth factor receptor 2-positive, node-negative tumors 1 cm or smaller"، J. Clin. Oncol.، 27 (34): 5700–6، doi:10.1200/JCO.2009.23.2025، PMC 2792998، PMID 19884543.
{{استشهاد بدورية محكمة}}: الاستشهاد يستخدم وسيط مهمل|lay-url=(مساعدة)، روابط خارجية في|laysummary= - "Breast Cancer: Breast Disorders: Merck Manual Professional"، Merck.com، مؤرشف من الأصل في 12 أبريل 2015، اطلع عليه بتاريخ 14 نوفمبر 2010.
- Elston CW, Ellis IO (نوفمبر 1991)، "Pathological prognostic factors in breast cancer. I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up"، Histopathology، 19 (5): 403–10، doi:10.1111/j.1365-2559.1991.tb00229.x، PMID 1757079.
- Peppercorn J (2009)، "Breast Cancer in Women Under 40"، Oncology، 23 (6)، مؤرشف من الأصل في 16 يونيو 2009.
- Brandt؛ Garne؛ Tengrup؛ Manjer (2015)، "Age at diagnosis in relation to survival following breast cancer: a cohort study"، World Journal of Surgical Oncology، 13 (1): 33، doi:10.1186/s12957-014-0429-x، ISSN 1477-7819.
- Klein, Judith، "Differences in male breast cancer stage, tumor size at diagnosis, and survival rate between metropolitan and nonmetropolitan regions"، Proquest، مؤرشف من الأصل في 12 مارس 2014، اطلع عليه بتاريخ 07 ديسمبر 2012.
- Pritchard KI (2009)، "Ovarian Suppression/Ablation in Premenopausal ER-Positive Breast Cancer Patients"، Oncology، 23 (1)، مؤرشف من الأصل في 15 أغسطس 2011.
- Robb C, Haley WE, Balducci L, Extermann M, Perkins EA, Small BJ, Mortimer J (أبريل 2007)، "Impact of breast cancer survivorship on quality of life in older women"، Critical Reviews in Oncology/hematology، 62 (1): 84–91، doi:10.1016/j.critrevonc.2006.11.003، PMID 17188505.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "WHO Disease and injury country estimates"، World Health Organization، 2009، مؤرشف من الأصل في 11 فبراير 2014، اطلع عليه بتاريخ 11 نوفمبر 2009.
- "World Cancer Report"، الوكالة الدولية لأبحاث السرطان، 2008.
{{استشهاد ويب}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)، الوسيط|مسار=غير موجود أو فارع (مساعدة) (cancer statistics often exclude non-melanoma skin cancers such as سرطانة الخلايا القاعدية, which are common but rarely fatal) - "Breast cancer: prevention and control"، World Health Organization، مؤرشف من الأصل في 20 مايو 2019.
- World Cancer Report 2014، International Agency for Research on Cancer, World Health Organization، 2014، ISBN 978-92-832-0432-9.
- Stewart B. W. and Kleihues P. (Eds): World Cancer Report. IARCPress. Lyon 2003 تم أرشفته 20 أكتوبر 2008 بواسطة آلة واي باك نسخة محفوظة 02 ديسمبر 2014 على موقع واي باك مشين.
- Ehrenreich, Barbara (نوفمبر 2001)، "Welcome to Cancerland"، مجلة هاربرز، مؤرشف من الأصل في 08 نوفمبر 2013.
- "Breast Cancer: Statistics on Incidence, Survival, and Screening"، Imaginis Corporation، 2006، مؤرشف من الأصل في 3 أبريل 2010، اطلع عليه بتاريخ 09 أكتوبر 2006.
- Breast Cancer: Breast Cancer in Young Women WebMD. Retrieved 9 September 2009 نسخة محفوظة 01 فبراير 2014 على موقع واي باك مشين.
- Nearly 85% of women diagnosed with breast cancer now survive for 5 year or more Office for National Statistics, 2013 نسخة محفوظة 14 أكتوبر 2015 على موقع واي باك مشين.
- McGuire؛ Brown؛ Malone؛ McLaughlin؛ Kerin (22 مايو 2015)، "Effects of age on the detection and management of breast cancer."، Cancers، 7 (2): 908–29، doi:10.3390/cancers7020815، PMID 26010605.
- Olson, James Stuart (2002)، Bathsheba's breast: women, cancer & history، Baltimore: The Johns Hopkins University Press، ص. 9–13، ISBN 0-8018-6936-6.
{{استشهاد بكتاب}}: الوسيط|ref=harvغير صالح (مساعدة) - "Oldest evidence of breast cancer found in Egyptian skeleton"، Reuters، 24 مارس 2015، مؤرشف من الأصل في 12 مايو 2015، اطلع عليه بتاريخ 25 مارس 2015.
- "The History of Cancer"، American Cancer Society، 25 مارس 2002، مؤرشف من الأصل في 17 مارس 2010، اطلع عليه بتاريخ 09 أكتوبر 2006.
- Olson 2002، صفحات 32–33
- Yalom, Marilyn (1997)، A history of the breast، New York: Alfred A. Knopf، ص. 234، ISBN 0-679-43459-3، مؤرشف من الأصل في 9 أغسطس 2020.
- Aronowitz, Robert A. (2007)، Unnatural history: breast cancer and American society، Cambridge, UK: Cambridge University Press، ص. 22–24، ISBN 0-521-82249-1، مؤرشف من الأصل في 9 أغسطس 2020.
- "History of Breast Cancer"، Random History، 27 فبراير 2008، مؤرشف من الأصل في 13 أبريل 2018، اطلع عليه بتاريخ 08 مايو 2010.
- Olson 2002، صفحة 1
- Olson 2002، صفحات 102–6
- Marc Lacroix (2011)، A Concise History of Breast Cancer، USA: Nova Science Publishers، ص. 59–68، ISBN 978-1-61122-305-7.
- Olson 2002، صفحات 26,28,229
- Alfredo Morabia (2004)، A History of Epidemiologic Methods and Concepts، Boston: Birkhauser، ص. 301–302، ISBN 3-7643-6818-7، مؤرشف من الأصل في 01 مارس 2020، اطلع عليه بتاريخ 31 ديسمبر 2007.
- Sulik, Gayle A. (2010)، Pink Ribbon Blues: How Breast Cancer Culture Undermines Women's Health، USA: Oxford University Press، ص. 200–3، ISBN 0-19-974045-3، OCLC 535493589، مؤرشف من الأصل في 15 أكتوبر 2021.
{{استشهاد بكتاب}}: الوسيط|ref=harvغير صالح (مساعدة) - Sulik 2010، صفحات 37–38
- Sulik 2010، صفحة 4
- Bob Riter، "History of Breast Cancer Advocacy"، Cancer Resource Center of the Finger Lakes، مؤرشف من الأصل في 8 سبتمبر 2015، اطلع عليه بتاريخ 29 يونيو 2013.
- Sulik 2010، صفحات 27–72
- Sulik 2010، صفحات 359–361
- Sulik 2010، صفحات 366–8
- Landeman, Anne (11 يونيو 2008)، "Pinkwashing: Can Shopping Cure Breast Cancer?"، Center for Media and Democracy، مؤرشف من الأصل في 28 أبريل 2019.
- Sulik 2010، صفحات 365–6
- Breast cancer month overshadowed by 'pinkwashing' 9 October 2010, Angela Mulholland, CTV.ca News نسخة محفوظة 03 يناير 2012 على موقع واي باك مشين.
- Ehrenreich, Barbara (نوفمبر 2001)، "Welcome to Cancerland"، مجلة هاربرز، مؤرشف من الأصل في 08 نوفمبر 2013.[وصلة مكسورة]
- Sulik 2010، صفحة 57
- Browne, Anthony (07 أكتوبر 2001)، "Cancer bias puts breasts first"، الغارديان، London، مؤرشف من الأصل في 30 يونيو 2013.
- Arnst, Catherine (13 يونيو 2007)، "A Gender Gap in Cancer"، بلومبيرغ بيزنس ويك، ISSN 0007-7135، مؤرشف من الأصل في 29 مايو 2012.
- Olson 2002، صفحات 199–200
- Ave, Melanie (10 أكتوبر 2006)، "Tampabay: All May Not Be in the Pink"، تامبا باي تاميز، مؤرشف من الأصل في 02 فبراير 2017.
- Aschwanden, Christie (17 أغسطس 2009)، "The Trouble with Mammograms"، لوس أنجلوس تايمز، مؤرشف من الأصل في 04 مارس 2016.
- Azim HA؛ Santoro؛ Russell-Edu؛ Pentheroudakis؛ Pavlidis؛ Peccatori (نوفمبر 2012)، "Prognosis of pregnancy-associated breast cancer: a meta-analysis of 30 studies."، Cancer treatment reviews، 38 (7): 834–42، doi:10.1016/j.ctrv.2012.06.004، PMID 22785217.
- Schedin (أبريل 2006)، "Pregnancy-associated breast cancer and metastasis."، Nature reviews. Cancer، 6 (4): 281–91، doi:10.1038/nrc1839، PMID 16557280.
- Connie Henke Yarbro, Debra Wujcik, Barbara Holmes Gobel, المحرر (2011)، Cancer nursing: principles and practice (ط. 7)، Jones & Bartlett Publishers، ص. 901–905، ISBN 978-1-4496-1829-2.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المحررون (link) - Gonçalves V, Sehovic I, Quinn G (2013)، "Childbearing attitudes and decisions of young breast cancer survivors: A systematic review"، Human Reproduction Update، 20 (2): 279–92، doi:10.1093/humupd/dmt039، PMC 3922144، PMID 24077938.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - McNaught J, Reid RL, Provencher DM؛ وآخرون (يوليو 2006)، "Progesterone-only and non-hormonal contraception in the breast cancer survivor: Joint Review and Committee Opinion of the Society of Obstetricians and Gynaecologists of Canada and the Society of Gynecologic Oncologists of Canada"، J Obstet Gynaecol Can، 28 (7): 616–39، PMID 16924781.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Management of the menopause after breast cancer, from the Royal Australian and New Zealand College of Obstetricians and Gynaecologists. College Statement C-Gyn 15. 1st Endorsed: February 2003. Current: November 2011. Review: November 2014 نسخة محفوظة 20 مارس 2016 على موقع واي باك مشين.
- San Antonio Breast Cancer Symposium Abstracts, newsletters, and other reports of the meeting. نسخة محفوظة 16 مايو 2010 على موقع واي باك مشين.
- Goldhirsch A, Ingle JN, Gelber RD, Coates AS, Thürlimann B, Senn HJ (أغسطس 2009)، "Thresholds for therapies: highlights of the St Gallen International Expert Consensus on the primary therapy of early breast cancer 2009"، Annals of Oncology، 20 (8): 1319–29، doi:10.1093/annonc/mdp322، PMC 2720818، PMID 19535820.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "What's new in breast cancer research and treatment?"، Cancer، مؤرشف من الأصل في 30 ديسمبر 2016، اطلع عليه بتاريخ 17 نوفمبر 2015.
- "Fenretinide (4-HPR): A Preventive Chance for Women at Genetic and Familial Risk?"، hindawi، مؤرشف من الأصل في 11 يوليو 2018، اطلع عليه بتاريخ 17 نوفمبر 2015.
- Sabel (يوليو 2014)، "Nonsurgical ablation of breast cancer: future options for small breast tumors."، Surgical oncology clinics of North America، 23 (3): 593–608، doi:10.1016/j.soc.2014.03.009، PMID 24882353.
- Roubidoux؛ Yang؛ Stafford (مارس 2014)، "Image-guided ablation in breast cancer treatment."، Techniques in vascular and interventional radiology، 17 (1): 49–54، doi:10.1053/j.tvir.2013.12.008، PMID 24636331.
- "Current Status of Imaging-Guided Percutaneous Ablation of Breast Cancer"، American Journal of Roentgenology، 203 (2): 442–448، أغسطس 2014، doi:10.2214/AJR.13.11600.
- Jauliac S, López-Rodriguez C, Shaw LM, Brown LF, Rao A, Toker A (يوليو 2002)، "The role of NFAT transcription factors in integrin-mediated carcinoma invasion."، Nature Cell Biology، 4 (7): 540–4، doi:10.1038/ncb816، PMID 12080349.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Yoeli-Lerner M, Yiu GK, Rabinovitz I, Erhardt P, Jauliac S, Toker A (23 نوفمبر 2005)، "Akt blocks breast cancer cell motility and invasion through the transcription factor NFAT."، Molecular Cell، 20 (4): 539–50، doi:10.1016/j.molcel.2005.10.033، PMID 16307918.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Fougère M, Gaudineau B, Barbier J, Guaddachi F, Feugeas JP, Auboeuf D, Jauliac S (15 أبريل 2010)، "NFAT3 transcription factor inhibits breast cancer cell motility by targeting the Lipocalin 2 gene."، Oncogene، 29 (15): 2292–301، doi:10.1038/onc.2009.499، PMID 20101218.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Gaudineau B, Fougère M, Guaddachi F, Lemoine F, de la Grange P, Jauliac S (01 أكتوبر 2012)، "Lipocalin 2 (LCN2), the TNF-like receptor TWEAKR and its ligand TWEAK act downstream of NFAT1 to regulate breast cancer cell invasion."، Journal of Cell Science، 125 (19): 4475–4486، doi:10.1242/jcs.099879، PMID 22767506.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Duffy MJ (2001)، "Biochemical markers in breast cancer: which ones are clinically useful?"، Clin Biochem، 34 (5): 347–52، doi:10.1016/s0009-9120(00)00201-0، PMID 11522269، مؤرشف من الأصل في 16 مارس 2020.
- Goldstein NS, Decker D, Severson D, Schell S, Vicini F, Margolis J؛ وآخرون (2007)، "Molecular classification system identifies invasive breast carcinoma patients who are most likely and those who are least likely to achieve a complete pathologic response after neoadjuvant chemotherapy."، Cancer، 110 (8): 1687–96، doi:10.1002/cncr.22981، PMID 17722109، مؤرشف من الأصل في 16 مارس 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Mohammadzadeh F, Mosayebi G, Montazeri V, Darabi M, Fayezi S, Shaaker M؛ وآخرون (2014)، "Fatty Acid Composition of Tissue Cultured Breast Carcinoma and the Effect of Stearoyl-CoA Desaturase 1 Inhibition."، J Breast Cancer، 17 (2): 136–42، doi:10.4048/jbc.2014.17.2.136، PMC 4090315، PMID 25013434، مؤرشف من الأصل في 16 مارس 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ranson M, Andronicos NM (2003)، "Plasminogen binding and cancer: promises and pitfalls."، Front Biosci، 8: s294-304، doi:10.2741/1044، PMID 12700073، مؤرشف من الأصل في 16 مارس 2020.
- Holder AM, Gonzalez-Angulo AM, Chen H, Akcakanat A, Do KA, Fraser Symmans W؛ وآخرون (2013)، "High stearoyl-CoA desaturase 1 expression is associated with shorter survival in breast cancer patients."، Breast Cancer Res Treat، 137 (1): 319–27، doi:10.1007/s10549-012-2354-4، PMC 3556743، PMID 23208590، مؤرشف من الأصل في 16 مارس 2020.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
- بوابة صحة المرأة
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي
- بوابة علم الأحياء
- بوابة المرأة

