سيزيوم
السيزيوم، (Caesium تهجئة IUPAC [2]) (تهجئة cesium بالإنجليزية الأمريكية)[7] هو عنصر كيميائي برمز Cs والعدد الذري 55. وهو فلز قلوي ناعم ذهبي فضي مع نقطة انصهار تبلغ 28.5 °م (83.3 °ف)، مما يجعله واحدًا من خمسة معادن أساسية فقط تكون سائلة عند درجة حرارة الغرفة أو ما يقرب إليها.[8] للسيزيوم خواص فيزيائية وكيميائية مشابهة لتلك الخاصة بالروبيديوم والبوتاسيوم. هو الأكثر تفاعلًا بين جميع المعادن، وهو قابل للاشتعال ويتفاعل مع الماء حتى عند −116 °م (−177 °ف). وهو العنصر الأقل كهربية، بقيمة 0.79 على مقياس بولينغ. له نظير ثابت واحد هو السيزيوم 133. يُستخرج السيزيوم في الغالب من البوليسيت، بينما تُستخرج النظائر المشعة، وخاصة السيزيوم 137، وهو ناتج انشطاري، من النفايات التي تنتجها المفاعلات النووية.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
فضي إلى ذهبي | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | سيزيوم، 55، Cs | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز قلوي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 1، 6، s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 132.9054519 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Xe]; 6s1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 18, 8, 1 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 1.93 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 1.843 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 301.59 ك، 28.44 °س، 83.19 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 944 ك، 671 °س، 1240 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النقطة الحرجة | 1938 ك، 9.4 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 2.09 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 63.9 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 32.210 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 1 (أكاسيده قاعدية قوية) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 0.79 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 375.7 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 2234.3 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3400 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 265 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 11±244 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 343 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الجسم | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 205 أوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 35.9 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 97 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 1.7 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 1.6 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 0.2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 0.14 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-46-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر السيزيوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
اكتشف الكيميائي الألماني روبرت بنسن والفيزيائي جوستاف كيرشوف السيزيوم في عام 1860 بطريقة مطيافية الانبعاث الذري المطورة حديثًا آنذاك. كانت التطبيقات الصغيرة الأولى للسيزيوم بمثابة «جامع» في الأنابيب المفرغة وفي الخلايا الكهروضوئية. في عام 1967، بناءً على دليل أينشتاين على أن سرعة الضوء هي البعد الأكثر ثباتًا في الكون، استخدم النظام الدولي للوحدات عدَدين موجيين محددين من طيف انبعاث السيزيوم -133 ليشارك في تعريف الثانية والمتر. منذ ذلك الحين، استخدم السيزيوم على نطاق واسع في الساعات الذرية عالية الدقة.
منذ التسعينيات، كان أكبر تطبيق للعنصر هو فورمات السيزيوم لسوائل الحفر، ولكن له مجموعة من التطبيقات في إنتاج الكهرباء والإلكترونيات والكيمياء. يبلغ عمر النصف للنظير المشع السيزيوم 137 حوالي 30 عامًا ويستخدم في التطبيقات الطبية والمقاييس الصناعية والهيدرولوجيا. تعتبر مركبات السيزيوم غير المشعة سامة بشكل معتدل، ولكن ميل المعدن النقي للتفاعل بشكل متفجر مع الماء يعني أن السيزيوم يعتبر مادة خطرة، وأن النظائر المشعة تمثل خطرًا صحيًا وبيئيًا كبيرًا في البيئة.
يتم الحصول على الجزء الأكبر من فلز السيزيوم من كلوريد السيزيوم بعملية كيميائية. ويتأين السيزيوم بسهولة عندما يسخن أو يعرض للضوء، حيث يتميز بالخاصية الكهروضوئية، وبسبب هذه الخاصية يستخدم السيزيوم في صمامات المضاعف الضوئي التي تقيس الضوء الضعيف جدًا. ويدرس العلماء استعمال السيزيوم وقودًا في محركات الدَّسر الأيوني في العربات الفضائية، كما أنهم يجرون تجارب على أساليب توليد القدرة التي تدخل فيها عملية تأيين السيزيوم.
أملاح السيزيوم تعطي لونا أزرقا بنفسجيا عند تعريضها للمنطقة غير المضيئة في لهب بنزن.
الاكتشاف
اكتشف السيزيوم العالمان الألمانيان روبرت بنسن وغوستاف روبرت كيرشهوف عام 1860م خلال التحليل الطيفي للمياه المعدنية في بلدة دوركهايم[9]، وفي عام 1882م تمكن الكيميائي كارل ستربرگ من عزل الفلز النقي.
اكتشف السيزيوم الذي أخذ اسمه من الكلمة اللاتينية (caesius) التي تعني أزرق سماوي بسبب اللون الأزرق الفاتح الذي يوجد في طيف الانبعاث. يعتبرالسيزيوم العنصر الأول الذي يكتشف بطريقة التحليل الطيفي وليس بطريقة كيمائية. يستخدم أيضاً في تصميم مناظير الرؤية الليلية نظراً لقدرته على الاستغناء عن إلكترونه بتأثير الأشعة تحت الحمراء.
مميزاته
الخصائص الفيزيائية

من بين جميع العناصر التي تكون صلبة في درجة حرارة الغرفة، يعتبر السيزيوم أنعم: فهو يحتوي على صلابة 0.2 موس. إنه معدن شاحب مطيل للغاية، يغمق في وجود كميات ضئيلة من الأكسجين.[10][11][12] عند وجود الزيت المعدني (حيث من الأفضل الاحتفاظ به أثناء النقل)، فإنه يفقد بريقه المعدني ويأخذ مظهرًا رمادي باهتًا. تبلغ درجة انصهاره 28.5 °م (83.3 °ف)، مما يجعلها واحدة من المعادن الأساسية القليلة التي تكون سائلة بالقرب من درجة حرارة الغرفة. الزئبق هو المعدن الأساسي المستقر الوحيد مع نقطة انصهار معروفة أقل من السيزيوم. [14] [15] بالإضافة إلى ذلك، يحتوي المعدن على درجة غليان منخفضة نوعًا ما، 641 °م (1,186 °ف)، وهو أدنى مستوى بين جميع المعادن غير الزئبق.[16] مركباته تحترق باللون الأزرق [17][18] أو البنفسجي.[18]
يشكل السيزيوم سبائك مع المعادن القلوية الأخرى والذهب والزئبق (الملغم). في درجات حرارة أقل من 650 °م (1,202 °ف)، فهي لا تتشابك مع الكوبالت أو الحديد أو الموليبدينوم أو النيكل أو البلاتين أو التنتالوم أو التنجستن. إنه يشكل مركبات بين المعادن محددة جيدًا مع الأنتيمون والغاليوم والإنديوم والثوريوم، وهي حساسة للضوء.[10] يمتزج مع جميع المعادن القلوية الأخرى (باستثناء الليثيوم)؛ السبيكة ذات التوزيع المولي من 41٪ سيزيوم، 47٪ بوتاسيوم، و12٪ صوديوم لديها أدنى نقطة انصهار من أي سبيكة معدنية معروفة، عند −78 °م (−108 °ف).[15][19] تمت دراسة عدد CsHg2 أسود مع بريق معدني أرجواني، بينما CsHg ذهبي اللون، وله بريق معدني أيضًا.[20]
يأتي اللون الذهبي للسيزيوم من تناقص وتيرة الضوء المطلوب لإثارة إلكترونات الفلزات القلوية أثناء نزول المجموعة. بالنسبة لليثيوم من خلال الروبيديوم، يكون هذا التردد في الأشعة فوق البنفسجية، ولكن بالنسبة للسيزيوم، فإنه يدخل في النهاية الزرقاء والبنفسجية للطيف. بمعنى آخر، يصبح التردد البلازموني للمعادن القلوية أقل من الليثيوم إلى السيزيوم. وهكذا ينقل السيزيوم ويمتص جزئيًا الضوء البنفسجي بشكل تفضيلي بينما تنعكس الألوان الأخرى (ذات التردد المنخفض)؛ ومن ثم يبدو مصفر.[21]
الخواص الكيميائية
معدن السيزيوم شديد التفاعل وشديد الاشتعال. يشتعل تلقائيًا في الهواء، ويتفاعل بشكل انفجاري مع الماء حتى في درجات الحرارة المنخفضة، أكثر من المعادن القلوية الأخرى (المجموعة الأولى من الجدول الدوري).[10] يتفاعل مع الجليد عند درجات حرارة منخفضة تصل إلى −116 °م (−177 °ف).[15] بسبب هذه الفعالية العالية، يُصنف معدن السيزيوم على أنه مادة خطرة. يتم تخزينها وشحنها في هيدروكربونات جافة ومشبعة مثل الزيوت المعدنية. يمكن التعامل معها فقط تحت غاز خامل، مثل الأرجون. ومع ذلك، فإن انفجار ماء السيزيوم غالبًا ما يكون أقل قوة من انفجار ماء الصوديوم بكمية مماثلة من الصوديوم. وذلك لأن السيزيوم ينفجر فورًا عند ملامسته للماء، مما يترك القليل من الوقت لتراكم الهيدروجين.[22] يمكن تخزين السيزيوم في أمبولات زجاجية من البورسليكات محكمة الغلق. بكميات تزيد عن حوالي 100 غرام (3.5 أونصة)، يتم شحن السيزيوم في حاويات محكمة الغلق من الفولاذ المقاوم للصدأ.[10]
مركبات

تحتوي معظم مركبات السيزيوم على العنصر مثل الكاتيون Cs+، الذي يرتبط أيونيًا بمجموعة متنوعة من الأنيونات. أحد الاستثناءات الجديرة بالملاحظة هو الأنيون القيصري Cs−)، [23] وأخرى هي الأكاسيد الفرعية المتعددة (انظر قسم الأكاسيد أدناه).
عادة ما تكون أملاح Cs + عديمة اللون ما لم يكن الأنيون نفسه ملونًا. العديد من الأملاح البسيطة ماصة للرطوبة، ولكن أقل من الأملاح المقابلة للمعادن القلوية الأخف. الفوسفات، [24] الأسيتات، والكربونات، والهاليدات، والأكسيد، والنترات، وأملاح الكبريتات قابلة للذوبان في الماء. غالبًا ما تكون الأملاح المزدوجة أقل قابلية للذوبان، ويتم استغلال قابلية الذوبان المنخفضة لكبريتات الألومنيوم السيزيوم في تكرير Cs من الخامات. الملح المزدوج مع الأنتيمون (مثل CsSbCl4) والبزموت والكادميوم والنحاس والحديد والرصاص هي أيضا ضعيفة الذوبان.[10]
هيدروكسيد السيزيوم (CsOH) هو استرطابي وبقوة الأساسية.[25] يحفر سطح أشباه الموصلات بسرعة مثل السيليكون.[26] اعتبر الكيميائيون سابقًا CsOH على أنه «أقوى قاعدة»، مما يعكس الجاذبية الضعيفة نسبيًا بين Cs + أيون الكبير وOH - ؛ [17] إنها بالفعل أقوى قاعدة أرهينيوس. ومع ذلك، فإن عددا من المركبات مثل ن-بوتيل الليثيوم، أميد الصوديوم، هيدريد الصوديوم، السيزيوم هيدريد، الخ، والتي لا يمكن حله في الماء كما يتفاعل بعنف مع ذلك، ولكن بدلا يستخدم فقط في بعض اللامائية المذيبات ابروتوني القطبية، هي أكثر بكثير الأساسية على أساس نظرية برونستيد - لوري أسيد - قاعدية.[25]
سيتفاعل خليط متكافئ من السيزيوم والذهب لتكوين أوريد السيزيوم الأصفر (Cs + Au -) عند التسخين. أنيون الأوريد هنا يتصرف مثل هالوجين زائف. يتفاعل المركب بعنف مع الماء، وينتج هيدروكسيد السيزيوم، والذهب المعدني، وغاز الهيدروجين؛ في الأمونيا السائلة يمكن أن يتفاعل مع راتينج التبادل الأيوني للسيزيوم لإنتاج أوريد رباعي ميثيل الأمونيوم. ويماثل البلاتين مركب والأحمر السيزيوم بلاتينيد (Cs 2 Pt)، يحتوي على أيون بلاتينيد أن تتصرف كما الزائفة كالكوجين.[27]
مجموعات
مثل كل الكاتيونات المعدنية، تشكل Cs + معقدات مع قواعد لويس في المحلول. نظرًا لحجمها الكبير، تتبنى Cs + عادةً أرقام تنسيق أكبر من 6، وهو الرقم النموذجي للكاتيونات المعدنية القلوية الأصغر. يتضح هذا الاختلاف في التنسيق 8 لـ CsCl. هذا العدد الكبير التنسيق ونعومة (الميل إلى سندات شكل التساهمية) وخصائص استغلالها في فصل جيم + من الكاتيونات الأخرى في معالجة النفايات النووية، حيث يجب فصل 137 Cs + من كميات كبيرة من امشع K +. [28]
هاليدات
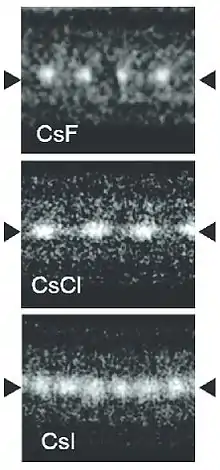
فلوريد السيزيوم (CSF) هو استرطابي صلبة بيضاء يستخدم على نطاق واسع في كيمياء الفلور العضوي كمصدر لل فلوريد الأنيونات.[30] يحتوي فلوريد السيزيوم على بنية الهاليت، مما يعني أن Cs + وF - حزمة في أقرب مجموعة معبأة مثل Na + وCl - في كلوريد الصوديوم.[25] والجدير بالذكر أن السيزيوم والفلور لديهم أدنى وأعلى كهربية، على التوالي، من بين جميع العناصر المعروفة.

يتبلور كلوريد السيزيوم (CsCl) في نظام بلوري مكعب بسيط. يسمى أيضًا «هيكل كلوريد السيزيوم»، [31] يتكون هذا الشكل الهيكلي من شبكة مكعبة بدائية ذات أساس ثنائي الذرة، لكل منها تنسيق ثمانية أضعاف؛ تقع ذرات الكلوريد على النقاط الشبكية عند حواف المكعب، بينما تقع ذرات السيزيوم في الفتحات الموجودة في مركز المكعبات. ويشاطر هذا الهيكل مع CsBr ومنظمة التضامن المسيحي الدولية، والعديد من المركبات الأخرى التي لا تحتوي على خدمات العملاء. في المقابل، تحتوي معظم الهاليدات القلوية الأخرى على هيكل كلوريد الصوديوم (NaCl).[31] يُفضل استخدام بنية CsCl لأن Cs + لها نصف قطر أيوني يبلغ 174 مساءا وCl− 181 مساء.[32]
أكاسيد
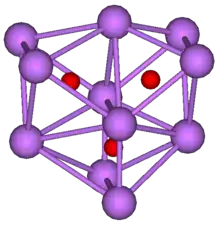
أكثر من المعادن القلوية الأخرى، يشكل السيزيوم العديد من المركبات الثنائية مع الأكسجين. عندما يحترق السيزيوم في الهواء، فإن أكسيد الفائق CsO2 CsO2 هو المنتج الرئيسي.[33] أكسيد السيزيوم «العادي» (Cs2O) تشكل بلورات سداسية [34] وهي الأكسيد الوحيد CdCl2 نوع.[35] يتبخر عند 250 °م (482 °ف)، ويتحلل إلى معدن السيزيوم وبيروكسيد Cs2O2 عند درجات حرارة أعلى من 400 °م (752 °ف). بالإضافة إلى الأكسيد الفائق والأوزون CsO3، [36][37] كما تمت دراسة العديد من الأكاسيد الفرعية ذات الألوان الزاهية.[38] وتشمل هذه Cs7O، Cs4O، Cs11O3، Cs3O (أخضر غامق [39])، CsO، Cs3O2، [40] وكذلك Cs7O2.[41][42] قد يتم تسخين الأخير في فراغ لتوليد Cs2O.[35] توجد أيضًا مركبات ثنائية تحتوي على الكبريت والسيلينيوم والتيلوريوم. [10]
النظائر
يحتوي السيزيوم على 39 نظيرًا معروفًا، تتراوح في العدد الكتلي (أي عدد النيوكليونات في النواة) من 112 إلى 151. يتم تصنيع العديد من هذه العناصر من عناصر أخف من خلال عملية التقاط النيوترون البطيئة (عملية S) داخل النجوم القديمة [43] وبواسطة عملية R في انفجارات المستعر الأعظم. [44] النظير الوحيد المستقر للسيزيوم هو 133 Cs، مع 78 نيوترون. على الرغم من أنه يحتوي على دوران نووي كبير (72 +)، الرنين المغناطيسي النووي يمكن أن الدراسات استخدام هذا النظير على تردد صدى 11.7 ميغا هيرتز.[45]
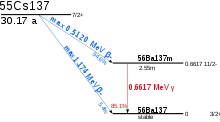
تتمتع 135 Cs المشعة بعمر نصفي طويل جدًا يبلغ حوالي 2.3 مليون سنة، الأطول بين جميع نظائر السيزيوم المشعة. 137 Cs و134 Cs لها فترات نصف عمر 30 وسنتين على التوالي. يتحلل 137 Cs إلى 137m Ba عن طريق تسوس بيتا قصير العمر، ثم إلى الباريوم غير المشع، بينما يتحول 134 Cs إلى 134 Ba مباشرة. تتمتع النظائر ذات الأعداد الكتلية 129 و131 و132 و136 بنصف عمر يتراوح بين يوم وأسبوعين، في حين أن معظم النظائر الأخرى لها نصف عمر من بضع ثوانٍ إلى أجزاء من الثانية. يوجد ما لا يقل عن 21 من الأيزومرات النووية المستقرة. بخلاف 134 مترًا مكعبًا (مع عمر نصف أقل بقليل من 3 ساعات)، كلها غير مستقرة للغاية وتتحلل مع نصف عمر لبضع دقائق أو أقل.[46][47]
يعتبر النظير 135 Cs أحد نواتج الانشطار طويلة العمر لليورانيوم المُنتَج في المفاعلات النووية.[48] ومع ذلك، يتم تقليل إنتاج منتج الانشطار هذا في معظم المفاعلات لأن السلف، 135 Xe، هو سم نيوتروني قوي ويتحول في كثير من الأحيان إلى مستقر 136 Xe قبل أن يتحلل إلى 135 درجة مئوية.[49][50]
اضمحلال بيتا من 137 Cs إلى 137m Ba هو انبعاث قوي لإشعاع غاما.[51] 137 Cs و90 Sr هما المنتجان الرئيسيان متوسط العمر للانشطار النووي، والمصادر الرئيسية للنشاط الإشعاعي من الوقود النووي المستهلك بعد عدة سنوات من التبريد، والتي تدوم عدة مئات من السنين.[49] هذان النظيران هما أكبر مصدر للنشاط الإشعاعي المتبقي في منطقة كارثة تشيرنوبيل.[49] بسبب معدل الالتقاط المنخفض، فإن التخلص من 137 Cs من خلال أسر النيوترون غير ممكن والحل الحالي الوحيد هو السماح لها بالتحلل بمرور الوقت.[52]
تقريبا كل السيزيوم المنتج من الانشطار النووي يأتي من اضمحلال بيتا لمنتجات الانشطار الغنية بالنيوترونات في الأصل، والتي تمر عبر نظائر مختلفة من اليود والزينون.[53] نظرًا لأن اليود والزينون متقلبان ويمكنهما الانتشار من خلال الوقود النووي أو الهواء، غالبًا ما يتم إنشاء السيزيوم المشع بعيدًا عن الموقع الأصلي للانشطار.[54] مع تجارب الأسلحة النووية في الخمسينيات وحتى الثمانينيات، تم إطلاق 137 Cs في الغلاف الجوي وعاد إلى سطح الأرض كعنصر من السقوط الإشعاعي. إنها علامة جاهزة لحركة التربة والرواسب من تلك الأوقات.[10]
حقيقة

السيزيوم عنصر نادر نسبيًا، يقدر بمتوسط 3 أجزاء في المليون في قشرة الأرض.[55] إنه العنصر الخامس والأربعون الأكثر وفرة والمركز السادس والثلاثون بين المعادن. ومع ذلك، فهو أكثر وفرة من عناصر مثل الأنتيمون، والكادميوم، والقصدير، والتنغستن، كما أنه أكثر وفرة بمرتبتين من الزئبق والفضة؛ إنه 3.3٪ وفير مثل الروبيديوم الذي يرتبط به ارتباطًا وثيقًا كيميائيًا.[10]
بسبب نصف قطره الأيوني الكبير، يعتبر السيزيوم أحد «العناصر غير المتوافقة».[56] أثناء تبلور الصهارة، يتركز السيزيوم في الطور السائل ويتبلور أخيرًا. لذلك، فإن أكبر رواسب السيزيوم هي أجسام خام البغماتيت في المنطقة التي تشكلت بواسطة عملية التخصيب هذه. لأن السيزيوم لا بديلا عن البوتاسيوم كما بسهولة الروبيديوم لا، المعادن القلوية المتبخرات السلفيت (بوكل) وكارنالايت KMgCl3·6H2O) قد تحتوي فقط على 0.002٪ سيزيوم. وبالتالي، يوجد السيزيوم في عدد قليل من المعادن. يمكن العثور على كميات النسبة المئوية من السيزيوم في البريل (Be3Al2(SiO3)6) وأفوجادريت ((K,Cs)BF4)، حتى 15 بالوزن٪ Cs 2 O في البيزوتايت المعدني وثيق الصلة (Cs(Be2Li)Al2Si6O18)، حتى 8.4 بالوزن٪ Cs 2 O في المعادن النادرة في لندنيت ((Cs,K)Al4Be4(B,Be)12O28)، وأقل في الروديزيت الأكثر انتشارًا.[10] الخام الوحيد المهم اقتصاديًا للسيزيوم هو الملوثات Cs(AlSi2O6) التي وجدت في عدد قليل من الأماكن في جميع أنحاء العالم في بيغماتيت مخصصة، ويرتبط مع أكثر تجاريا مهمة الليثيوم المعادن، اللبيدوليت وبيتاليت. داخل البيغماتيت، ينتج عن حجم الحبوب الكبير والفصل القوي للمعادن خامًا عالي الجودة للتعدين.[57]
أهم وأغنى مصدر معروف للسيزيوم في العالم هو منجم تانكو في بحيرة بيرنيك في مانيتوبا، كندا، ويقدر أنه يحتوي على 350.000 الأطنان المترية من خام الملوثات، والتي تمثل أكثر من ثلثي قاعدة احتياطي العالم.[57][58] على الرغم من أن المحتوى المتكافئ للسيزيوم في الملوثات يبلغ 42.6٪، إلا أن عينات الملوثات النقية من هذا الرواسب تحتوي فقط على حوالي 34٪ سيزيوم، بينما يبلغ متوسط المحتوى 24 بالوزن ٪.[58] يحتوي الملوث التجاري على أكثر من 19٪ سيزيوم.[59] وبيكيتا إيداع البغماتيت ضرب من الغرنيت في زيمبابوي ويتم استخراج لبيتاليت، ولكن كما أنه يحتوي على كمية كبيرة من بولوسيت. مصدر آخر بارز للتلوث في صحراء كاريبيب، ناميبيا.[58] بالمعدل الحالي للإنتاج العالمي للمناجم من 5 إلى 10 طن متري في السنة، وسوف تستمر الاحتياطيات لآلاف السنين.[10]
إنتاج
يعد تعدين وتنقية خام الملوثات عملية انتقائية ويتم إجراؤها على نطاق أصغر من معظم المعادن الأخرى. يتم سحق الخام، وفرزه يدويًا، ولكن لا يتم تركيزه عادةً، ثم يتم طحنه. يتم بعد ذلك استخلاص السيزيوم من الملوثات بشكل أساسي من خلال ثلاث طرق: هضم الحمض، والتحلل القلوي، والاختزال المباشر.[10][60]
في عملية الهضم الحمضي، يتم إذابة صخور ملوثات السيليكات بأحماض قوية، مثل الهيدروكلوريك (HCl)، والكبريتيك (H2SO4)، أحماض هيدروبروميك (HBr)، أو هيدروفلوريك (HF). مع حمض الهيدروكلوريك، يتم إنتاج خليط من الكلوريدات الذائبة، ويتم ترسيب أملاح الكلوريد المزدوجة غير القابلة للذوبان من السيزيوم على هيئة كلوريد الأنتيمون السيزيوم (Cs4SbCl7)، كلوريد اليود السيزيوم (Cs2ICl)، أو سداسي كلور السيزيوم (Cs2(CeCl6)). بعد الفصل، يتحلل الملح المزدوج المترسب النقي، ويتم ترسيب CsCl النقي عن طريق تبخير الماء.
ينتج عن طريقة حمض الكبريتيك الملح المزدوج غير القابل للذوبان مباشرة مثل شب السيزيوم (CsAl(SO4)2·12H2O). وكبريتات الألمنيوم يتم تحويل عنصر إلى غير قابلة للذوبان أكسيد الألومنيوم عن طريق تحميص الشب مع الكربون، والمنتج الناتجة ترشح بالماء لتسفر عن Cs2SO4 حل.[10]
تحميص التلوث بكربونات الكالسيوم وكلوريد الكالسيوم ينتج سيليكات الكالسيوم غير القابلة للذوبان وكلوريد السيزيوم القابل للذوبان. النض بالماء أو الأمونيا المخففة (NH4OH) ينتج محلول كلوريد مخفف (CsCl). يمكن تبخير هذا المحلول لإنتاج كلوريد السيزيوم أو تحويله إلى شب السيزيوم أو كربونات السيزيوم. على الرغم من أنه ليس مجديًا تجاريًا، يمكن تقليل الخام مباشرة بالبوتاسيوم أو الصوديوم أو الكالسيوم في الفراغ يمكن أن ينتج معدن السيزيوم مباشرة.[10]
يتم تحويل معظم السيزيوم المستخرج (مثل الأملاح) مباشرة إلى فورمات السيزيوم (HCOO - Cs +) لتطبيقات مثل التنقيب عن النفط. لتزويد السوق النامية، قامت شركة كابوت ببناء مصنع إنتاج في عام 1997 في منجم تانكو بالقرب من بحيرة بيرنيك في مانيتوبا، بسعة 12,000 برميل (1,900 م3) سنويا من محلول فورمات السيزيوم.[61] المركبات التجارية الأولية الأصغر حجمًا للسيزيوم هي كلوريد ونترات السيزيوم.[62]
بشكل بديل، يمكن الحصول على فلز السيزيوم من المركبات النقية المشتقة من الركاز. يمكن تقليل كلوريد السيزيوم وهاليدات السيزيوم الأخرى عند 700 إلى 800 °م (1,292 إلى 1,472 °ف) مع الكالسيوم أو الباريوم، ومعدن السيزيوم المقطر من النتيجة. بنفس الطريقة، يمكن تقليل الألومينات أو الكربونات أو الهيدروكسيد بواسطة المغنيسيوم.[10]
يمكن أيضًا عزل المعدن عن طريق التحليل الكهربائي لسيانيد السيزيوم المنصهر (CsCN). يمكن إنتاج سيزيوم نقي وخالي من الغاز بشكل استثنائي بواسطة 390 °م (734 °ف) التحلل الحراري من السيزيوم أزيد CsN3، والتي يمكن إنتاجها من كبريتات السيزيوم المائية وأزيد الباريوم.[60] في تطبيقات الفراغ، يمكن أن يتفاعل ثنائي كرومات السيزيوم مع الزركونيوم لإنتاج معدن سيزيوم نقي بدون منتجات غازية أخرى.[62]
- Cs2Cr2O7 + 2 Zr → 2 Cs + 2 ZrO2+ Cr2O3
كان سعر السيزيوم النقي 99.8٪ (أساس معدني) في عام 2009 حوالي $10 لكل غرام ($280/أونصة)، لكن المركبات أرخص بكثير.[58]
تاريخ

في عام 1860، اكتشف روبرت بنسن وجوستاف كيرشوف السيزيوم في المياه المعدنية من دوركهايم بألمانيا. بسبب الخطوط الزرقاء الساطعة في طيف الانبعاث، اشتقوا الاسم من الكلمة اللاتينية (caesius)، والتي تعني السماء الزرقاء.[note 1][63][64][65] كان السيزيوم أول عنصر يتم اكتشافه باستخدام مطياف، والذي اخترعه بنسن وكيرتشوف قبل عام واحد فقط.[66]
للحصول على عينة نقية من السيزيوم 44,000 لتر (9,700 غالون إمب؛ 12,000 غال-أمريكي) من المياه المعدنية لابد من تبخيرها لإنتاج 240 كيلوغرام (530 رطل) من محلول ملح مركز. ترسبت معادن الأرض القلوية إما على شكل كبريتات أو أكسالات، تاركة المعدن القلوي في المحلول. بعد التحويل إلى النترات والاستخلاص بالإيثانول، يتم الحصول على خليط خالٍ من الصوديوم. من هذا الخليط، تم ترسيب الليثيوم بواسطة كربونات الأمونيوم. يتكون البوتاسيوم والروبيديوم والسيزيوم من أملاح غير قابلة للذوبان مع حمض الكلوروبلاتينيك، ولكن هذه الأملاح تظهر اختلافًا طفيفًا في قابلية الذوبان في الماء الساخن، وتم الحصول على سداسي كلورو بلاتينات السيزيوم والروبيديوم الأقل قابلية للذوبان ((Cs، Rb) 2 PtCl 6) عن طريق التبلور الجزئي. بعد اختزال سداسي كلورو بلاتينات الهيدروجين، تم فصل السيزيوم والروبيديوم عن طريق الاختلاف في قابلية ذوبان كربوناتهم في الكحول. أسفرت العملية عن 9.2 غرام (0.32 أونصة) من كلوريد الروبيديوم و7.3 غرام (0.26 أونصة) من كلوريد السيزيوم من 44000 الأولي لترات من المياه المعدنية.[64]
من كلوريد السيزيوم، قدر العالمان الوزن الذري للعنصر الجديد بـ 123.35 (مقارنةً بالوزن المقبول حاليًا وهو 132.9).[64] لقد حاولوا توليد عنصر السيزيوم عن طريق التحليل الكهربائي لكلوريد السيزيوم المصهور، ولكن بدلاً من المعدن، حصلوا على مادة زرقاء متجانسة «لا تظهر تحت العين المجردة ولا تحت المجهر أدنى أثر للمادة المعدنية»؛ نتيجة لذلك، قاموا بتعيينه على أنه كلوريد فرعي (Cs2Cl). في الواقع، ربما كان المنتج عبارة عن خليط غرواني من المعدن وكلوريد السيزيوم.[67] أدى التحليل الكهربائي للمحلول المائي للكلوريد باستخدام كاثود الزئبق إلى إنتاج ملغم سيزيوم يتحلل بسهولة تحت الظروف المائية.[64] تم عزل المعدن النقي في النهاية من قبل الكيميائي الألماني كارل ستيربيرج أثناء عمله على الدكتوراه مع كيكولي وبونسن.[65] في عام 1882، أنتج معدن السيزيوم عن طريق التحليل الكهربائي للسيانيد، متجنبًا مشاكل الكلوريد.[68]
تاريخيا، كان أهم استخدام للسيزيوم في البحث والتطوير، في المقام الأول في المجالات الكيميائية والكهربائية. كان هناك عدد قليل جدًا من التطبيقات للسيزيوم حتى عشرينيات القرن الماضي، عندما بدأ استخدامه في الأنابيب الفراغية الراديوية، حيث كان له وظيفتان ؛ كجالب، أزال الأكسجين الزائد بعد التصنيع، وكطلاء على الكاثود الساخن، زاد التوصيل الكهربائي. لم يتم التعرف على السيزيوم كمعدن صناعي عالي الأداء حتى الخمسينيات من القرن الماضي.[69] وتضمنت طلبات السيزيوم امشع الخلايا الكهروضوئية، مضخم الأنابيب، والمكونات البصرية ل طيفي الأشعة تحت الحمراء، ومحفزات لعدة التفاعلات العضوية، بلورات ل عدادات التلألؤ، ومولدات الكهرباء المغنطيسية والهيدروديناميكية.[10] يستخدم السيزيوم أيضًا كمصدر للأيونات الموجبة في مقياس الطيف الكتلي الأيوني الثانوي (SIMS).
منذ عام 1967، أسس النظام الدولي للقياسات الوحدة الأولية للوقت، الثانية، على خصائص السيزيوم. يعرّف النظام الدولي للوحدات (SI) الثانية بأنها مدة 9192.631.770 دورة عند تردد الموجات الصغرية للخط الطيفي المقابل للانتقال بين مستويين من الطاقة فائقة الدقة للحالة الأرضية للسيزيوم -133.[70] حدد المؤتمر العام الثالث عشر للأوزان والمقاييس لعام 1967 الثانية على أنها: «مدة 9192.631.770 دورة من ضوء الميكروويف الممتص أو المنبعث من الانتقال فائق الدقة لذرات السيزيوم -133 في حالتها الأرضية دون أن تزعجها الحقول الخارجية».
التطبيقات
نبذة مختصرة
يستخدم السيزيوم في الساعات الذرية، أدوات الحفر النفطية، الألواح الشمسية.يستخدم في علاج سرطان الثدى ومرض هودجكن. يستخدم في صنع الخلايا الكهروَضوئية. قد استفيد من الخواص الكهرضوئية للسيزيوم في تصنيع جهاز الأنتروسكوب الذي يسمح برؤية باطن الأجسام غير الشفافة
التنقيب عن البترول
أكبر استخدام في الوقت الحاضر للسيزيوم غير المشع هو في سوائل حفر فورمات السيزيوم لصناعة النفط الاستخراجي.[10] تم تطوير المحاليل المائية لفورمات السيزيوم (HCOO - Cs +) - التي يتم تصنيعها عن طريق تفاعل هيدروكسيد السيزيوم مع حمض الفورميك - في منتصف التسعينيات لاستخدامها في حفر آبار النفط وسوائل التكميل. تتمثل وظيفة مائع الحفر في تشحيم لقم الثقب، وإحضار قطع الصخور إلى السطح، والحفاظ على الضغط على التكوين أثناء حفر البئر. تساعد سوائل الإنجاز على تمركز أجهزة التحكم بعد الحفر ولكن قبل الإنتاج من خلال الحفاظ على الضغط.[10]
الكثافة العالية لمحلول ملحي فورمات السيزيوم (حتى 2.3 ز / سم 3، أو 19.2 رطل لكل جالون)، [48] جانب الطبيعة الحميدة نسبيًا لمعظم مركبات السيزيوم، يقلل من الحاجة إلى المواد الصلبة المعلقة عالية الكثافة السامة في مائع الحفر - وهي ميزة تكنولوجية وهندسية وبيئية مهمة. على عكس مكونات العديد من السوائل الثقيلة الأخرى، فإن فورمات السيزيوم صديقة للبيئة نسبيًا.[48] يمكن مزج محلول فورمات السيزيوم مع فورمات البوتاسيوم والصوديوم لتقليل كثافة السوائل إلى كثافة الماء (1.0 ز / سم 3، أو 8.3 جنيه لكل جالون). علاوة على ذلك، فهو قابل للتحلل البيولوجي ويمكن إعادة تدويره، وهو أمر مهم نظرًا لارتفاع تكلفته (حوالي 4000 دولار أمريكي) لكل برميل في عام 2001).[71] تعتبر الفورمات القلوية آمنة في التعامل معها ولا تلحق الضرر بالتكوين المنتج أو المعادن الموجودة في قاع البئر كبديل للتآكل، ZnBr2 عالي الكثافة (مثل بروميد الزنك ZnBr2) الحلول) تفعل في بعض الأحيان ؛ كما أنها تتطلب تنظيفًا أقل وتقليل تكاليف التخلص منها.[10]
الساعات الذرية


تستخدم الساعات الذرية القائمة على السيزيوم التحولات الكهرومغناطيسية في البنية فائقة الدقة لذرات السيزيوم -133 كنقطة مرجعية. صنع لويس إيسن أول ساعة دقيقة للسيزيوم في عام 1955 في المختبر الفيزيائي الوطني في المملكة المتحدة.[72] لقد تحسنت ساعات السيزيوم على مدى نصف القرن الماضي وتعتبر «أدق إنجاز للوحدة التي حققتها البشرية حتى الآن».[70] تقيس هذه الساعات التردد بخطأ من 2 إلى 3 أجزاء في 10 14، والتي تتوافق مع دقة 2 نانوثانية في اليوم، أو ثانية واحدة في 1.4 مليون سنين. أحدث الإصدارات أكثر دقة من جزء واحد في 10 15، أي حوالي ثانية واحدة في 20 ملايين السنوات.[10] معيار السيزيوم هو المعيار الأساسي لقياسات الوقت والتردد المتوافقة مع المعايير.[73] تنظم ساعات السيزيوم توقيت شبكات الهاتف الخلوي والإنترنت.[74]
وحدات SI
الرمز الثاني، s، هو وحدة SI للوقت. يتم تعريفه من خلال اتخاذ القيمة العددية الثابتة للتردد السيزيوم ΔνCs ورابط الجأش للدولة أرض الواقع التردد فائق الدقة الانتقال للذرة السيزيوم 133، ليكون 9192631770 عند المعبر عنها بوحدة هرتز، والتي تساوي الصورة −1.
الطاقة الكهربائية والالكترونيات
مولدات بخار السيزيوم الحرارية هي أجهزة منخفضة الطاقة تحول الطاقة الحرارية إلى طاقة كهربائية. في محول الأنبوب المفرغ ثنائي القطب، يعمل السيزيوم على تحييد شحنة الفضاء بالقرب من الكاثود ويعزز تدفق التيار.[75]
السيزيوم مهم أيضًا لخصائصه الضوئية، وتحويل الضوء إلى تدفق الإلكترون. يتم استخدامه في الخلايا الكهروضوئية لأن الكاثودات القائمة على السيزيوم، مثل المركب المعدني K2CsSb، لها جهد عتبة منخفض لانبعاث الإلكترونات.[76] تشتمل مجموعة الأجهزة الضوئية التي تستخدم السيزيوم على أجهزة التعرف الضوئي على الحروف وأنابيب مضاعفة الصور وأنابيب كاميرات الفيديو.[77][78] ومع ذلك، يمكن استبدال السيزيوم في المواد الحساسة للضوء الجرمانيوم والروبيديوم والسيلينيوم والسيليكون والتيلوريوم والعديد من العناصر الأخرى.[10]
يوديد السيزيوم (CSI)، بروميد (CsBr) وفلوريد السيزيوم يعملون (CSF) بلورات ل وماضة في عدادات التلألؤ تستخدم على نطاق واسع في الفيزياء الاستكشاف والجسيمات المعدنية البحوث للكشف عن أشعة غاما والأشعة السينية الإشعاع. لكونه عنصرًا ثقيلًا، يوفر السيزيوم قوة إيقاف جيدة مع اكتشاف أفضل. قد توفر مركبات السيزيوم استجابة أسرع (CsF) وتكون أقل استرطابية (CsI).
يستخدم بخار السيزيوم في العديد من أجهزة قياس المغناطيسية الشائعة.[79]
يستخدم العنصر كمعيار داخلي في القياس الطيفي.[80] مثل المعادن القلوية الأخرى، فإن السيزيوم لديه انجذاب كبير للأكسجين ويستخدم كـ «جامع» في الأنابيب المفرغة.[81] وتشمل استخدامات أخرى من المعدن ذات الطاقة العالية وأشعة الليزر، بخار توهج المصابيح، وبخار مقومات.[10]
سوائل الطرد المركزي
تصنع الكثافة العالية لأيون السيزيوم محاليل كلوريد السيزيوم وكبريتات السيزيوم وثلاثي فلورو أسيتات السيزيوم Cs(O2CCF3) مفيدة في البيولوجيا الجزيئية من أجل تنبذ فائق متدرج الكثافة.[82] تُستخدم هذه التقنية بشكل أساسي في عزل الجزيئات الفيروسية والعضيات تحت الخلوية والكسور والأحماض النووية من العينات البيولوجية.[83]
الاستخدامات الكيميائية والطبية

تستخدم القليل من التطبيقات الكيميائية السيزيوم.[84] يعزز تعاطي المنشطات بمركبات السيزيوم من فعالية العديد من محفزات أيونات الفلز للتخليق الكيميائي، مثل حمض الأكريليك، والأنثراكينون، وأكسيد الإيثيلين، والميثانول، وأنهيدريد الفثاليك، والستايرين، ومونومرات ميثيل ميثاكريلات، والأوليفينات المختلفة. كما أنها تستخدم في التحويل التحفيزي لثاني أكسيد الكبريت إلى ثالث أكسيد الكبريت في إنتاج حامض الكبريتيك.[10]
يتمتع فلوريد السيزيوم بميزة الاستخدام في الكيمياء العضوية كقاعدة [25] وكمصدر لا مائي لأيون الفلوريد. [85] تحل أملاح السيزيوم في بعض الأحيان محل أملاح البوتاسيوم أو الصوديوم في التخليق العضوي، مثل التدوير، والأسترة، والبلمرة. تم استخدام السيزيوم أيضًا في قياس جرعات الإشعاع بالحرارة (TLD) : عند تعرضه للإشعاع، فإنه يكتسب عيوبًا بلورية، عند تسخينها، تعود بانبعاث ضوء يتناسب مع الجرعة المتلقاة. وبالتالي، فإن قياس نبضة الضوء باستخدام أنبوب مضاعف ضوئي يمكن أن يسمح بتقدير جرعة الإشعاع المتراكمة.
التطبيقات النووية والنظيرية
السيزيوم 137 هو نظير مشع شائع الاستخدام كباعث لأشعة جاما في التطبيقات الصناعية. تشمل مزاياها نصف عمر يبلغ حوالي 30 عامًا، وتوفرها من دورة الوقود النووي، و137 Ba كمنتج نهائي مستقر. القابلية العالية للذوبان في الماء هي عيب يجعلها غير متوافقة مع مشعات المسابح الكبيرة للأغذية والمستلزمات الطبية.[86] لقد تم استخدامه في الزراعة وعلاج السرطان وتعقيم الطعام وحمأة الصرف الصحي والمعدات الجراحية.[10][87] تم استخدام النظائر المشعة للسيزيوم في الأجهزة الإشعاعية في المجال الطبي لعلاج أنواع معينة من السرطان، [88] ولكن ظهور بدائل أفضل واستخدام كلوريد السيزيوم القابل للذوبان في الماء في المصادر، مما قد يؤدي إلى تلوث واسع النطاق تدريجيًا ضع بعض مصادر السيزيوم خارج نطاق الاستخدام.[89][90] تم استخدام السيزيوم 137 في مجموعة متنوعة من مقاييس القياس الصناعية، بما في ذلك مقاييس الرطوبة والكثافة والتسوية والسمك.[91] كما تم استخدامه في أجهزة تسجيل الآبار لقياس كثافة الإلكترون للتكوينات الصخرية، وهو ما يماثل الكثافة الظاهرية للتكوينات.[92]
تم استخدام السيزيوم 137 في الدراسات الهيدرولوجية المماثلة لتلك التي تحتوي على التريتيوم. باعتباره منتجًا مبتكرًا لاختبار القنبلة الانشطارية من الخمسينيات وحتى منتصف الثمانينيات، تم إطلاق السيزيوم 137 في الغلاف الجوي، حيث تم امتصاصه بسهولة في المحلول. يسمح التباين المعروف من سنة إلى أخرى خلال تلك الفترة بالارتباط مع طبقات التربة والرواسب. تم استخدام السيزيوم -134، وبدرجة أقل السيزيوم -135، في الهيدرولوجيا لقياس إنتاج السيزيوم في صناعة الطاقة النووية. في حين أنها أقل انتشارًا من أي من السيزيوم 133 أو السيزيوم 137، فإن هذه النظائر الخيطية تنتج فقط من مصادر بشرية المنشأ.[93]
استخدامات أخرى

تم استخدام السيزيوم والزئبق كوقود دافع في المحركات الأيونية المبكرة المصممة لدفع المركبات الفضائية في مهمات طويلة جدًا بين الكواكب أو خارج الكواكب. تأين الوقود بالتلامس مع قطب كهربائي من التنجستن مشحون. لكن التآكل بواسطة السيزيوم على مكونات المركبات الفضائية دفع التطور في اتجاه الوقود الغازي الخامل، مثل الزينون، والتي يسهل التعامل معها في الاختبارات الأرضية وتسبب أضرارًا أقل محتملة للمركبة الفضائية.[10] تم استخدام الزينون في المركبة الفضائية التجريبية ديب سبيس 1 التي تم إطلاقها في عام 1998.[94][95] ومع ذلك، فقد تم بناء محركات الدفع الكهربائية ذات الانبعاث الميداني والتي تعمل على تسريع أيونات المعادن السائلة مثل السيزيوم.[48]
تستخدم نترات السيزيوم كعامل مؤكسد وملون للألعاب النارية لحرق السيليكون في توهجات الأشعة تحت الحمراء، [96] مثل توهج LUU-19، [97] لأنه يصدر الكثير من ضوءه في طيف الأشعة تحت الحمراء القريبة. [98] ربما تم استخدام مركبات السيزيوم كمضافات وقود لتقليل توقيع الرادار لأعمدة العادم في طائرة استطلاع لوكهيد A-12 CIA. [99] تمت إضافة السيزيوم والروبيديوم كربونات إلى الزجاج لأنها تقلل من التوصيل الكهربائي وتحسن استقرار ومتانة الألياف البصرية وأجهزة الرؤية الليلية. يتم استخدام فلوريد السيزيوم أو فلوريد الألومنيوم السيزيوم في التدفقات المصاغة لنحاس سبائك الألومنيوم التي تحتوي على المغنيسيوم.[10]
تم بحث أنظمة توليد الطاقة المغنطيسية الديناميكية (MHD)، لكنها فشلت في الحصول على قبول واسع النطاق.[100] يعتبر معدن السيزيوم أيضًا بمثابة سائل عامل في مولدات الكهرباء التوربينية ذات دورة رانكين ذات درجة الحرارة العالية. [101]
تم تقييم أملاح السيزيوم على أنها كواشف مضادة للصدمة بعد تناول أدوية الزرنيخ. لكن بسبب تأثيرها على إيقاعات القلب، تقل احتمالية استخدامها مقارنة بأملاح البوتاسيوم أو الروبيديوم. كما تم استخدامها لعلاج الصرع.[10]
يمكن تبريد السيزيوم 133 بالليزر واستخدامه لاستكشاف المشكلات الأساسية والتكنولوجية في فيزياء الكم. يحتوي على طيف رنين فشباخ مناسب بشكل خاص لتمكين دراسات الذرات شديدة البرودة التي تتطلب تفاعلات قابلة للضبط.[102]
مخاطر الصحة والسلامة
| سيزيوم | |
|---|---|
| المخاطر | |
| رمز الخطر وفق GHS |   |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | <abbr class="abbr" title="Error in hazard statements">HH260, <abbr class="abbr" title="Error in hazard statements">HH314 |
| بيانات وقائية وفق GHS | <abbr class="abbr" title="Error in hazard statements">PP223, <abbr class="abbr" title="Error in hazard statements">PP231 + P232, <abbr class="abbr" title="Error in hazard statements">PP280, <abbr class="abbr" title="Error in hazard statements">PP305 + P351 + P338, <abbr class="abbr" title="Error in hazard statements">PP370 + P378, <abbr class="abbr" title="Error in hazard statements">PP422 |
| NFPA 704 |
4
3
3
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
تعتبر مركبات السيزيوم غير المشعة سامة بدرجة معتدلة، ولا يمثل السيزيوم غير المشع خطرًا بيئيًا كبيرًا. نظرًا لأن العمليات الكيميائية الحيوية يمكن أن تخلط وتستبدل السيزيوم بالبوتاسيوم، فإن زيادة السيزيوم يمكن أن تؤدي إلى نقص بوتاسيوم الدم، وعدم انتظام ضربات القلب، والسكتة القلبية الحادة، ولكن هذه الكميات لن تصادف عادةً في المصادر الطبيعية.[103][104]
متوسط الجرعة المميتة (LD 50 ) لكلوريد السيزيوم في الفئران هو 2.3 غرام لكل كيلوغرام، وهو ما يمكن مقارنته بقيم LD 50 لكلوريد البوتاسيوم وكلوريد الصوديوم.[105] الاستخدام الرئيسي للسيزيوم غير المشع هو فورمات السيزيوم في سوائل حفر البترول لأنه أقل سمية بكثير من البدائل، على الرغم من أنه أكثر تكلفة.[48]
معدن السيزيوم هو أحد العناصر الأكثر تفاعلاً وهو شديد الانفجار في وجود الماء. يتم تسخين غاز الهيدروجين الناتج عن التفاعل بواسطة الطاقة الحرارية المنبعثة في نفس الوقت، مما يتسبب في الاشتعال والانفجار العنيف. يمكن أن يحدث هذا مع معادن قلوية أخرى، لكن السيزيوم قوي جدًا لدرجة أن هذا التفاعل المتفجر يمكن أن يحدث حتى عن طريق الماء البارد.[10]
إنه شديد الاشتعال : درجة حرارة الاشتعال الذاتي للسيزيوم هي −116 °م (−177 °ف)، وهي تشتعل بشكل متفجر في الهواء لتكوين هيدروكسيد السيزيوم وأكاسيد مختلفة. هيدروكسيد السيزيوم قاعدة قوية جدًا، وسوف يتسبب في تآكل الزجاج بسرعة.[16]
النظائر 134 و137 موجودة في المحيط الحيوي بكميات صغيرة من الأنشطة البشرية، تختلف حسب الموقع. لا يتراكم المشع في الجسم بسهولة مثل نواتج الانشطار الأخرى (مثل اليود المشع وراديوالسترونتيوم). حوالي 10٪ من المشع الممتص يغسل خارج الجسم بسرعة نسبيًا في العرق والبول. أما النسبة المتبقية البالغة 90٪ فلديها نصف عمر بيولوجي يتراوح بين 50 و150 يومًا.[106] الراديوكيزيوم يتبع البوتاسيوم ويميل إلى التراكم في أنسجة النبات، بما في ذلك الفواكه والخضروات.[107][108][109] تتنوع النباتات على نطاق واسع في امتصاص السيزيوم، وفي بعض الأحيان تظهر مقاومة كبيرة له. كما تم توثيقه جيدا أن الفطر من الغابات الملوثة تتراكم المشع (السيزيوم 137) في الفطرية مثل ثمرة البوغية.[110] كان تراكم السيزيوم 137 في البحيرات مصدر قلق كبير بعد كارثة تشيرنوبيل.[111][112] أظهرت التجارب مع الكلاب أن جرعة واحدة مقدارها 3.8 مليون قرش (140 MBq، 4.1 ميكروغرام من السيزيوم 137) لكل كيلوغرام مميت في غضون ثلاثة أسابيع ؛ [113] الكميات الصغيرة قد تسبب العقم والسرطان.[114] حذرت الوكالة الدولية للطاقة الذرية ومصادر أخرى من أن المواد المشعة مثل السيزيوم 137 يمكن استخدامها في أجهزة التشتت الإشعاعي أو «القنابل القذرة».[115]
انظر أيضًا
- حادثة غويانيا الإشعاعية، حادث تلوث إشعاعي كبير في عام 1987 يشمل السيزيوم 137.
- حادثة أكرونس، حادث تلوث السيزيوم 137 في عام 1998.
ملحوظات
- Bunsen quotes Aulus Gellius Noctes Atticae II, 26 by Nigidius Figulus: Nostris autem veteribus caesia dicts est quae Graecis, ut Nigidus ait, de colore coeli quasi coelia.
المراجع
- "Magnetic susceptibility of the elements and inorganic compounds"، Handbook of Chemistry and Physics (PDF) (ط. 81st)، CRC press، اطلع عليه بتاريخ 26 سبتمبر 2010.
- "IUPAC Periodic Table of Elements"، International Union of Pure and Applied Chemistry، مؤرشف من الأصل في 5 ديسمبر 2021.
- قالب:RedBook2005.
- Coghill, Anne M.؛ Garson, Lorrin R., المحررون (2006)، The ACS Style Guide: Effective Communication of Scientific Information (ط. 3rd)، Washington, D.C.: American Chemical Society، ص. 127، ISBN 978-0-8412-3999-9، مؤرشف من الأصل في 27 يوليو 2020.
- Coplen؛ Peiser (1998)، "History of the recommended atomic-weight values from 1882 to 1997: a comparison of differences from current values to the estimated uncertainties of earlier values" (PDF)، Pure Appl. Chem.، 70 (1): 237–257، doi:10.1351/pac199870010237، S2CID 96729044، مؤرشف من الأصل (PDF) في 21 أكتوبر 2021.
- OED entry for "caesium". Second edition, 1989; online version June 2012. Retrieved 07 September 2012. Earlier version first published in New English Dictionary, 1888. "نسخة مؤرشفة"، مؤرشف من الأصل في 4 مايو 2021، اطلع عليه بتاريخ 25 فبراير 2022.
- Caesium is the spelling recommended by the الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC).[3] The الجمعية الكيميائية الأمريكية (ACS) has used the spelling cesium since 1921,[4][5] following Webster's New International Dictionary. The element was named after the Latin word caesius, meaning "bluish grey".[6] In medieval and early modern writings caesius was spelled with the وصلات أبجدية æ as cæsius; hence, an alternative but now old-fashioned orthography is cæsium. More spelling explanation at الاختلافات الإملائية بين الإنجليزية الأمريكية والإنجليزية البريطانية.
- Along with روبيديوم 39 °م (102 °ف), فرانسيوم (estimated at 27 °م [81 °ف]), زئبق (−39 °م [−38 °ف]), and غاليوم (30 °م [86 °ف]); bromine is also liquid at room temperature (melting at −7.2 °م [19.0 °ف]), but it is a هالوجين and not a metal. Preliminary work with كوبرنيسيوم and فليروفيوم suggests that they are gaseous metals at room temperature.
- {{استشهاد ويب| مسار = http://pubs.usgs.gov/of/2004/1432/2004-1432.pdf| عنوان =}}
- Butterman, William C.؛ Brooks؛ Reese Jr. (2004)، "Mineral Commodity Profile: Cesium" (PDF)، United States Geological Survey، مؤرشف من الأصل (PDF) في 7 فبراير 2007، اطلع عليه بتاريخ 27 ديسمبر 2009.
- Heiserman, David L. (1992)، Exploring Chemical Elements and their Compounds، McGraw-Hill، ص. 201–203، ISBN 978-0-8306-3015-8، مؤرشف من الأصل في 26 يوليو 2020.
- Addison, C. C. (1984)، The Chemistry of the Liquid Alkali Metals، Wiley، ISBN 978-0-471-90508-0، مؤرشف من الأصل في 8 سبتمبر 2021، اطلع عليه بتاريخ 28 سبتمبر 2012.
- "Francium"، Periodic.lanl.gov، مؤرشف من الأصل في 6 أكتوبر 2021، اطلع عليه بتاريخ 23 فبراير 2010.
- The radioactive element فرانسيوم may also have a lower melting point, but its radioactivity prevents enough of it from being isolated for direct testing.[13] كوبرنيسيوم and فليروفيوم may also have lower melting points.
- Kaner, Richard (2003)، "C&EN: It's Elemental: The Periodic Table – Cesium"، American Chemical Society، مؤرشف من الأصل في 28 أغسطس 2021، اطلع عليه بتاريخ 25 فبراير 2010.
- "Chemical Data – Caesium – Cs"، Royal Society of Chemistry، مؤرشف من الأصل في 23 نوفمبر 2021، اطلع عليه بتاريخ 27 سبتمبر 2010.
- Lynch, Charles T. (1974)، CRC Handbook of Materials Science، CRC Press، ص. 13، ISBN 978-0-8493-2321-8، مؤرشف من الأصل في 24 ديسمبر 2021.
- Clark, Jim (2005)، "Flame Tests"، chemguide، مؤرشف من الأصل في 21 أغسطس 2021، اطلع عليه بتاريخ 29 يناير 2012.
- Taova, T. M.؛ وآخرون (22 يونيو 2003)، "Density of melts of alkali metals and their Na-K-Cs and Na-K-Rb ternary systems" (PDF)، Fifteenth symposium on thermophysical properties, Boulder, Colorado, United States، مؤرشف من الأصل (PDF) في 9 أكتوبر 2006، اطلع عليه بتاريخ 26 سبتمبر 2010.
- Deiseroth, H. J. (1997)، "Alkali metal amalgams, a group of unusual alloys"، Progress in Solid State Chemistry، 25 (1–2): 73–123، doi:10.1016/S0079-6786(97)81004-7.
- Addison, C. C. (1984)، The chemistry of the liquid alkali metals، Wiley، ص. 7، ISBN 9780471905080.
- Gray, Theodore (2012) The Elements, Black Dog & Leventhal Publishers, p. 131, (ردمك 1-57912-895-5).
- Dye, J. L. (1979)، "Compounds of Alkali Metal Anions"، Angewandte Chemie International Edition، 18 (8): 587–598، doi:10.1002/anie.197905871.
- Hogan, C. M. (2011)."Phosphate"، مؤرشف من الأصل في 25 أكتوبر 2012، اطلع عليه بتاريخ 17 يونيو 2012.
- Greenwood, N. N.؛ Earnshaw (1984)، Chemistry of the Elements، Oxford, UK: Pergamon Press، ISBN 978-0-08-022057-4، مؤرشف من الأصل في 16 مارس 2022.
- Köhler, Michael J. (1999)، Etching in microsystem technology، Wiley-VCH، ص. 90، ISBN 978-3-527-29561-6، مؤرشف من الأصل في 23 ديسمبر 2021.
- Jansen, Martin (30 نوفمبر 2005)، "Effects of relativistic motion of electrons on the chemistry of gold and platinum"، Solid State Sciences، 7 (12): 1464–1474، Bibcode:2005SSSci...7.1464J، doi:10.1016/j.solidstatesciences.2005.06.015.
- Moyer, Bruce A.؛ Birdwell؛ Bonnesen؛ Delmau (2005)، Use of Macrocycles in Nuclear-Waste Cleanup: A Realworld Application of a Calixcrown in Cesium Separation Technology، Macrocyclic Chemistry، ص. 383–405، doi:10.1007/1-4020-3687-6_24، ISBN 978-1-4020-3364-3.
- Senga, Ryosuke؛ Suenaga (2015)، "Single-atom electron energy loss spectroscopy of light elements"، Nature Communications، 6: 7943، Bibcode:2015NatCo...6.7943S، doi:10.1038/ncomms8943، PMID 26228378.
- Evans, F. W.؛ Litt, M. H.؛ Weidler-Kubanek, A. M.؛ Avonda, F. P. (1968)، "Reactions Catalyzed by Potassium Fluoride. 111. The Knoevenagel Reaction"، Journal of Organic Chemistry، 33 (5): 1837–1839، doi:10.1021/jo01269a028.
- Holleman, Arnold F.؛ Wiberg؛ Wiberg (1985)، "Vergleichende Übersicht über die Gruppe der Alkalimetalle"، Lehrbuch der Anorganischen Chemie (باللغة الألمانية) (ط. 91–100)، Walter de Gruyter، ص. 953–955، ISBN 978-3-11-007511-3.
- Wells, A. F. (1984)، Structural Inorganic Chemistry (ط. 5th)، Oxford Science Publications، ISBN 978-0-19-855370-0.
- Cotton, F. Albert؛ Wilkinson, G. (1962)، Advanced Inorganic Chemistry، John Wiley & Sons, Inc.، ص. 318، ISBN 978-0-471-84997-1.
- قالب:RubberBible87th
- Tsai, Khi-Ruey؛ Harris؛ Lassettre (1956)، "The Crystal Structure of Cesium Monoxide"، Journal of Physical Chemistry، 60 (3): 338–344، doi:10.1021/j150537a022، مؤرشف من الأصل في 24 سبتمبر 2017.
- Vol'nov, I. I.؛ Matveev (1963)، "Synthesis of cesium ozonide through cesium superoxide"، Bulletin of the Academy of Sciences, USSR Division of Chemical Science، 12 (6): 1040–1043، doi:10.1007/BF00845494.
- Tokareva, S. A. (1971)، "Alkali and Alkaline Earth Metal Ozonides"، Russian Chemical Reviews، 40 (2): 165–174، Bibcode:1971RuCRv..40..165T، doi:10.1070/RC1971v040n02ABEH001903.
- Simon, A. (1997)، "Group 1 and 2 Suboxides and Subnitrides — Metals with Atomic Size Holes and Tunnels"، Coordination Chemistry Reviews، 163: 253–270، doi:10.1016/S0010-8545(97)00013-1.
- Tsai, Khi-Ruey؛ Harris؛ Lassettre (1956)، "The Crystal Structure of Tricesium Monoxide"، Journal of Physical Chemistry، 60 (3): 345–347، doi:10.1021/j150537a023.
- Okamoto, H. (2009)، "Cs-O (Cesium-Oxygen)"، Journal of Phase Equilibria and Diffusion، 31: 86–87، doi:10.1007/s11669-009-9636-5.
- Band, A.؛ Albu-Yaron؛ Livneh؛ Cohen؛ Feldman؛ Shimon؛ Popovitz-Biro؛ Lyahovitskaya؛ Tenne (2004)، "Characterization of Oxides of Cesium"، The Journal of Physical Chemistry B، 108 (33): 12360–12367، doi:10.1021/jp036432o.
- Brauer, G. (1947)، "Untersuchungen ber das System Csium-Sauerstoff"، Zeitschrift für Anorganische Chemie، 255 (1–3): 101–124، doi:10.1002/zaac.19472550110.
- Busso, M.؛ Gallino, R.؛ Wasserburg, G. J. (1999)، "Nucleosynthesis in Asymptotic Giant Branch Stars: Relevance for Galactic Enrichment and Solar System Formation" (PDF)، Annual Review of Astronomy and Astrophysics، 37: 239–309، Bibcode:1999ARA&A..37..239B، doi:10.1146/annurev.astro.37.1.239، مؤرشف من الأصل (PDF) في 18 ديسمبر 2021، اطلع عليه بتاريخ 20 فبراير 2010.
- Arnett, David (1996)، Supernovae and Nucleosynthesis: An Investigation of the History of Matter, from the Big Bang to the Present، Princeton University Press، ص. 527، ISBN 978-0-691-01147-9.
- Goff, C.؛ Matchette؛ Shabestary؛ Khazaeli (1996)، "Complexation of caesium and rubidium cations with crown ethers in N,N-dimethylformamide"، Polyhedron، 15 (21): 3897–3903، doi:10.1016/0277-5387(96)00018-6.
- Brown, F.؛ Hall؛ Walter (1955)، "The half-life of Cs137"، Journal of Inorganic and Nuclear Chemistry، 1 (4–5): 241–247، Bibcode:1955PhRv...99..188W، doi:10.1016/0022-1902(55)80027-9.
- Sonzogni, Alejandro، "Interactive Chart of Nuclides"، Brookhaven National Laboratory، مؤرشف من الأصل في 18 نوفمبر 2021، اطلع عليه بتاريخ 06 يونيو 2008.
-
{{استشهاد بمنشورات مؤتمر}}: استشهاد فارغ! (مساعدة) - (Report).
{{استشهاد بتقرير}}: الوسيط|title=غير موجود أو فارغ (مساعدة) - Taylor, V. F.؛ Evans؛ Cornett (2008)، "Preliminary evaluation of 135Cs/137Cs as a forensic tool for identifying source of radioactive contamination"، Journal of Environmental Radioactivity، 99 (1): 109–118، doi:10.1016/j.jenvrad.2007.07.006، PMID 17869392.
- "Cesium | Radiation Protection"، U.S. Environmental Protection Agency، 28 يونيو 2006، مؤرشف من الأصل في 15 مارس 2011، اطلع عليه بتاريخ 15 فبراير 2010.
- Kase, Takeshi؛ Konashi؛ Takahashi؛ Hirao (1993)، "Transmutation of Cesium-137 Using Proton Accelerator"، Journal of Nuclear Science and Technology، 30 (9): 911–918، doi:10.3327/jnst.30.911.
- Knief, Ronald Allen (1992)، "Fission Fragments"، Nuclear engineering: theory and technology of commercial nuclear power، Taylor & Francis، ص. 42، ISBN 978-1-56032-088-3.
- Ishiwatari, N.؛ Nagai، "Release of xenon-137 and iodine-137 from UO2 pellet by pulse neutron irradiation at NSRR"، Nippon Genshiryoku Gakkaishi، 23 (11): 843–850، OSTI 5714707.
- Turekian, K. K.؛ Wedepohl (1961)، "Distribution of the elements in some major units of the Earth's crust"، Geological Society of America Bulletin، 72 (2): 175–192، Bibcode:1961GSAB...72..175T، doi:10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2، ISSN 0016-7606، مؤرشف من الأصل في 11 يونيو 2022.
- Rowland, Simon (04 يوليو 1998)، "Cesium as a Raw Material: Occurrence and Uses"، Artemis Society International، مؤرشف من الأصل في 8 يوليو 2021، اطلع عليه بتاريخ 15 فبراير 2010.
- Černý, Petr؛ Simpson (1978)، "The Tanco Pegmatite at Bernic Lake, Manitoba: X. Pollucite" (PDF)، Canadian Mineralogist، 16: 325–333، مؤرشف من الأصل (PDF) في 18 ديسمبر 2021، اطلع عليه بتاريخ 26 سبتمبر 2010.
- Polyak, Désirée E.، "Cesium"، U.S. Geological Survey، مؤرشف من الأصل (PDF) في 1 نوفمبر 2021، اطلع عليه بتاريخ 17 أكتوبر 2009.
- Norton, J. J. (1973)، "Lithium, cesium, and rubidium—The rare alkali metals"، في Brobst, D. A.؛ Pratt, W. P. (المحررون)، United States mineral resources، U.S. Geological Survey Professional، ج. Paper 820، ص. 365–378، مؤرشف من الأصل في 21 يوليو 2010، اطلع عليه بتاريخ 26 سبتمبر 2010.
- Burt, R. O. (1993)، "Caesium and cesium compounds"، Kirk-Othmer encyclopedia of chemical technology (ط. 4th)، New York: John Wiley & Sons, Inc.، ج. 5، ص. 749–764، ISBN 978-0-471-48494-3.
- Benton, William؛ Turner (2000)، "Cesium formate fluid succeeds in North Sea HPHT field trials" (PDF)، Drilling Contractor (May/June): 38–41، مؤرشف من الأصل (PDF) في 18 ديسمبر 2021، اطلع عليه بتاريخ 26 سبتمبر 2010.
- Eagleson, Mary, المحرر (1994)، Concise encyclopedia chemistry، Eagleson, Mary، Berlin: de Gruyter، ص. 198، ISBN 978-3-11-011451-5، مؤرشف من الأصل في 22 ديسمبر 2021.
- قاموس أكسفورد الإنجليزي, 2nd Edition
- Kirchhoff, G.؛ Bunsen (1861)، "Chemische Analyse durch Spectralbeobachtungen" (PDF)، Annalen der Physik und Chemie، 189 (7): 337–381، Bibcode:1861AnP...189..337K، doi:10.1002/andp.18611890702، مؤرشف من الأصل (PDF) في 20 ديسمبر 2021.
- Weeks, Mary Elvira (1932)، "The discovery of the elements. XIII. Some spectroscopic discoveries"، Journal of Chemical Education، 9 (8): 1413–1434، Bibcode:1932JChEd...9.1413W، doi:10.1021/ed009p1413.
- Kaner, Richard (2003)، "C&EN: It's Elemental: The Periodic Table – Cesium"، American Chemical Society، مؤرشف من الأصل في 22 نوفمبر 2020، اطلع عليه بتاريخ 25 فبراير 2010.
- Zsigmondy, Richard (2007)، Colloids and the Ultra Microscope، Read books، ص. 69، ISBN 978-1-4067-5938-9، مؤرشف من الأصل في 11 ديسمبر 2021.
- Setterberg, Carl (1882)، "Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst"، Justus Liebig's Annalen der Chemie، 211: 100–116، doi:10.1002/jlac.18822110105، مؤرشف من الأصل في 27 أبريل 2021.
- Strod, A. J. (1957)، "Cesium—A new industrial metal"، American Ceramic Bulletin، 36 (6): 212–213.
- "Cesium Atoms at Work"، Time Service Department—U.S. Naval Observatory—Department of the Navy، مؤرشف من الأصل في 23 فبراير 2015، اطلع عليه بتاريخ 20 ديسمبر 2009.
- Flatern, Rick (2001)، "Keeping cool in the HPHT environment"، Offshore Engineer (February): 33–37.
- Essen, L.؛ Parry (1955)، "An Atomic Standard of Frequency and Time Interval: A Caesium Resonator"، نيتشر، 176 (4476): 280–282، Bibcode:1955Natur.176..280E، doi:10.1038/176280a0.
- Markowitz, W.؛ Hall؛ Essen؛ Parry (1958)، "Frequency of Cesium in Terms of Ephemeris Time"، Physical Review Letters، 1 (3): 105–107، Bibcode:1958PhRvL...1..105M، doi:10.1103/PhysRevLett.1.105.
- Reel, Monte (22 يوليو 2003)، "Where timing truly is everything"، The Washington Post، ص. B1، مؤرشف من الأصل في 29 أبريل 2013، اطلع عليه بتاريخ 26 يناير 2010.
- Rasor, Ned S.؛ Warner (سبتمبر 1964)، "Correlation of Emission Processes for Adsorbed Alkali Films on Metal Surfaces"، Journal of Applied Physics، 35 (9): 2589–2600، Bibcode:1964JAP....35.2589R، doi:10.1063/1.1713806.
- "Cesium Supplier & Technical Information"، American Elements، مؤرشف من الأصل في 16 ديسمبر 2021، اطلع عليه بتاريخ 25 يناير 2010.
- Smedley, John؛ Rao؛ Wang (2009)، "K2CsSb Cathode Development"، AIP Conference Proceedings، 1149 (1): 1062–1066، Bibcode:2009AIPC.1149.1062S، doi:10.1063/1.3215593.
- Görlich, P. (1936)، "Über zusammengesetzte, durchsichtige Photokathoden"، Zeitschrift für Physik، 101 (5–6): 335–342، Bibcode:1936ZPhy..101..335G، doi:10.1007/BF01342330.
- Groeger, S.؛ Pazgalev؛ Weis (2005)، "Comparison of discharge lamp and laser pumped cesium magnetometers"، Applied Physics B، 80 (6): 645–654، arXiv:physics/0412011، Bibcode:2005ApPhB..80..645G، doi:10.1007/s00340-005-1773-x.
- Haven, Mary C.؛ Tetrault؛ Schenken (1994)، "Internal Standards"، Laboratory instrumentation، New York: John Wiley and Sons، ص. 108، ISBN 978-0-471-28572-4.
- McGee, James D. (1969)، Photo-electronic image devices: proceedings of the fourth symposium held at Imperial College, London, September 16–20, 1968، Academic Press، ج. 1، ص. 391، ISBN 978-0-12-014528-7، مؤرشف من الأصل في 24 ديسمبر 2021.
- Manfred Bick, Horst Prinz, "Cesium and Cesium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a06_153.
- Desai, Mohamed A., المحرر (2000)، "Gradient Materials"، Downstream processing methods، Totowa, N.J.: Humana Press، ص. 61–62، ISBN 978-0-89603-564-5.
- Burt, R. O. (1993)، "Cesium and cesium compounds"، Kirk-Othmer encyclopedia of chemical technology (ط. 4th)، New York: John Wiley & Sons، ج. 5، ص. 759، ISBN 978-0-471-15158-6.
- Friestad, Gregory K.; Branchaud, Bruce P.; Navarrini, Walter and Sansotera, Maurizio (2007) "Cesium Fluoride" in Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons. دُوِي:10.1002/047084289X.rc050.pub2
- Okumura, Takeshi (21 أكتوبر 2003)، "The material flow of radioactive cesium-137 in the U.S. 2000" (PDF)، United States Environmental Protection Agency، مؤرشف من الأصل (PDF) في 20 يوليو 2011، اطلع عليه بتاريخ 20 ديسمبر 2009.
- Jensen, N. L. (1985)، "Cesium"، Mineral facts and problems، U.S. Bureau of Mines، ج. Bulletin 675، ص. 133–138.
- "IsoRay's Cesium-131 Medical Isotope Used In Milestone Procedure Treating Eye Cancers At Tufts-New England Medical Center"، Medical News Today، 17 ديسمبر 2007، مؤرشف من الأصل في 29 أبريل 2021، اطلع عليه بتاريخ 15 فبراير 2010.
- Bentel, Gunilla Carleson (1996)، "Caesium-137 Machines"، Radiation therapy planning، McGraw-Hill Professional، ص. 22–23، ISBN 978-0-07-005115-7، اطلع عليه بتاريخ 26 سبتمبر 2010.
- National Research Council (U.S.). Committee on Radiation Source Use and Replacement (2008)، Radiation source use and replacement: abbreviated version، National Academies Press، ISBN 978-0-309-11014-3، مؤرشف من الأصل في 22 ديسمبر 2021.
- Loxton, R.؛ Pope, P., المحررون (1995)، "Level and density measurement using non-contact nuclear gauges"، Instrumentation : A Reader، London: Chapman & Hall، ص. 82–85، ISBN 978-0-412-53400-3.
- Timur, A.؛ Toksoz (1985)، "Downhole Geophysical Logging"، Annual Review of Earth and Planetary Sciences، 13: 315–344، Bibcode:1985AREPS..13..315T، doi:10.1146/annurev.ea.13.050185.001531.
- Kendall, Carol، "Isotope Tracers Project – Resources on Isotopes – Cesium"، National Research Program – U.S. Geological Survey، مؤرشف من الأصل في 8 يوليو 2021، اطلع عليه بتاريخ 25 يناير 2010.
- Marcucci, M. G.؛ Polk (2000)، "NSTAR Xenon Ion Thruster on Deep Space 1: Ground and flight tests (invited)"، Review of Scientific Instruments، 71 (3): 1389–1400، Bibcode:2000RScI...71.1389M، doi:10.1063/1.1150468.
- Sovey, James S.؛ Rawlin؛ Patterson، "A Synopsis of Ion Propulsion Development Projects in the United States: SERT I to Deep Space I" (PDF)، NASA، مؤرشف من الأصل (PDF) في 29 يونيو 2009، اطلع عليه بتاريخ 12 ديسمبر 2009.
- "Infrared illumination compositions and articles containing the same"، United States Patent 6230628، Freepatentsonline.com، مؤرشف من الأصل في 8 يوليو 2021، اطلع عليه بتاريخ 25 يناير 2010.
- "LUU-19 Flare"، Federation of American Scientists، 23 أبريل 2000، مؤرشف من الأصل في 06 أغسطس 2010، اطلع عليه بتاريخ 12 ديسمبر 2009.
- Charrier, E.؛ Charsley؛ Laye؛ Markham؛ Berger؛ Griffiths (2006)، "Determination of the temperature and enthalpy of the solid–solid phase transition of caesium nitrate by differential scanning calorimetry"، Thermochimica Acta، 445: 36–39، doi:10.1016/j.tca.2006.04.002.
- Crickmore, Paul F. (2000)، Lockheed SR-71: the secret missions exposed، Osprey، ص. 47، ISBN 978-1-84176-098-8.
- National Research Council (U.S.) (2001)، Energy research at DOE—Was it worth it?، National Academy Press، ص. 190–194، doi:10.17226/10165، ISBN 978-0-309-07448-3، مؤرشف من الأصل في 23 مارس 2016، اطلع عليه بتاريخ 26 سبتمبر 2010.
- Roskill Information Services (1984)، Economics of Caesium and Rubidium (Reports on Metals & Minerals)، London, United Kingdom: Roskill Information Services، ص. 51، ISBN 978-0-86214-250-6.
- Chin, Cheng؛ Grimm؛ Julienne؛ Tiesinga (29 أبريل 2010)، "Feshbach resonances in ultracold gases"، Reviews of Modern Physics، 82 (2): 1225–1286، arXiv:0812.1496، Bibcode:2010RvMP...82.1225C، doi:10.1103/RevModPhys.82.1225.
- Melnikov, P.؛ Zanoni (يونيو 2010)، "Clinical effects of cesium intake."، Biological Trace Element Research، 135 (1–3): 1–9، doi:10.1007/s12011-009-8486-7، PMID 19655100.
- Pinsky, Carl؛ Bose؛ Taylor؛ McKee؛ Lapointe؛ Birchall (1981)، "Cesium in mammals: Acute toxicity, organ changes and tissue accumulation"، Journal of Environmental Science and Health, Part A، 16 (5): 549–567، doi:10.1080/10934528109375003.
- Johnson, Garland T.؛ Lewis؛ Wagner (1975)، "Acute toxicity of cesium and rubidium compounds"، Toxicology and Applied Pharmacology، 32 (2): 239–245، doi:10.1016/0041-008X(75)90216-1، PMID 1154391.
- Rundo, J. (1964)، "A Survey of the Metabolism of Caesium in Man"، British Journal of Radiology، 37 (434): 108–114، doi:10.1259/0007-1285-37-434-108، PMID 14120787.
- Nishita, H.؛ Dixon؛ Larson (1962)، "Accumulation of Cs and K and growth of bean plants in nutrient solution and soils"، Plant and Soil، 17 (2): 221–242، doi:10.1007/BF01376226.
- Avery, S. (1996)، "Fate of caesium in the environment: Distribution between the abiotic and biotic components of aquatic and terrestrial ecosystems"، Journal of Environmental Radioactivity، 30 (2): 139–171، doi:10.1016/0265-931X(96)89276-9.
- Salbu, Brit؛ Østby؛ Garmo؛ Hove (1992)، "Availability of caesium isotopes in vegetation estimated from incubation and extraction experiments"، Analyst، 117 (3): 487–491، Bibcode:1992Ana...117..487S، doi:10.1039/AN9921700487، PMID 1580386.
- Vinichuk, M. (2010)، "Accumulation of potassium, rubidium and caesium (133Cs and 137Cs) in various fractions of soil and fungi in a Swedish forest"، Science of the Total Environment، 408 (12): 2543–2548، Bibcode:2010ScTEn.408.2543V، doi:10.1016/j.scitotenv.2010.02.024، PMID 20334900.
- Smith, Jim T.؛ Beresford (2005)، Chernobyl: Catastrophe and Consequences، Berlin: Springer، ISBN 978-3-540-23866-9.
- Eremeev, V. N.؛ Chudinovskikh؛ Batrakov؛ Ivanova (1991)، "Radioactive isotopes of caesium in the waters and near-water atmospheric layer of the Black Sea"، Physical Oceanography، 2 (1): 57–64، doi:10.1007/BF02197418.
- Redman, H. C.؛ McClellan؛ Jones؛ Boecker؛ Chiffelle؛ Pickrell؛ Rypka (1972)، "Toxicity of 137-CsCl in the Beagle. Early Biological Effects"، Radiation Research، 50 (3): 629–648، Bibcode:1972RadR...50..629R، doi:10.2307/3573559، JSTOR 3573559، PMID 5030090.
- "Chinese 'find' radioactive ball"، BBC News، 27 مارس 2009، مؤرشف من الأصل في 10 أكتوبر 2021، اطلع عليه بتاريخ 25 يناير 2010.
- Charbonneau, Louis (12 مارس 2003)، "IAEA director warns of 'dirty bomb' risk"، The Washington Post، Reuters، ص. A15، مؤرشف من الأصل في 05 ديسمبر 2008، اطلع عليه بتاريخ 28 أبريل 2010.
- Data from The Radiochemical Manual and Wilson, B. J. (1966) The Radiochemical Manual (2nd ed.
روابط خارجية
- السيزيوم أو السيزيوم في الجدول الدوري لمقاطع الفيديو (جامعة نوتنجهام).
- شاهد تفاعل السيزيوم (المعدن الأكثر تفاعلًا في الجدول الدوري) مع الفلور (غير المعدني الأكثر تفاعلًا) بإذن من المعهد الملكي.
- Rogachev, Andrey Yu.؛ Miao؛ Merino؛ Hoffmann (2015)، "Molecular CsF5and CsF2+"، Angewandte Chemie، 127 (28): 8393–8396، Bibcode:2015AngCh.127.8393R، doi:10.1002/ange.201500402.
- بوابة الكيمياء
- بوابة العناصر الكيميائية
