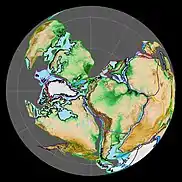
Historia de la Tierra
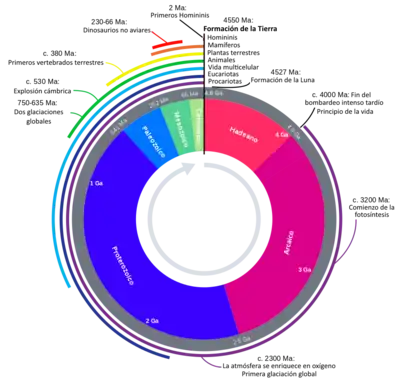
La historia de la Tierra se refiere al desarrollo del planeta Tierra y cubre alrededor de 4500 millones de años (4 567 000 000 años) —aproximadamente un tercio de la edad del universo, de los 13 700 Ma estimados desde el Big Bang[1]—, desde su formación hasta la época actual.[2] Está dividida en cuatro eones —la mayor división cronológica—, siendo los tres primeros los que definen el Precámbrico:
- el Hadeano, que duró casi 500 Ma y que no dejó casi ninguna roca en su lugar, excepto fragmentos en rocas eruptivas posteriores, y es sobre todo conocido a través de la modelización del sistema solar y el análisis comparativo de las composiciones isotópicas de los diferentes cuerpos celestes;
- el Arcaico, que duró 1500 Ma, marcado a la vez por la aparición de las primeras cortezas continentales y por el origen de la vida que creó la biosfera y conocido por el análisis de las rocas que ha dejado, de su edad y de las condiciones de su formación;
- el Proterozoico, que duró 2000 Ma, marcado por la aparición masiva del oxígeno en la atmósfera, que reemplazó a la atmósfera primitiva de dióxido de carbono, y conocido también a través de las rocas entonces formadas, en un ambiente hasta el presente generalmente oxidante;
- el Fanerozoico, literalmente el de los «animales visibles», de los organismos multicelulares: además de los análisis de rocas, se conoce por los fósiles que han dejado esos organismos animales y vegetales en sus diferentes estratos geológicos. Es la edad de la vida tal como se conoce hoy y se divide en tres eras: el Paleozoico, que no comenzó hasta hace 540 Ma, una era de artrópodos, peces y la primera vida en la tierra; el Mesozoico, que abarcó el ascenso, el reinado y la extinción climática de los dinosaurios no aviares; y el Cenozoico, que vio el surgimiento de los mamíferos. Los seres humanos reconocibles surgieron hace como mucho 2 Ma, un período extremadamente pequeño en la escala geológica.

La Tierra se formó por acreción de la nebulosa solar.[3][4][5] La desgasificación volcánica probablemente creó la atmósfera primordial y luego el océano, pero la atmósfera primitiva casi no contenía oxígeno. Gran parte de la Tierra se fundió debido a las frecuentes colisiones con otros cuerpos que llevaron a un vulcanismo extremo. Mientras la Tierra estaba en su etapa más temprana (Tierra primordial), se cree que una colisión de impacto gigante con un cuerpo del tamaño de un planeta llamado Tea habría formado la Luna. Con el tiempo, la Tierra se enfrió, entrañando la formación de una corteza sólida y permitiendo que existiera el agua líquida en la superficie.
La evidencia indiscutible más antigua de vida en la Tierra data de hace al menos 3500 Ma,[6][7][8] durante la Era Eoarcaica, después de que la corteza geológica comenzara a solidificarse a partir del material fundido anterior del eón Hadeano. Hay fósiles de esteras microbianas como los estromatolitos que se encuentran en areniscas de 3480 Ma descubiertos en Australia Occidental.[9][10][11] Otra evidencia física temprana de una sustancia biogénica es el grafito en rocas metasedimentarias de 3700 Ma descubiertas en el suroeste de Groenlandia,[12] así como los «restos de vida biótica» encontrados en rocas de 4100 Ma en Australia Occidental.[13][14] Según S. Blair Hedges, de la Universidad del Temple, «si la vida surgiese relativamente rápido en la Tierra, entonces podría ser común en el universo».[13]
Los organismos fotosintéticos aparecieron hace entre 3200 y 2400 Ma y comenzaron a enriquecer la atmósfera con oxígeno. La vida permaneció mayormente pequeña y microscópica hasta hace unos 580 Ma, cuando surgió la vida multicelular compleja, se desarrolló con el tiempo y culminó en la explosión cámbrica hace unos 541 Ma. Esta repentina diversificación de formas de vida produjo la mayor parte de los principales filos conocidos hoy en día, y dividió el eón Proterozoico del período Cámbrico, ya en la era Paleozoica. Se estima que el 99% de todas las especies que alguna vez vivieron en la Tierra, más de cinco mil millones,[15] se han extinguido.[16][17] Las estimaciones sobre el número de especies actuales de la Tierra varían entre 10 millones y 14 millones,[18] de las cuales están documentadas alrededor de 1,5 millones.[19] Algunos estudios establecen que aún permanecen sin descripción alrededor del 86% de las especies terrestres y el 91% de las especies marinas.[20] Sin embargo, recientemente se ha afirmado que 1 billón de especies viven actualmente en la Tierra, y de ellas solo una milésima parte del 1% están descriptas.[21]
La corteza terrestre ha cambiado constantemente desde su formación, al igual que la vida desde su primera aparición. Las especies continúan evolucionando, adoptando nuevas formas, dividiéndose en especies hijas o extinguiéndose frente a entornos físicos en constante cambio. El proceso de la tectónica de placas continúa dando forma a los continentes y océanos de la Tierra y la vida que albergan. La actividad humana es ahora una fuerza dominante que afecta al cambio global, alterando la biosfera, la superficie de la Tierra, la hidrosfera y la atmósfera con la pérdida de tierras silvestres, la sobreexplotación de los océanos, la producción de gases de efecto invernadero, la degradación de la capa de ozono y una degradación general de la calidad del suelo, el aire y el agua.[22]
Casi todas las ramas de las ciencias naturales han contribuido a la comprensión de los principales eventos del pasado de la Tierra, grandes cambios geológicos —diferenciación en capas, creación de corteza continental, movilización de la litosfera por la tectónica de placas—, reconfiguración de equilibrios químicos, como la Gran Oxidación, intensos cambios climáticos y episodios catastróficos; separados por largos períodos de estabilidad, durante los cuales las retroalimentaciones, entre la biosfera, la atmósfera, la hidrosfera y la litosfera estabilizaron las condiciones dando lugar a la aparición de la vida y a su evolución y diversificación, con varios episodios de extinción masiva, como las que se produjeron durante el (Devónico o el Pérmico-Triásico, entre otras.[23]
Cronología
El tiempo geológico está dividido en diez eras geológicas, agrupadas en tres eones y divididas en veintidós periodos (el eón Hádico no está dividido en eras y las eras del eón Arcaico no están divididas en periodos). Los periodos, a su vez, están divididos en épocas y éstas en edades (no mostradas en la tabla):[24]
| Supereón | Eón | Era | Periodo | Inicio (en Ma) |
|---|---|---|---|---|
| Fanerozoico | Cenozoico | Cuaternario | 2,588 | |
| Neógeno | 23,03 | |||
| Paleógeno | 66,0 | |||
| Mesozoico | Cretácico | ~145,0±0,8 | ||
| Jurásico | 201,3±0,2 | |||
| Triásico | 252,2±0,5 | |||
| Paleozoico | Pérmico | 298,9±0,2 | ||
| Carbonífero | 358,9±0,4 | |||
| Devónico | 419,2±3,2 | |||
| Silúrico | 443,4±1,5 | |||
| Ordovícico | 485,4±1,9 | |||
| Cámbrico | 541,0±1,0 | |||
| Precámbrico | Proterozoico | Neoproterozoico | Ediacárico | ~635 |
| Criogénico | 850 | |||
| Tónico | 1000 | |||
| Mesoproterozoico | Esténico | 1200 | ||
| Ectásico | 1400 | |||
| Calímico | 1600 | |||
| Paleoproterozoico | Estatérico | 1800 | ||
| Orosírico | 2050 | |||
| Riácico | 2300 | |||
| Sidérico | 2500 | |||
| Arcaico | Neoarcaico | 2800 | ||
| Mesoarcaico | 3200 | |||
| Paleoarcaico | 3600 | |||
| Eoarcaico | 4000 | |||
| Hádico | ~4600 | |||
Las siguientes líneas de tiempo muestran la escala del tiempo geológico: la 1.ª muestra el tiempo completo desde la formación de la Tierra hasta el presente; la 2.ª muestra una vista ampliada del eón más reciente; la 3.ª la era más reciente; la 4.ª el período más reciente; y la 5.ª la época más reciente. Los colores son los estándares para representar las rocas según su edad de formación en los mapas geológicos internacionales.[25] 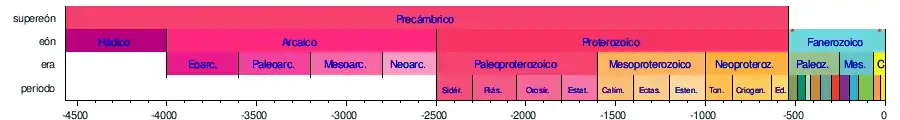     | ||||
Sistema solar

−4570 Ma: formación del Sol
La edad del Universo se estima en 13 772 ± 0,059 millones de años.[26] La principal teoría sobre la formación del Universo es el Big Bang: el Universo era un punto extremadamente pequeño de altísima densidad que abruptamente entró en expansión.[27] Al ralentizarse y enfriarse gradualmente, parte de esa energía se convirtió en materia en forma de átomos de deuterio, helio 4 y litio 7: esta fue la nucleosíntesis primordial. Las nubes de gas de dihidrógeno se concentran bajo el impulso de la gravitación, tomando la forma de galaxias y de estrellas. Cuando una esfera de gas alcanza una cierta densidad, se hace posible una reacción de fusión nuclear, fusionando cuatro átomos de hidrógeno para formar helio. Cuando la estrella envejece y aumenta la cantidad de helio producido, la fusión nuclear produce átomos más pesados: carbono, oxígeno, etc. Llegada a una cierta edad, la estrella puede colapsar sobre sí misma y luego explotar en una supernova expulsando toda la materia que había producido desde su origen.
Esa materia es el origen de la nebulosa solar, una nube de gas (o disco de acreción) a partir de la cual se formó el sistema solar. Era entonces una gran nube en rotación, constituida por polvo, roca y gas. La gravedad y la inercia la aplanaron en un disco protoplanetario orientado perpendicularmente en relación con su eje de rotación, lo que aceleró su velocidad de rotación. La mayor parte de la masa se concentró luego en el centro y comenzó a calentarse, pero pequeñas perturbaciones debidas a las colisiones y al momento cinético de otros grandes desechos crearon las condiciones para que comenzaran a formarse protoplanetas. La caída de materiales, el aumento de la velocidad de rotación y la compresión inducida por la gravedad crearon una enorme cantidad de energía cinética en el centro. La incapacidad de transferir esa energía con la suficiente rapidez al exterior provocó un aumento gradual de la temperatura en el centro del disco. Finalmente, la fusión nuclear del hidrógeno en helio comenzó de nuevo y, después de la contracción, una estrella variable de tipo T Tauri, se convirtió en nuestro joven Sol, hace 4570 millones de años.[28]
−4570 a −4540 Ma: creación de la Tierra
Durante ese tiempo, a medida que la gravedad hacía que la materia se condensase alrededor de objetos previamente perturbados, las partículas de polvo y el resto del disco protoplanetario comienzan a separarse en anillos. Los fragmentos cada vez más grandes chocan entre sí y formando objetos de mayor volumen, destinados en última instancia a convertirse en protoplanetas. Estos incluyen un grupo ubicado aproximadamente a 150 millones de kilómetros del centro: la Tierra. Así fue como el sistema solar comenzó a formarse.[29]
La similitud de composición en elementos refractarios, entre los planetas terrestres, los asteroides y el Sol mismo, se considera una fuerte evidencia de su origen común.[30] Posteriormente, la Tierra perdió gran parte del hidrógeno y del helio primitivos en el espacio, que pudieron superar la velocidad de escape debido a su agitación térmica. Sin embargo, es posible que otros elementos volátiles pudieran ser aportados por episodios posteriores de bombardeo meteórico.[30]
El Sol al principio irradiaba menos que en la actualidad. En el momento de la formación de la Tierra, solo tenía el 70% de su energía actual, y ha estado ganando un 7% por cada mil millones de años.[31][32]
En el momento de su acreción, el componente gaseoso de la Tierra estaba compuesto en gran parte por elementos ligeros, hidrógeno y helio. El viento solar de esa nueva estrella T Tauri impulsó la mayor parte del gas y del polvo del disco, que aún no se habían condensado en cuerpos más grandes, tanto más fácilmente cuanto que el núcleo todavía no se había diferenciado. La Tierra no tenía aún un campo magnético, —formado hace al menos 3400 millones de años—,[33] para desviar el viento solar y formar el cinturón de Van Allen. Estos elementos ligeros se encuentran actualmente en cantidades insignificantes en la atmósfera de la Tierra, en comparación con su abundancia cósmica.[34]
Reloj cósmico
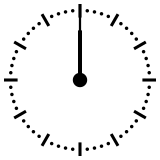
Para ayudar a comprender los valores relativos de un millón o de mil millones de años, esos tiempos se pueden reducir a una «vuelta del dial» de un reloj que representaría en doce horas toda la historia de la Tierra, desde su acreción, en la medianoche, hasta el presente, a mediodía. En esta escala de tiempo, donde los 4540 millones de años están representados en esas doce horas, un millón de años dura poco menos de diez segundos. En el momento de la formación de la Tierra, el Universo se había formado así hacía ya poco más de 36 horas. El Sol se encendió unos tres minutos antes de las 0.00 hs. Se necesitan unos 230 millones de años para dar la vuelta a nuestra galaxia, la Vía Láctea, que en esta escala de tiempo representan unos cuarenta minutos.
La aparición en África del Homo erectus se produjo hace 1.8 Ma,[36] lo que equivale a unos 17 segundos antes del mediodía. En comparación con la historia de la Tierra, el desarrollo de la historia humana es, por tanto, cuantitativamente insignificante.
Hadeano (de −4540 a −4000 Ma)
| Supereón | Eón[37] | M. años |
|---|---|---|
| Fanerozoico | 542,0 ±1,0 | |
| Precámbrico | Proterozoico | 2500 |
| Arcaico | 4000 | |
| Hádico | c. 4567 |
El eón Hádico,[38] Hadeico, Hadeano o Katarchei, es una división de la escala temporal geológica y la primera división del Precámbrico. Comienza en el momento en que se formó la Tierra hace unos 4567 millones de años y termina hace 4000 millones de años, durando unos 567 millones de años, cuando comienza el eón Arcaico. La Comisión Internacional de Estratigrafía lo considera un término formal desde 2022.[39]
El geólogo Preston Cloud acuñó el término en 1972, originalmente para etiquetar el período anterior a las primeras rocas conocidas en la Tierra.[40][41] W. Brian Harland acuñó más tarde un término casi sinónimo, el «período priscoano», de priscus, la palabra latina para «antiguo».[42] Otros textos más antiguos se refieren al eón como el Pre-Arcaico.[43][44][38] Etimológicamente, la palabra «Hádico» proviene de la palabra griega Hades que denominaba al inframundo griego, probablemente porque se lo relaciona con una etapa de calor y confusión.
Durante este período, probablemente el sistema solar se estaba formando dentro de una gran nube de gas y polvo. La Tierra se formó cuando parte de esta materia incandescente se transformó en un cuerpo sólido. Este es el período durante el cual se formó la corteza terrestre. Esta corteza sufrió muchos cambios, debido a las numerosas erupciones volcánicas.
Las rocas más antiguas que se conocen tienen una antigüedad de aproximadamente 4400 millones de años y se encuentran en Canadá y Australia, mientras que las formaciones rocosas más antiguas son las de 3800 millones de años de Groenlandia.
Durante este eón se produjo el bombardeo intenso tardío, que afectó a los planetas interiores del sistema solar hace 3800-4000 millones de años.
Según relojes moleculares y la evidencia fósil el último antepasado común universal de todos los seres vivos vivió a finales de este eón,[45][46] y el origen de los primeros procariotas se estimó a mediados de este eón[47][48][49] Cabe destacar que a comienzos de este eón estuvieron presentes las biomoléculas autorreplicantes que formarían los protobiontes, estructuras abióticas que posteriormente darían origen al último antepasado común universal y a la vida en general. (Véase Abiogénesis)−4540 Ma: el origen


Poco se sabe sobre la historia de la Tierra primitiva, entre −4540 y −4000 Ma (es decir, durante el primer eón, el Hadeano).
La joven Tierra, durante el Hadeano, era muy diferente del mundo tal como se conoce hoy. No tenía ni océano ni oxígeno en su atmósfera. Era bombardeada por planetoides y materiales salidos de la formación del sistema solar. La Tierra se formó durante millones de años de impactos y de acreción, luego los asteroides continuaron chocando con ella, lo que produjo un fuerte calentamiento en la superficie. La Tierra también continuamente se calienta por radiactividad interna.
Este bombardeo, combinado con el calor de las transformaciones radiactivas, con el calor residual y al debido a la presión de contracción, llevaron a las rocas de todo el planeta a un estado de fusión.
Los gases provenientes de las rocas terrestres fundidas eran principalmente, como ahora, el nitrógeno, el dióxido de carbono, el amoníaco, el metano, el vapor de agua y cantidades más pequeñas de otros gases. Sin embargo, esta atmósfera anóxica no tenía capa de ozono y permitía que penetrase la radiación ultravioleta que disociaba las moléculas más frágiles. Solo las más robustas se acumularon en cantidades notables: CO
2, N
2 y H
2O.
El núcleo terrestre se habría formado primero, en menos de 15 millones de años.[50] Estaba principalmente constituido por hierro metálico, pero comportaba un poco de níquel y aproximadamente un 10% de elementos más ligeros (que no se pueden identificar con certeza). Los elementos metálicos que se encontraban en el interior (hierro y níquel) se derritieron y fluyeron hacia el centro del planeta, que emitió aún más calor, acelerando el proceso. El hierro líquido contenido en el núcleo creó un verdadero campo magnético a su alrededor mediante un efecto dínamo. De hecho, fue y es este campo el que protege la atmósfera del planeta del viento solar.
Así es como se formó el núcleo durante los primeros 40 millones de años de la Tierra. A medida que los elementos más pesados se hundían en el centro, los más ligeros subían a la superficie, formando por diferenciación las diferentes envolturas de la Tierra (ver Estructura interna de la Tierra) y produciendo así calor adicional. Esto lleva a la hipótesis de que el modelo del océano de magma lunar puede transponerse a la formación inicial de la Tierra,[51] cuya superficie no era entonces más que un océano de magma generalizado de unos 2000 °C.[52]
Inicialmente, la nebulosa solar estaría formada principalmente por hidrógeno, por lo que sería un medio muy reductor. El carbono tiende a presentarse como metano (CH
4), el nitrógeno como amonio (NH+
4), el oxígeno en forma de agua (H
2O), el azufre en forma de sulfuro de hidrógeno (H
2S).
Pero el hierro migrante en el núcleo bajo forma reducida, la desgasificación de los asteroides primitivos, que inicialmente condujo a una atmósfera fuertemente reductora, dio paso a una desgasificación más oxidada, bajo forma de dióxido de carbono CO
2 y de agua. Por su parte, los gases reducidos como el CH
4 o el monóxido de carbono (CO) se foto-disocian en la atmósfera superior y dieron lugar a la producción de hidrógeno, cuya velocidad media, debido a la agitación térmica, superaba la velocidad de escape, por lo que se escapaba al espacio.[30] La fuga de hidrógeno gaseoso, reducido, será una causa constante del aumento del grado de oxidación de la superficie terrestre a lo largo de su historia.[53] Con esta diferenciación, se crea una nueva atmósfera terrestre a partir de la desgasificación del magma.
Varios millones de años después, una colisión importante con un protoplaneta llamado Tea, o con un asteroide del tamaño de un planeta, cambió la dirección del eje de la Tierra. El impacto mezcló, por fusión a alta temperatura, las capas externas de los dos planetas, lo que hizo que la Tierra se agrandase mientras que el resto de los escombros formaba la Luna. Como resultado del caos de los primeros años de vida del planeta, las colisiones fueron más raras y la Tierra pudo enfriarse.
−4500 Ma: formación de la Luna


El origen de la Luna aún es incierto, aunque muchas evidencias apoyan la tesis de una gran colisión. La Tierra podría no haber sido el único planeta que se formó a 150 millones de kilómetros del Sol. Una hipótesis indica que se habría formado otro cúmulo, dibujando un triángulo equilátero con el Sol y la Tierra, en su cuarto o quinto punto de Lagrange. Este protoplaneta, llamado Tea, habría sido más pequeño que la Tierra actual, probablemente del tamaño y la masa de Marte. Su órbita podría haber sido estable al principio, pero con el tiempo se habría desestabilizado a medida que la Tierra aumentaba su masa por la acumulación de material.
Tea oscilaría con respecto a la Tierra hasta aproximadamente −4533 Ma,[54][55] cuando habría entrado en colisión, en un ángulo oblicuo bajo. Ese ángulo y la velocidad no fueron suficientes para destruir la Tierra, pero si para que expulsase una gran parte de la corteza. La mayor parte de los elementos más pesados de Tea se hundieron en el corazón de la Tierra, mientras que el resto de los materiales y las eyecciones se condensaron en un único cuerpo en unas pocas semanas. Bajo la influencia de su propia gravedad, se convirtió en un cuerpo más esférico, la Luna, que quedó capturada por la gravedad de la Tierra.[56]


La energía del impacto vaporizó enormes volúmenes de roca. La parte superior de esta capa gaseosa incandescente evacuó el calor al espacio, a una temperatura efectiva de 2300 K: la Tierra era entonces una esfera luminosa naranja radiante cuyo manto vaporizado formó una fotosfera. Este enfriamiento provocó movimientos de convección en la fotosfera y toda la masa del manto terrestre debía circular allí de manera repetida para evacuar su calor al espacio.
Los componentes del manto se condensaron gradualmente después de enfriarse, reencontrando en un primer momento una fase líquida. Después de un millar de años, el enfriamiento no dejó en la atmósfera más que gases volátiles, algunos cientos de bares de vapor de agua y una centena de bares de CO
2.[57]
En ese momento, la Luna orbitaba mucho más rápido y a una distancia mucho menor que la actual.[58] También se plantea la hipótesis de que el impacto hubiera cambiado el eje de la Tierra para producir su fuerte inclinación del eje de 23,5°, que es responsable de las estaciones en la Tierra —el modelo ideal para el origen de los planetas considera que tendrían inclinaciones axiales iniciales cercanas a 0°, por lo tanto sin estaciones reconocibles—. El impacto también podría haber acelerado la rotación de la Tierra dándole un tiempo de rotación de unas pocas horas.[58] La hipótesis del gran impacto se ha relacionado con el inicio de la tectónica de placas del planeta.[59]
Una consecuencia importante de esta colisión fue que la Tierra habría capturado el núcleo lunar, lo que explicaría que la Luna es mucho menos densa que la Tierra, debido a que se formó principalmente por rocas de la corteza.[60]
Ese intercambio permitió que la Tierra tuviera un núcleo más grande y, por lo tanto, una mejor protección contra el viento solar gracias al campo magnético de la Tierra.
−4500 a −4000 Ma: enfriamiento


El flujo térmico del interior de la Tierra en ese momento era de 140 W/m². La superficie permaneció caliente, entre 1800 y 2000 K, parcialmente fundida con un poco de escoria sólida.[57] A medida que la tierra dejaba de ser incandescente, se condensaban nubes de agua en la parte superior de la atmósfera, limitando así la evacuación de calor y provocando un efecto invernadero que ralentizaba el enfriamiento. Además, la Luna provocaba grandes mareas, cuya energía se dispersaba en forma de calor adicional.
El CO
2 permaneció en la atmósfera, a una presión de 100 bares, porque este compuesto es poco soluble en el magma a esta presión, y los carbonatos son inestables a la temperatura de la roca fusión, del orden de los 1800 K.[57]
La escoria de feldespato puede formarse y constituir una corteza terrestre primitiva de gabros y anortositas, pero debía reciclarse constantemente en el material fundido.[52]
Una corteza terrestre estable parece estar en su lugar alrededor de −4400 Ma, como indican los cristales de circonio encontrados en el oeste de Australia (fechados alrededor de 4404 ±8 Ma).[61] Después de 20 millones de años, la superficie de la Tierra se había enfriado lo suficiente y el flujo de calor había disminuido a 0,5 W/m², el equivalente a la corteza oceánica moderna que se remonta a un millón de años.[57]
La hipótesis de un océano de magma que ocuparía una fracción nada despreciable de la Tierra durante todo el Hadeano es cuestionada por los estudios de geoquímica (datación por samario-neodimio, isótopos de hafnio en circonitas) que sugieren que una corteza terrestre fijada basáltica (constituida por basaltos y komatiitas) o granítica es mucho más temprana que las rocas terrestres más antiguas.[62] Gracias a la precisión mejorada del espectrómetro de masas, estudios de 2005 aún controvertidos, parecen indicar que esa corteza primitiva se habría formado alrededor de −4450 Ma y habría sobrevivido unos cientos de millones de años antes de ser «remezclada» en el manto.[63] Una vez que la Tierra se había enfriado lo suficiente, la corteza terrestre probablemente apareció hace de 3800 a 4000 Ma, al comienzo,[64] o durante el Arcaico.[65] Las áreas entran nuevamente en fusión debido a grandes impactos que ocurren a intervalos de unas pocas decenas a cientos de años, y estarían en el origen de diferenciaciones parciales.[66]
−4200 Ma: formación de los océanos


El planeta continuaba enfriándose y las lluvias probablemente llevaron a la formación de los océanos hace −4200 Ma.[67][68]
Incluso si el Sol solo estaba emitiendo al 70% de su potencia actual, la cantidad de CO
2 en la atmósfera era suficiente para mantener una temperatura superficial del orden de 500 K (227 °C) en la superficie de un mar líquido (la presión de vapor saturante del agua era de 26,5 bares a 500 K).[57]
El agua cargada de CO
2 forma el ácido carbónico, que ataca a las rocas volcánicas y prolonga su acción en los océanos también saturados en CO
2. El ácido carbónico (CO
3H−
+ H+
) es un ácido débil, pero con los tiempos geológicos, ataca al basalto y corroe el feldespato, por ejemplo la anortita de fórmula CaSi
2Al
2O
8, disociándolos en particular en iones de calcio Ca2+
, normalmente solubles.
Pero a este grado de enfriamiento, y en un océano saturado de carbonatos y de ácido carbónico, la interacción de este último con el calcio dio lugar al carbonato cálcico (caliza), que es prácticamente insoluble:[69]
Ca2+
+ CO
3H−
↔ CaCO
3 + H+
Los carbonatos de calcio y de magnesio son estables en superficie y pueden precipitar, en equilibrio con la erosión de las rocas basálticas. Sin embargo, solo son estables en la región más fría (500 m) de la corteza oceánica.[57] El volumen de carbonatos acumulados sobre este espesor, en toda la superficie de la corteza oceánica del globo, corresponde a la captura de una cantidad de CO
2 permitiendo hacer bajar su presión parcial del orden de 50 bares.[30]
La capacidad de retención del CO
2 por las rocas carbonatadas está condicionada, sin embargo, por la masas limitadas de CaO y de MgO expuestas a la erosión, dado que la exposición a las intemperies de la superficie total de la corteza oceánica solo permitió que se precipitase el equivalente a una decena de bares a la vez.[57] Por lo tanto, toda la corteza oceánica debió pasar por muchos ciclos de subducción antes de que los carbonatos se transfieresen lo suficiente al manto terrestre como para eliminar la mayor parte del CO
2 atmosférico, permitiendo así que la superficie se enfriase por debajo de los 100 °C y permitiese la aparición de la vida.
Una vez que la mayor parte del CO
2 fue eliminada, se instaló un equilibrio dinámico entre la alteración de las rocas en la superficie y la captura de CO
2 en la corteza oceánica para reformar los carbonatos, lo que mantuvo una concentración limitada de CO
2 en el aire y en el océano.[57]
−4100 Ma: bombardeo intenso tardío
.jpg.webp)
De –4000 a –3800 Ma, la Tierra experimentó un período de bombardeo intenso tardío,[70] al igual que la Luna y los otros cuerpos del sistema solar. Esa fase probablemente se debió a la reordenación del sistema solar exterior.
Ese bombardeo intenso esterilizaba periódicamente el océano gracias a la energía que se transfería en forma de calor: un asteroide de ~300 km de diámetro es suficiente para vaporizar una parte del océano y calentar el resto más allá de la esterilización; un asteroide de ~450 km de diámetro vaporizaría el conjunto de todos los océanos; a partir de entonces, la lluvia cayó lentamente, del orden de un metro por año, y el océano tardó unos miles de años en reconstituirse.[57] Sin embargo, siguió siendo posible que los organismos vivos termófilos subsistieran en una zona intermedia a unos mil metros de profundidad en la corteza, lo suficientemente profunda para no ser ebullicionados, y lo suficientemente en la superficie para no ser cocidos por el manto terrestre.[57]
Aunque la historia de los elementos volátiles de la Tierra es ciertamente compleja en detalles y en cualquier caso no muy conocida, está bastante bien establecido que gran parte de la masa aportada por el bombardeo intenso tardío lo fue en forma de elementos hidratados y de carbonatos reducidos, así como una fracción significativa de metal.[30] El impacto de los asteroides metálicos también liberó hierro vaporizado o líquido en la atmósfera y en el océano. A altas temperaturas, el hierro reacciona con el agua para oxidarse, liberando hidrógeno. Este hidrógeno, a su vez, reacciona con los componentes atmosféricos,[57] reduciendo el CO
2 para formar metano CH
4 y nitrógeno N
2, que dan amoniaco, soluble en el océano bajo la forma del hidróxido de amonio NH+
4. De una manera general, la desgasificación de esta lluvia de asteroides, ya fuese durante su impacto o por posterior liberación volcánica, condujo a heterogeneidades en la corteza terrestre y en el manto terrestre, y produjo una atmósfera más reductora que anteriormente.[30]
Este suministro tardío de elementos reducidos en superficie tiene por consecuencia importante reinyectar nitrógeno en forma de NH+
4 directamente explotables por química prebiótica. Por otro lado, los meteoritos ferrosos están particularmente cargados de fósforo, un elemento indispensable para la vida pero inicialmente raro en la corteza terrestre,[71] (este elemento siderófilo migra con el núcleo terrestre). De la serie de elementos «CHNOPS» indispensables para la vida y que constituyen la biosfera, solo el fósforo es un elemento naturalmente raro.
−4000 Ma: rocas más antiguas datadas

Las primeras rocas que se distinguen de la corteza oceánica son rocas magmáticas resultantes de erupciones volcánicas. Las rocas más antiguas identificadas hasta hoy se encuentran en el escudo Canadiense.[72] Son tonalitas que datan de unos −4030 Ma y marcan el final del Hadeano, eón que se caracteriza por la ausencia de testimonios geológicos. Estas rocas muestran rastros de metamorfismo por alta temperatura, pero también granos sedimentarios que han sido redondeados por la erosión durante el transporte por agua, mostrando que ya existirían entonces ríos y mares. Los cratones consisten primariamente de dos tipos alternativos de terranos. Los primeros se llaman cinturones de rocas verdes, que consisten en rocas sedimentarias —las más antiguas datan de −3800 Ma— de bajo grado de metamorfismo.[73] Esas "rocas verdes" son similares a los sedimentos que hoy en día se encuentran en las fosas oceánicas, encima de las zonas de subducción. Por esta razón, las rocas verdes son algunas veces vistas como evidencia de subducción durante el Arcaico. El segundo tipo es un complejo de rocas magmáticas félsicas. Estas rocas son mayormente tonalitas, trondhjemitas o granodioritas, tipos de roca similar en composición al granito. Los complejos TTG son vistos como partes relictas de la primera corteza continental, formada por la fusión parcial en basalto.[74]
Algunas rocas metasedimentarias más jóvenes del oeste de Australia (Jack Hills) han revelado la presencia de circones hadeanos datados el más antiguo de −4400 Ma.[61] El circón se forma durante la génesis de las rocas magmáticas comunes, principales constituyentes granitoides de la corteza terrestre, especialmente los granitos y las rocas alcalinas como la pegmatita o la sienita. Aparece con los productos precoces de la cristalización primaria de estas rocas. La presencia de este mineral reciclado en las rocas en cuestión indica que existían superficies sujetas a erosión en ese momento; pero estas superficies no se han encontrado.
Arcaico (de −4000 a −2500 Ma)
| Supereón | Eón[75] | Millones años |
|---|---|---|
| Fanerozoico | 542,0 ±1,0 | |
| Precámbrico | Proterozoico | 2500 |
| Arcaico | 4.000 | |
| Hádico | ca. 4.600 |
El Arcaico o eón arcaico —anteriormente conocido como Arqueozoico y en ocasiones Arqueano (este último, un anglicismo)— es una división de la escala temporal geológica, es la segunda división geológica del Precámbrico. Comienza hace 4000 millones de años, después del eón hádico, y finaliza hace 2500 millones de años, cuando comienza el eón proterozoico, durando unos 1500 millones de años.[76] Las fechas se definen cronométricamente, en lugar de estar basadas en la estratigrafía.[77][78] El límite inferior (punto de partida) no ha sido oficialmente establecido por la Comisión Internacional de Estratigrafía. En la literatura antigua, el Hádico se incluye como parte del Arcaico. El nombre «arcaico» proviene del griego antiguo «αρχή», que significa «comienzo», «origen».
En este período se produce una evolución de la corteza terrestre, por lo cual tuvo que haber una tectónica de placas (movimiento de placas) y una estructura interna terrestre similar a la que conocemos hoy en día, aunque la diferenciaba el exceso de calor. Se calcula que había más actividad tectónica debido a la mayor velocidad con que se produce la litosfera, por lo cual también cabría esperar que hubiese mayor actividad en las dorsales y un mayor número de ellas, así como mayor actividad en las zonas de subducción y mayor número de placas y más pequeñas, evidentemente.−3800 Ma: inicios de la vida microbiana
Al comienzo del Arcaico, la menor actividad solar se vio compensada por una atmósfera muy cargada de gases de efecto invernadero. La temperatura era elevada. A medida que el agua y el dióxido de carbono se transferían a los océanos y a los carbonatos, la atmósfera restante progresivamente quedó constituida principalmente de nitrógeno. El efecto invernadero disminuyó con la pérdida del CO
2, la temperatura de la superficie descendió gradualmente y alcanzó valores (70-100 °C) donde las reacciones químicas de los termófilos se hicieron posibles. El análisis isotópico del silicio muestra que la temperatura de los océanos disminuyó desde 70 °C, hace 3500 Ma, a 20 °C, hace 800 Ma.[79] Si esa atmósfera se hubiera mantenido, la Tierra ya no sería habitable hoy.
La vida microbiana apareció en ese momento. Cualitativamente, un determinado medio que disponía de un gradiente químico permitió la producción de compuestos orgánicos y de reacciones variadas. Ciertas reacciones condujeron a polimerizaciones (polinucleótidos), y ciertos compuestos formados actuaron como catalizadores de otros. En un sistema tan complejo, tan pronto como una cadena de reacciones se catalizaba, tendía a dominar y a agotar los recursos disponibles, pudiendo luego ser la base de nuevas complejidades.
En esa creciente complejidad, no hay un límite claro entre un sistema autocatalítico y «la vida»; en ambos casos la competencia conduce a una selección natural favoreciendo diferencialmente lo que era más efectivo en términos de reproducción y de uso eficiente de los recursos. Tan pronto como el sistema se volvió lo suficientemente estable y robusto para asegurar una reproducción suficientemente fiel, bajo unas condiciones ambientales lo más variadas, puede describirse como autopoiético: «la vida» comienza y se extiende a todos los ambientes conectados, en unos pocos cientos o miles de años.[57]
La vía exacta seguida por los orígenes de la vida, que se cree se remontaría a unos 3500 a 3800 Ma, sigue siendo incierta, y los científicos desconocen la fecha exacta de aparición de la primera célula. Pero de alguna manera, la vida finalmente tomó la forma de una «célula», capaz de mantener la integridad de un «individuo» con respecto al medio ambiente, capaz de mantener un metabolismo coherente mediante intercambios químicos con el medio circundante, y capaz de replicarse a sí misma produciendo otros «individuos» idénticos.
Estas tres funciones de base son esenciales para la vida. La delimitación de un «individuo» en relación con un entorno «externo» se refiere a lo que es una membrana plasmática, capaz de asegurar tal separación. La replicación idéntica de un sistema formal se refiere a la codificación genética de la información necesaria para esta célula, probablemente primero en forma de un mundo de ARN, luego en una forma estabilizada por el ADN. Pero es el metabolismo de estas células el que resultará fundamental para describir su evolución y su influencia en la historia de la tierra, a través del impacto que esta bioquímica tendrá en la evolución del planeta.
Aparte de algunos ensayos de vida en colonia, «la vida» seguirá siendo unicelular a lo largo del Arcaico y del Proterozoico, durante el cual la «sopa primordial» se transforma simplemente en una sopa de entidades replicantes, diferenciadas progresivamente en virus, arqueas y bacterias, y finalmente eucariotas. Solo con la aparición de estas últimas, 3500 Ma después, aparecerá «la vida» tal como se conoce, inaugurando el Fanerozoico.
Vida

Los detalles del origen de la vida se desconocen, aunque se han establecido unos principios generales. Hay dos teorías sobre el origen de la vida. La primera defiende la hipótesis de la «panspermia», y sugiere que la materia orgánica pudo haber llegado a la Tierra desde el espacio,[80] mientras que otros argumentan que tuvo origen terrestre. En cambio, es similar el mecanismo por el cual la vida surgió.
La vida surgió en la Tierra quizás hace unos 4000 Ma, aunque el cálculo de cuándo comenzó es bastante especulativo. Generada por la energía química de la joven Tierra, surgió una molécula (o varias) que poseía la capacidad de hacer copias similares a sí misma: el «primer replicador». La naturaleza de esta molécula se desconoce. Esta ha sido reemplazada en funciones, a lo largo del tiempo, por el actual replicador: el ADN. Haciendo copias de sí mismo, el replicador funcionaba con exactitud, pero algunas copias contenían algún error. Si este cambio destruía la capacidad de hacer nuevas copias se extinguía. De otra manera, algunos cambios harían más rápida o mejor la réplica: esta variedad llegaría a ser numerosa y exitosa. A medida que aumentaba la materia viva, la "comida" iba agotándose, y las «cadenas» explotarían nuevos materiales, o quizás detenía el progreso de otras «cadenas» y recogía sus recursos, llegando a ser más numerosas.
Se han propuesto varios modelos para explicar cómo podría desarrollarse el replicador. Se han propuesto diferentes cadenas, incluidas algunas como las proteínas modernas, ácidos nucleicos, fosfolípidos, cristales, o incluso sistemas cuánticos. Actualmente no hay forma de determinar cuál de estos modelos pudo ser el originario de la vida en la Tierra. Una de las teorías más antiguas, en la cual se ha estado trabajando minuciosamente, puede servir como ejemplo para saber cómo podría haber ocurrido. La gran energía de los volcanes, rayos y la radiación ultravioleta podrían haber ayudado a desencadenar las reacciones químicas produciendo moléculas más complejas a partir de compuestos simples como el metano y el amoníaco. Entre estos compuestos orgánicos simples estarían los bloques con los que se construiría la vida. A medida que aumentaba esta "sopa orgánica", las diferentes moléculas reaccionaban unas con otras. A veces se obtenían moléculas más complejas. La presencia de ciertas moléculas podría aumentar la velocidad de reacción. Esto continuó durante bastante tiempo, con reacciones más o menos aleatorias, hasta que se creó una nueva molécula: el «replicador». Este tenía la extraña propiedad de promover reacciones químicas para conseguir una copia de sí mismo, con lo que comenzó realmente la evolución. Se han postulado otras teorías del replicador. En cualquier caso, el ADN ha reemplazado al replicador. Toda la vida conocida (excepto algunos virus y priones) usan el ADN como su replicador, de forma casi idéntica.
Células
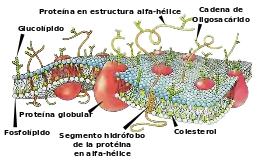
En la actualidad se tiene que reproducir materia empaquetada dentro de la membrana celular. Es fácil comprender el origen de la membrana celular, así como el origen del replicador, debido a que las moléculas de fosfolípidos que construyen una membrana celular a menudo forman una bicapa espontáneamente cuando se colocan en agua (véase «Teoría de la burbuja»).[81] No se sabe si este proceso precede o da como resultado el origen del replicador (o quizás fuera el replicador). La teoría que predomina más es que el replicador, quizás el ARN (hipótesis del ARN mundial), junto a este instrumento de reproducción y tal vez otras biomoléculas, ya habían evolucionado. Al principio las protocélulas simplemente podrían haber explotado cuando crecían demasiado; el contenido esparcido podría haber recolonizado otras "burbujas". Las proteínas que estabilizaban la membrana, o que ayudaban en la división de forma ordenada, podrían estimular la proliferación de estas cadenas celulares. ARN es probablemente un candidato para un primer replicador ya que puede almacenar información genética y catalizar reacciones. En algunos puntos el ADN prevaleció el papel de recopilador genético sobre el ARN, y las proteínas conocidas como enzimas adoptaron el papel de catalizar, dejando al ARN para transferir información y modular el proceso. Se tiende a creer que estas primigenias células pudieron evolucionar en grupos en las chimeneas volcánicas submarinas conocidas como "fumarolas negras";[82] o incluso calientes, rocas marinas.[83] No obstante, se cree que de todas estas múltiples células, o protocélulas, solo una sobrevivió. Las evidencias sugieren que el último antepasado universal vivió durante el principio del Eón Arcaico, hace alrededor de 3500 Ma o incluso antes.[84][85] Esta célula "LUCA" es el antecesor común de todas las células y por tanto de toda la vida en la Tierra. Fue probablemente una procariota, la cual poseía una membrana celular y probablemente ribosomas, pero carente de un núcleo u orgánulos como mitocondrias o cloroplastos. Igual que todas las células modernas, utilizaba el ADN como código genético, el ARN para transferir información y sintetizar proteínas, y los enzimas para catalizar las reacciones. Algunos científicos opinan que en vez de ser un solo organismo el que dio lugar al último antepasado universal, había poblaciones de organismos intercambiándose genes en transferencia horizontal.[84]
Ciclos del carbono y del nitrógeno
A nivel energético, la vida muy probablemente apareció alrededor de una fuente hidrotermal difundiendo el hidrógeno reductor en un ambiente cargado de dióxido de carbono.[31][86] La fuente de energía primaria de las células primitivas habría sido la metanogénesis,[53][87] reacción de oxidoreducción exotérmica que produce metano a partir de hidrógeno y dióxido de carbono:
CO
2 + 4 H
2 → CH
4 + 2 H
2O + 135 kJ
La fermentación presentaba la ventaja de utilizar prácticamente los mismos procesos que los del metabolismo metanogénico anterior, por lo que estaría al alcance de esas células primitivas.[86] Para la fermentación, el catabolismo menos eficiente, los propios compuestos orgánicos desempeñaron el papel de aceptor de electrones.[88] La fermentación de la materia orgánica observada (CH
2O) condujo a la liberación de metano (y dióxido de carbono) en una reacción que se puede describir esquemáticamente por:[87]
2 (CH
2O) → CO
2 + CH
4
Las células primitivas consumían el CO
2, abundante en el medio ambiente de la época, pero también el hidrógeno más raro, que se encuentra en las emisiones volcánicas. Esa dependencia del hidrógeno sería un factor limitante, la producción primaria que permitía era necesariamente muy limitada.[57][89] El catabolismo de las primeras células no podía depender de la respiración celular que requería de oxígeno libre, entonces ausente del planeta, ni de la respiración anaeróbica con compuestos inorgánicos, como el nitrato (NO−
3) o el sulfato (SO2−
4), menos eficiente que la precedente.[88]
La existencia de una vía de catabolismo podría haber permitido la aparición de las primeras células heterótrofas, en cuanto la evolución de las células les permitió capturar y digerir otras células sin perder ellas mismas su identidad.
Además, el comienzo de la vida fue también el comienzo del ciclo del nitrógeno. El nitrógeno es un componente indispensable de la vida, siendo, por ejemplo, un componente central de los aminoácidos. Sin embargo, la mayor parte del nitrógeno se presenta bajo la forma de dinitrógeno N
2, que es relativamente inerte. En el océano primitivo, otra forma estable del nitrógeno era el hidróxido de amonio NH+
4,[90] aportado por el gran bombardeo tardío, o difundido alrededor de las dorsales oceánicas por los respiraderos hidrotermales. Fue esta forma la que sería para la bioquímica el punto de entrada hacia la materia orgánica. Por lo tanto, el requerimiento de nitrógeno fijado pasó inicialmente por un ciclo no biológico, del cual dependió la biosfera,[91][92] un equilibrio que tuvo lugar en el océano entre el nitrógeno fijado en la biomasa y el que regresaba en forma de NH+
4 por los residuos orgánicos.
Efecto termostato de los metanógenos
En la atmósfera superior, el metano se disociaba por la radiación ultravioleta y el hidrógeno libre se escapaba al espacio, lo que contribuyó a la oxidación progresiva de la superficie de la Tierra.[53]
Tan pronto como las primitivas células metanogénicas se volvieron lo suficientemente abundantes como para que su producción superase la desaparición del metano por fotólisis en la estratosfera, el metano producido se difundió en la atmósfera, donde causó un efecto invernadero mucho más eficiente que el del dióxido de carbono. Entonces se convierte en un importante contribuyente al efecto invernadero[87] y, gracias a su lenta acumulación, pudo compensar a muy largo plazo la caída del CO
2, gradualmente transformado en carbonatos e inmovilizado en su ciclo del carbono en la litosfera.[69]
Una temperatura demasiado alta o demasiado baja podía inhibir este proceso de metanogénesis, que disminuyó tan pronto como la temperatura se aleja de su nivel óptimo. Como resultado, el ciclo del metano tuvo un efecto de termostato, manteniendo la temperatura efectiva de la biosfera en un nivel en el que la producción de CH
4 solo compensaba su disociación por la radiación ultravioleta, si bien su acumulación se autorregulaba. Esta regulación es similar a la descrita entre el contenido de CO
2 y el clima, pero operaba en una escala de tiempo mucho más lenta.[69]
La concentración de metano era inicialmente baja. En ese estadio, apareció una regulación positiva entre la desaparición geológica del CO
2 y la aparición biológica del CH
4, estabilizando inicialmente la temperatura en el límite superior de la capacidad de las bacterias metanogénicas: si las temperaturas bajaban, aumentaba la producción de CH
4 y con él el efecto invernadero, restableciendo la temperatura elevada.
Posteriormente, la presión atmosférica en CO
2 ha podido continuar a disminuir, hasta el punto en que la fugacidad del metano se acercase a la del dióxido de carbono, lo que condujo a la formación de un smog de hidrocarburos en la atmósfera.[69][87][93] Este smog tuvo un efecto invernadero negativo (similar al observado en Titán), porque la energía solar se absorbía en la estratosfera y se irradiaba al espacio sin llegar al suelo. En este caso, la regulación precedente se invirtió: la temperatura bajaba, el CH
4 aumentaba, el smog también, y la temperatura efectiva de la biosfera descendía con un efecto de bola de nieve. Sin embargo, la caída de temperatura no superaba el límite inferior de la capacidad de las bacterias metanogénicas. Por debajo de ese límite, de hecho, la producción de CH
4 caería y ya no compensaría las pérdidas, el smog desaparecía y las temperaturas subían a su segundo valor de equilibrio.[69]
Esta segunda regulación ya no se relaciona directamente con la temperatura, sino con las condiciones de formación del smog. Por tanto, pudo permitir que las temperaturas siguieran descendiendo con la desaparición del dióxido de carbono. Por otro lado, la aparición de una cobertura que filtraba la radiación solar[87] pudo haber permitido que las células primitivas sobrevivieran en la superficie, abriendo el camino a la fotosíntesis.
−3700 Ma: aparición de la fotosíntesis anoxigénica


La fotosíntesis pudo evolucionar a partir de reacciones fotocatalíticas que proporcionan una forma alternativa de producir los hidratos de carbono (de fórmula genérica CH
2O) a partir de sulfuros u de óxido de hierro. Con la constante fuga de hidrógeno al espacio, la superficie de la Tierra se volvió progresivamente menos reducida, y aparecieron más sustancias oxidadas, como el sulfato o el óxido férrico. En un primer momento, estas sustancias minerales pudieron ser usadas como receptor final de electrones, abriendo el camino para la respiración anaeróbica.
2 (CH
2O) + SO2−
4 → 2 CO
2 + S2−
+ 2 H
2O + energía
2 (CH
2O) + 2 Fe
2O
3 → CO
2 + 4 FeO + H
2O + energía
Como se señaló anteriormente, la fermentación es una vía de catabolismo bastante ineficaz. Por tanto, la emergencia de vías catabólicas más eficientes proporcionaba una ventaja selectiva inmediata a las células heterótrofas, lo que condujo a la generalización del proceso.
Los suelos esquistosos y arcillosos son susceptibles de contener piritas (en un ambiente anóxico), por la acción de las bacterias sobre la materia orgánica. El punto de partida de esta mineralización se encuentra en la producción de sulfuro de hidrógeno por bacterias proteolíticas que degradan las proteínas o por las bacterias sulfato-reductoras que descomponen los sulfatos (productos resultantes de la descomposición de las proteínas) en sulfuro de hidrógeno. Otras bacterias reducen los hidróxidos férricos (hidróxidos salidos de las rocas o de la materia orgánica) y liberan los iones ferrosos al medio ambiente. Al combinarse con el hierro, el sulfuro de hidrógeno conduce a la precipitación de sulfuros de hierro, precursores de la pirita. Cuando la pirita tiene un origen sedimentario, constituye el mineral autigénico característico de los ambientes marinos anóxicos ricos en materia orgánica.[94] La respiración anaeróbica está formada por una cadena de reacciones enlazadas, catalizadas por proteínas, que permiten por un lado consumir materia orgánica y por otro liberar energía. Inversamente, si se suministra energía en el otro extremo de la cadena, los balances se mueven en la otra dirección, hacia la síntesis de materia orgánica. Capturarando la energía del Sol con el fotorreceptor adecuado, las bacterias (las primeras formas de vida) desarrollaron un nuevo proceso: la fotosíntesis, siguiendo reacciones genéricas:[57]
2 CO
2 + S2- + 2 H
2O + hν → 2 (CH2O) + SO42-
CO
2 + 4 FeO + H
2O + hν → 2 (CH2O) + 2 Fe2O3
Esta reacción pasa por la producción de una coenzima reductora, el NADPH, y una coenzima que almacena energía química, la ATP. Además, las reacciones independientes de la luz utilizan el flujo de estas dos coenzimas para absorber y reducir el dióxido de carbono, utilizando el NADPH como fuente de electrones y la ATP como fuente de energía.
Al igual que con el origen de la vida, la invención de la fotosíntesis tuvo un efecto de bola de nieve. Las primeras células donde pudo evolucionar este metabolismo fueron inicialmente las células metanogénicas, que llegaron a un ambiente marino poco profundo, suficientemente iluminadas para permitir la explotación de estos iones (pero a una profundidad suficiente para protegerse contra la radiación ultravioleta). Al principio, fue la baja disponibilidad de hidrógeno H2 que puso una presión de selección a favor de la emergencia de un ciclo alternativo; y la mayor disponibilidad del azufre y del hierro permitió incrementar su producción primaria, constituyendo una ventaja selectiva. La primera célula capaz de prescindir por completo del hidrógeno ya no dependía de estas fuentes limitadas y pudo proliferar por todo el planeta.[57] En comparación con las fuentes de energía anteriores, las estimaciones cuantitativas tienden a mostrar que el flujo metabólico pudo haber aumentado en un factor de cien.[95]
Esta nueva fuente de energía estaba mucho más disponible que el hidrógeno de la bioquímica inicial. Sin embargo, todavía estaba limitada por la disponibilidad de aceptores de electrones, como el hidrógeno sulfurado (H2S(aq)), o el hierro férrico.[89] Sin embargo, el acceso a la energía solar permitió que las bacterias fotosintéticas crecieran en número, hasta el punto de dejar trazas significativas y detectables en la sedimentación:
- los científicos creen haber encontrado microorganismos fósiles en las rocas de Isua en Groenlandia que se remontan a −3800 Ma. Pero podrían ser artefactos. El análisis isotópico de los depósitos de hierro en este mismo yacimiento muestra una sobrerrepresentación de 56Fe, índicador de una actividad fotosintética;[96]
- los depósitos de hierro bandeado más antiguas datan de −3700 Ma. En la medida en que son la marca de un episodio de oxidación del hierro oceánico, se puede ver en ellos la firma de una importante actividad de la respiración anaeróbica, por lo tanto de la fotogénesis;[96]
- los fósiles celulares más antiguos que se conocen son los estromatolitos que datan de hace −3500 Ma, que están formados por colonias celulares en medios saturados.
Sobre este último punto, cabe destacar que los estromatolitos están formados estructuralmente por velos bacterianos, pero el origen de estos velos puede ser variable. Hoy en día, estos velos son solo los de las cianobacterias, pero esto no implica que los estromatolitos fósiles también fueran creados por esas mismas cianobacterias: cualquier procariota capaz de formar una colonia puede ser igualmente candidato.[97] Y, en particular, la aparición de estromatolitos no implica en modo alguno una producción de oxígeno, cuyos efectos probados son mucho más tardíos. La aparición de la fotosíntesis es distinta de la fotosíntesis oxigenica.[98]
Si el nitrógeno biodisponible no fue necesariamente un factor limitante al comienzo de la vida, ciertamente lo fue con el inicio de la fotosíntesis anóxica.[95]
Siendo el acceso al nitrógeno fijado un factor limitante de la biomasa, a partir de ese momento pudo existir una ventaja selectiva de disponer de una vía metabólica que permitiera fijar el nitrógeno atmosférico disuelto en la capa oceánica superficial. De hecho, la firma del enriquecimiento isotópico del nitrógeno en los depósitos de −3200 a −2500 Ma tiende a mostrar que tal camino ya existía en ese período.[99]
Fotosíntesis y oxígeno

Probablemente las primeras células eran todas heterótrofas, utilizando todas las moléculas orgánicas (incluso las de otras células) como materia prima y como fuente de energía.[100] A medida que el suministro de comida disminuía, algunas desarrollaron una nueva estrategia. En vez utilizar los cada vez menores grupos de moléculas orgánicas libres, estas moléculas adoptaron la luz solar como fuente de energía. Las estimaciones varían, pero hace unos 3000 Ma,[101] algo similar a la actual fotosíntesis se había desarrollado. Esto hizo que la energía solar disponible no solo para los autótrofos sino que también para los heterótrofos que se nutrían de ellos. La fotosíntesis consume bastante CO2 y agua como materia prima y, con la energía de la luz solar, produce moléculas ricas en energía (los carbohidratos).
Además, se producía oxígeno como desecho de la fotosíntesis. Al principio, este elemento se combinaba con caliza, hierro, y otros minerales. Hay una prueba sólida de esto en las capas ricas de hierro oxidado en el estrato geológico correspondiente a este periodo. Los océanos habrían cambiado el color a verde mientras el oxígeno estaba reaccionando con los minerales. Cuando cesaron las reacciones, el oxígeno pudo finalmente llegar a la atmósfera. Aunque cada célula solo produce una pequeña cantidad de oxígeno, el metabolismo combinado de todas ellas, durante un vasto período, transformó la atmósfera terrestre al estado actual.[102]
La actual es, entonces, la tercera atmósfera de la Tierra. La radiación ultravioleta excitó parte del oxígeno formando ozono, el cual se fue acumulando en una capa cerca de la zona superior de la atmósfera. La capa de ozono absorbía, y absorbe aún, una cantidad significativa de la radiación ultravioleta, que antes atravesaba sin impedimentos la atmósfera. Esto permitió a las células colonizar la superficie del océano y, en definitiva, la tierra.[103] Sin la capa de ozono, la radiación ultravioleta bombardearía permanentemente la superficie terrestre, causando niveles insostenibles de mutación en las células expuestas.
Además de proporcionar una gran cantidad de energía disponible para la vida y bloquear la radiación ultravioleta, la fotosíntesis causó un tercer efecto, el más importante, y que tendría un impacto a escala planetaria: el oxígeno era tóxico para la mayor parte de la vida anterior a la fotosíntesis. Probablemente gran parte de la vida en la tierra murió al aumentar sus niveles, es la llamada «catástrofe del oxígeno».[103] Las formas de vida que sobrevivieron, prosperaron, y algunas desarrollaron la capacidad de utilizar el oxígeno para mejorar su metabolismo y obtener más energía de la misma materia orgánica.
−3400 Ma (?): aparición de la fotosíntesis oxigenada

Después de la invención de la fotosíntesis anoxigénica, las bacterias evolucionaron y, a través de la selección natural, varias versiones de la reacción fotosintética emergieron permitiendo una adaptación óptima a los diferentes ambientes colonizados por esas bacterias. Estas versiones podrían haber intercambiado por transferencia de genes horizontales de una familia a otra, y al azar de estos cruces, el antepasado de las cianobacterias (o quizás una bacteria de otra familia) pudo haber heredado dos conjuntos de proteínas capaces de funcionar en serie.[104] Esta serialización permitió utilizar el agua misma como donante de electrones en reacciones redox bioquímicas:
2 H
2O → 4 H+
+ 4 -
e + O
2 ↑
Esta transformación se desarrolló en dos fases: en la primera, las reacciones dependientes de la luz captan la energía luminosa y la utilizan para producir una coenzima reductora, la NADPH, y una coenzima que almacena energía química, la ATP. Estas dos coenzimas alimentarán el metabolismo celular, como anteriormente. Observando «hidratos de carbono» por la fórmula genérica (CH
2O), la fotosíntesis se puede describir generalmente mediante:
CO
2 + H
2O + energía luminosa → (CH
2O) + O
2 ↑
La aparición de la fotosíntesis oxigenica modificó radicalmente la economía de la producción primaria: para esta nueva fuente de energía, el donador de electrones que era el agua era ahora inagotable en un medio acuático.[89] El punto importante de este nuevo ciclo es que entrañó la producción de una molécula de oxígeno en el medio ambiente.
Varios estudios sugieren que la aparición de la fotosíntesis data de −3400 Ma.[105][106][107][108] Pero esta fecha es objeto de discusiones críticas, la fecha de aparición de la fotosíntesis oxigénica varía desde un «como mínimo» asociado con los primeros estromatolitos a 3500 Ma, hasta un «como máximo» marcado por la Gran Oxidación, en −2400 Ma.
Un indicador que señala una producción fotosintética de oxígeno proviene de la firma isotópica del carbono en los depósitos arqueanos. De hecho, la fijación del carbono a través del ciclo de Calvin conduce a una separación isotópica significativa, agotando el 13C en varias partes por mil en comparación con el 12C. El agotamiento en masa de la biosfera en 13C conduce simétricamente a un enriquecimiento de la hidrosfera y de la atmósfera, cuyo nivel se registra durante la precipitación de los carbonatos marinos.[53]
−3260 Ma: Impacto de Barberton
La tectónica de placas es propulsada principalmente por el hundimiento gravitatorio de la litosfera en zonas de subducción: la corteza oceánica de más de 3000 Ma es más densa (de ~1%) que la astenosfera, y allí se cae hundiéndose los más posible. Pero esta inversión de densidad actual no fue tan marcada durante el Arcaico, porque la temperatura más elevada del manto resultaría en una litosfera más delgada.[109] Además, para iniciar y mantener tal movimiento, no basta con iniciarlo con un simple fosa de subducción; se debe configurar todo un sistema de dorsales y de fallas transformantes, que una vez creada puede continuar dinámicamente.[109] Además, para que se inicie una subducción según este modelo, el movimiento debe ser impulsado por la placa que se hunde, y por tanto, que la subducción ya hubiera comenzado.[110]
Antes del inicio de la tectónica de placas, durante la mayor parte del Arcaico, la superficie de la Tierra estaba probablemente en el mismo estado que la de otros planetas o planetoides telúricos: bajo la hidrosfera oceánica, una litosfera basáltica forma una «cubierta» relativamente continua sobre la astenosfera. De los plumas que pueden ocasionalmente perforar la corteza oceánica y causar un volcanismo en superficie, la sobrecarga es probable que cree un sistema de fracturas.[110] Trozos de corteza pueden hundirse localmente y en la astenosfera, y luego posiblemente ser reciclados más tarde por el vulcanismo.[109] La evolución natural de este tipo de corteza es que se espesa en bloque a medida que el planeta se enfría.[109]
Los primeros elementos de la corteza continental pueden haberse formado a partir de grandes mesetas basálticas y su posterior erosión.[111] Sin embargo, no se conoce ningún depósito sedimentario de carbonatos que date del eón Hadeano.
En abril de 2014, los científicos declararon que habían encontrado evidencia del mayor evento de impacto de meteorito terrestre hasta la fecha cerca del cinturón de rocas verdes de Barberton. Estimaron que el impacto tuvo lugar hace unos 3260 Ma y que el impactador tendría entre 37 y 58 kilómetros de diámetro, cinco veces más que el impacto del cráter del Chicxulub en la península de Yucatán. El impactador golpeó la Tierra liberando una enorme cantidad de energía, provocando el equivalente de terremotos de magnitud 10,8 y de megatsunamis de miles de metros de altura. El cráter de impacto de Barbertone, si aún existe, todavía no se ha encontrado.
La modelización muestra que una tectónica de placas puede iniciarse por el impacto de un asteroide del orden de 500 km de diámetro,[109] o incluso a partir de 100 km.[110] Pero el impacto de Barberton no es de esa clase, aunque puede haber sido una parte de la historia. También es posible que una pluma suficientemente activa pudiera crear una provincia magmática importante de más de 1000 km de diámetro, cuyo colapso como resultado de la inversión de densidad probablemente pudiera iniciar un movimiento de placa.[109] Pero incluso en ese caso, no es seguro que ese movimiento continuase hasta ahora: la tectónica de placas podría haberse iniciado varias veces en la Tierra, separadas por episodios de cobertura continua,[109] lo que lleva a trazas geológicas alternando presencia y ausencia de subducción.[110]
−3000 Ma: primeros continentes
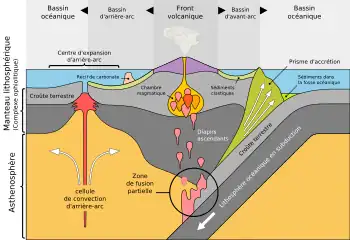
Se estima que el 80% de la corteza continental terrestre se formó entre −3200 y −2500 Ma.[112] Estaba entonces caracterizada por un cambio de régimen, pasando de intrusiones formadas por granitoides sódicos a granitos potásicos.[113][114][115] Esta coincidencia entre los cambios observados en la composición y el espesor de la corteza terrestre y la oxidación progresiva de la superficie terrestre debida a la invención de la fotosíntesis (anoxigénica y luego oxigenada) sugiere que habría existido un vínculo entre los procesos geoquímicos y la producción biológica,[116] pero la naturaleza de ese vínculo sigue sin estar clara.
Este es el comienzo de la importancia de la tectónica de placas. Con la formación de la corteza continental, los carbonatos pudieron acumularse allí en la litosfera, que luego sirvió como sumidero en el ciclo del carbono. El continuo crecimiento de la corteza continental expuso cada vez más superficie a la erosión del ácido carbónico, acelerando gradualmente la captura del CO
2 atmosférico.[87]
En el fondo del océano, la circulación hidrotermal alrededor de las dorsales oceánicas proporcionaba un mecanismo regulador de la concentración del CO
2 y de la acidez del océano. El agua de los océanos, más o menos cargada de CO
2, atacó al basalto y se cargó con cationes, luego se precipitaba en forma de carbonatos, formando una fuente hidrotermal en su regreso al océano.[117][118]
La subducción condujo a la formación de arcos volcánicos, que se acumularon al comienzo de la corteza continental. Los carbonatos arrastrados por la subducción se descompusieron en profundidad y el vulcanismo del arco liberó en parte el carbono en forma de CO
2. En el caso de placas que llevaban mucho sedimentos, los arcos insulares podían ser dobles:
- un primer arco no volcánico formado por un prisma de acreción sedimentario cerca de la fosa oceánica como la de Barbados, en las Antillas, o las Islas Mentawai, en Indonesia;
- un segundo arco volcánico más alejado de la fosa.
Los primeros «continentes» están datados de este período. Son hipotéticos y toman la forma de «super-cratones» de un tamaño comparable al de Australia:
- Vaalbara que comenzó a formarse hace 3600 Ma y existía desde −3100 a 2500 Ma;
- Ur, formado hace unos 3000 Ma durante el Arcaico;
- Kenorland, formado durante la era neoarcheana, hace aproximadamente 2700 Ma (2700 Ma).
La convección del manto, el proceso que maneja las placas tectónicas actualmente, es el resultado del flujo de calor desde el interior hasta la superficie de la Tierra. Implica la creación de placas tectónicas rígidas en medio de las dorsales oceánicas y su destrucción en el manto en las zonas de subducción. Durante el principio del Arcaico (cerca de 3,0 Ga) el manto estaba mucho más caliente que en la actualidad, probablemente cerca de 1600 °C, por lo tanto la convección en el manto era más rápida. Aunque ocurría un proceso similar a la tectónica de placas de hoy en día, este también habría sido mucho más rápido. Es probable que durante el Hádico y el Arcaico, las zonas de subducción fueran más abundantes, y por lo tanto las placas tectónicas fueran más pequeñas.
La corteza inicial, formada cuando la superficie de la Tierra se solidificó por primera vez, desapareció totalmente debido a la combinación de una tectónica de placas muy activa durante el Hádico y los grandes impactos del bombardeo intenso tardío en el Arcaico, hace entre 4100 y 3800 Ma. Se supone que aquella corteza primitiva estaba compuesta de basalto, como la corteza oceánica actual, porque se había producido muy poca diferenciación en la corteza. Las primeras masas grandes de corteza continental, producto de la diferenciación de elementos más ligeros durante la fusión parcial en la parte más baja de la corteza, aparecieron al final del Hádico, hace cerca de 4000 Ma. Los restos que quedan de aquellos primeros continentes son los llamados escudos o cratones. Estos elementos litosféricos ligeros del Hádico tardío y de la corteza del Arcaico temprano constituyeron los núcleos alrededor de los cuales crecieron los actuales continentes.
−2900 Ma: crisis del nitrógeno, glaciación de Pongola y nitrogenasa
El oxígeno producido reacciona inmediatamente con estos compuestos reductores, lo que captura el oxígeno y limita las posibilidades de vida a la proliferación de solo organismos anaeróbicos.
El primero afectado es el ciclo del nitrógeno. En el océano primitivo, el amoníaco era estable y servía como fuente de nitrógeno para la biosfera. Mientras el ambiente oceánico sea un ambiente reductor rico en amoníaco, el oxígeno no puede escapar a la atmósfera, pero oxida ese amoníaco, liberando el nitrógeno en forma de dinitrógeno. La reacción es globalmente:
4 NH
3 + 3 O
2 → 2 N
2 ↑ + 6 H
2O
Este amoníaco es un sumidero que consume el oxígeno disuelto en el océano primitivo,[90][119] pero a la inversa, esa neutralización es un sumidero para el nitrógeno disponible, ya que transfiere gradualmente el nitrógeno, acumulado en el océano en forma de amoníaco, a su forma inerte de dinitrógeno que se acumula en la atmósfera. Por tanto, la producción de oxígeno habría provocado una escasez de nitrógeno biológicamente asimilable.
El equilibrio en el océano, entre el nitrógeno fijado en la biomasa y el liberado en forma de NH4+
por los residuos orgánicos, se desplaza hacia menos nitrógeno disponible y, por tanto, menos biomasa. Esa asfixia progresiva desencadena una gran crisis ecológica. En ausencia de amoníaco disuelto, la biomasa solo se equilibra con el flujo de NH
3 procedente de las dorsales oceánicas (y la producción resultante de una fijación primitiva por la biomasa). Inversamente, esa reducción de la biomasa limita en consecuencia directamente el flujo de oxígeno, falto de biomasa para producirlo. Se establece en esta etapa la retroalimentación entre el ciclo del oxígeno y el ciclo del nitrógeno, equilibrándose finalmente la producción de oxígeno con la necesaria para consumir la del nitrógeno producido, haciendo desaparecer el oxígeno producido.
La limitación es tanto más severa cuanto que el flujo de las dorsales es consumido principalmente en el sitio por organismos que metabolizan el hidrógeno, mientras que la producción de oxígeno tiene lugar en la superficie, donde se reduce la concentración de NH
3. Por tanto, la biosfera pierde una parte sustancial de su capacidad para producir metano NH
4. Esta crisis puede haber estado en el origen de la glaciación de Pongola: la insuficiente producción de metano ya no le permite desempeñar su papel de «termostato»; entraña una disminución del efecto invernadero y una caída de las temperaturas medias del globo.

Por lo tanto, el entorno oceánico arcaico debe haber ejercido una presión de selección muy fuerte sobre los organismos fotosintéticos en relación con la dependencia del amoníaco. Como resultado, la capacidad de catalizar la reducción del N
2 en NH
3 ha constituido una ventaja adaptativa, empujando hacia el surgimiento de una nitrogenasa cada vez más eficiente, y la ventaja selectiva que brinda un metabolismo autótrofo capaz de transformar el nitrógeno N
2 en amoniaco asimilable, realizando la fijación biológica del nitrógeno, fue en una primera etapa inmediata, ya que un tal organismo podía propagarse sin estar vinculado a una fuente de amoníaco.[90]
El análisis de los sedimentos y de su enriquecimiento en nitrógeno 15
N, en comparación con su versión actual de 14
N, sugiere que se produjo un ciclo metabólico de fijación de nitrógeno entre 3,2 y 2,5 Ga.[99]
Con la aparición de bacterias fijadoras de nitrógeno, se estableció un equilibrio en los océanos entre las concentraciones de nitrógeno y fosfato asimilable, la relación [NO2−
]:[PO3−
4] se establece en aproximadamente 15:1, es decir, aproximadamente la estequiometría correspondiente a las partículas de materia orgánica en descomposición en la columna de agua[120] (véase el Informe Redfield). Esta estabilización proviene de la competencia entre las bacterias fijadoras de nitrógeno y las otras formas de la biosfera, y resulta del alto costo metabólico de esta fijación: cuando aumenta el nitrógeno disponible, las bacterias fijadoras de nitrógeno se ven perjudicadas por su alto costo metabólico, lo que hace que su biomasa disminuya y, por lo tanto, la fijación de nitrógeno; a la inversa, cuando el nitrógeno está menos disponible que el fosfato, las bacterias fijadoras de nitrógeno pueden utilizar el fosfato de manera más eficiente, aumentando su biomasa y aumentando la fijación de nitrógeno y luego la disponibilidad de nitrógeno en las partículas en descomposición.[120] Globalmente, el equilibrio se establece en torno a la estequiometría de la materia orgánica, con un ligero déficit relativo en NO3−
compensando el handicap metabólico de las bacterias fijadoras de nitrógeno.[120]
Lenta agonía del Proterozoico

La desgasificación del oxígeno era entonces un desperdicio del ciclo, un veneno para los organismos anaeróbicos.[121] Pero la producción de O
2 en el océano no significaba que su contenido estuviera aumentando, porque el oxígeno es un elemento muy reactivo; en el ambiente reductor donde es emitido, muchos «sumideros» son capaces de hacer que reaccione y desaparezca: en solución, el amoniaco, el hierro, los sulfuros. Durante más de mil millones de años, el oxígeno liberado por esas actividades fotosintéticas es consumido por «sumideros de oxígeno», esencialmente la oxidación de sustancias reductoras contenidas en las aguas marinas (hierro y otros metales, materia orgánica) y en la superficie de las tierras emergidas, y el del metano atmosférico.[122]
Puede parecer paradójico que la aparición de oxígeno en la atmósfera, la Gran Oxidación, que se ha datado en −2400 Ma, no haya ocurrido hasta casi mil millones de años después del inicio de la fotosíntesis oxigénica.[87] Es que en realidad, el oxígeno fue un oxidante formidable para la ecología del Proterozoico, que provocó una modificación sustancial de la biosfera tal como existía en ese momento:[123]
- esta se redujo primero por inanición, por la supresión del nitrógeno fijado en forma de amoníaco, el punto de entrada del ciclo del nitrógeno biológico;
- cuando ese obstáculo pudo superarse mediante la fijación biológica del nitrógeno, la producción redujo drásticamente la biodisponibilidad del hierro, indispensable para las enzimas fijadoras del nitrógeno o la fotosíntesis, reduciendo una vez más la biomasa;
- la biosfera fue entonces masivamente intoxicada, siendo el oxígeno disuelto un veneno para el metabolismo metanogénico de esa época, en particular para el funcionamiento de la nitrogenasa previamente desarrollada;
- cuando después de mil millones de años de sobrevivir a esa intoxicación crónica, esos dos obstáculos fueron superados, con la fotosíntesis doblada de la respiración aeróbica, la biosfera pudo desarrollarse hasta un punto que permitió la Gran Oxidación, suprimiendo, desafortunadamente, el efecto de invernadero protector y provocando una tercera catástrofe en la forma de la Gran Glaciación, durante la cual la actividad biológica fue prácticamente aniquilada.
Es necesario para empezar que la producción de oxígeno sea mayor que la producción de los elementos reducidos por las dorsales oceánicas. Más allá de eso, el carbono reducido que constituye la materia orgánica es en sí mismo un «sumidero». Ya sea por respiración aeróbica o por oxidación de materia muerta, la reoxidación de la materia orgánica invierte el proceso de fotosíntesis, consumiendo el oxígeno para transformar el carbono reducido en dióxido de carbono. Solo puede haber una acumulación significativa de oxígeno en la atmósfera si se entierra una cantidad equivalente de carbono para eliminarlo de la oxidación.[98]
Proterozoico (de −2500 a −500 Ma)
| Supereón | Eón[124] | Inicio en Millones años |
|---|---|---|
| Fanerozoico | 542,0 ±1,0 | |
| Precámbrico | Proterozoico | 2500 |
| Arcaico | 4000 | |
| Hádico | ca. 4570 |
−2500 Ma: precipitación del hierro

La aparición de nitrogenasa permitió la fijación biológica de nitrógeno y la producción de oxígeno a niveles más elevados.
Sin embargo, la producción neta de oxígeno no era posible más que si se capturaba materia orgánica en la litosfera. De hecho, en presencia de oxígeno, la materia orgánica (denominada genéricamente C(H
2O) es en sí misma un sumidero de oxígeno cuando se oxida liberando dióxido de carbono:[93]
C(H
2O) + O
2 → CO
2 ↑ + H
2O
Otro sumidero de oxígeno es el consumo de la pirita FeS
2, formada por la reacción global:[128]
2 Fe
2O
3 + 8 SO2−
4 + 16 H+
↔ 15 O
2 + 4 FeS
2 + 8 H
2O
Esta reacción global es la superposición de tres procesos, que son la fotosíntesis anoxigénica que produce la materia orgánica, la reducción anóxica de sulfatos en H2S utilizando esta materia orgánica como agente reductor y la precipitación de pirita por reacción de H
2S sobre el Fe
2O
3.
En segundo lugar, el oxígeno reacciona principalmente con los metales como el hierro ferroso, para precipitarse en hematita y magnetita. La producción anaeróbica produce oxígeno y esta producción destruye la producción anaeróbica. Sigue un ciclo de inestabilidad: la muerte de organismos anaeróbicos consume y fija el O
2 y reduciendo su contenido, volviendo anóxicas y desertificadas las cuencas y mesetas continentales. Durante un evento anóxico oceánico, los organismos muertos quedan enterrados y el carbono correspondiente se transfiere a la litosfera, junto con los oligoelementos asociados. Pero la erosión aporta nuevos oligoelementos, la desaparición del veneno permite que los organismos anaeróbicos proliferen nuevamente, desencadenando las condiciones para su nueva desaparición. Esta inestabilidad se refleja en los yacimientos por depósitos de hierro bandeado, alternativamente negras y rojas. El oxígeno producido fue así absorbido en gran parte por minerales y secuestrado en el suelo. Estas precipitaciones, que reflejan aquí ráfagas de producción de oxígeno, alternando con depósitos de esquistos arcillosos y carbonatos silíceos depositados en condiciones más anóxicas, que son a su vez de color rojizo. Este es el origen de los grandes yacimientos de hierro bandeados.
Como resultado, el oxígeno libre no existía en la atmósfera hasta hace unos 2400 Ma, cuando, en el Paleoproterozoico, la mayor parte de estas formas reducidas del hierro fiueron oxidadas.
Crisis del hierro y catástrofe del oxígeno
El hierro biológicamente fijado es un componente esencial para la fotosíntesis: el fotosistema I contiene doce átomos de hierro. Además, es un componente esencial para la formación de la nitrogenasa y, por tanto, para la fijación biológica del nitrógeno.[129] Pero este hierro solo está disponible biológicamente cuando está en solución. Con la precipitación de compuestos ferrosos, la disponibilidad de hierro se convirtió en un factor limitante de la biosfera.[129]
El equilibrio químico de la disolución del hierro se desplazó como resultado del descenso de la concentración del hierro; y el aumento concomitante de la concentración de O
2 en el océano, como resultado de la fotosíntesis, gradualmente lo convirtió en un medio oxidante, mientras que había sido inicialmente reductor.
Cuando, en el Paleoproterozoico, la mayoría de las formas reducidas de hierro se oxidaron, la sedimentación de los yacimientos de hierro en bandas se hizo escasa y el contenido en O
2 luego aumentó en los océanos primero, luego en la atmósfera, para resultar altamente tóxico para los organismos anaeróbicos: esta es la «catástrofe del oxígeno». De hecho, el oxígeno era tóxico para los organismos anaeróbicos de la época, la biomasa fue envenenada con sus propios desechos y se colapsó una vez más. Al acumularse, el oxígeno provocará la muerte de las arqueas metanogénicas, para las que era un veneno,[69] deteniendo prácticamente la producción de metano.
La transición solo terminó con la aparición de células capaces de vivir en un ambiente oxigenado. Aparecen entonces, en el plano geológio, depósitos rojos, marcados de hierro férrico, y las rocas sedimentarias cambian de un color predominantemente negro al rojo.
Respiración aeróbica
Además, el oxígeno es una fuente de energía extremadamente eficiente, mucho más que la fermentación, que abrió el camino a nuevos desarrollos. La vida se vuelve más compleja. Algunas bacterias aprenden a utilizar el oxígeno: es el inicio de la respiración.
Las propias cianobacterias se adaptaron a un entorno que contiene este oxígeno que ellas producen. El oxígeno, al ser particularmente reactivo, permite un catabolismo mucho más eficiente que con la respiración anaeróbica.
Parece que la capacidad de utilización del oxígeno en la respiración aeróbica, lo que implica una enzima oxígeno-reductasa, puede haber sido objeto de transferencia horizontal de genes entre los grupos de bacterias. La transferencia horizontal de genes también parece estar muy extendida entre las arqueas.[130]
Debido a una transferencia horizontal de genes que siempre es posible, se debe ser cauteloso con los análisis de deriva genética o de clasificación filogenética que sitúen la aparición de tal capacidad en tal grupo o en tal fecha.
Aunque todos los metabolismos hacen uso del oxígeno de una forma u otra, algunos de sus compuestos que aparecen en los ciclos metabólicos pueden ser tóxicos. El dioxígeno O
2 es paramagnético y tiene dos electrones de espín paralelo. En la respiración aeróbica, esto dificulta la reacción con el O
2, porque el donante de electrones debe poder invertir el spin antes de poder donar un electrón. Para contornear el problema, el oxígeno se combina con un metal paramagnético (por ejemplo, cobre o hierro) o recibe electrones adicionales. Por tanto, la reducción de O
2 en H
2O pasa por superóxidos como O2−
, el peróxido de hidrógeno H
2O
2, o el radical hidroxilo (OH). Estos radicales libres representan una amenaza potencial para el equilibrio celular.[131]
Multicelularidad de las cianobacterias

El análisis de las derivaciones genéticas de las cianobacterias muestra que la multicelularidad evolucionó poco antes de la gran oxidación.[132][133]
Inicialmente, el hecho de que las células se peguen entre sí es constituye desventaja, porque la vecindad de otra célula está necesariamente menos cargada de nutrientes y más cargada de desechos que un área menos poblada. Pero esta desventaja nutricional se compensa en gran medida en presencia de depredadores capaces de capturar y digerir bacterias libres mediante fagocitosis. En ese contexto, la multicelularidad es una ventaja selectiva, porque el grupo multicelular se vuelve demasiado grande para ser capturado.
Esta producción de oxígeno tendrá un impacto decisivo en la evolución del planeta.
El oxígeno de las bacterias se produjo en cantidades tales que los océanos quedaron saturados de él. El oxígeno se escapó a la atmósfera, convirtiéndose en uno de sus componentes. A esto se le llama la Gran Oxidación.
−2400 Ma: Gran oxidación


La producción de dioxígeno atmosférico comenzó con la aparición de la fotosíntesis en las cianobacterias, desde −3500 Ma. Pero mecanismos diversos de oxidación llevaron a capturar el O
2 sin que realmente pueda acumularse en la capa superior del océano, ni en la atmósfera. El oxígeno fue en inicio consumido por sus reacciones sobre elementos reductores del océano: oxidación del NH
4 luego del Fe2+
, limitando sus liberaciones a la atmósfera. Mientras el nivel de oxígeno que sale de las aguas de superficie se mantiene bajo, es consumido por el metano presente en la atmósfera, cuyo nivel está regulado principalmente por el equilibrio que el crea entre el efecto invernadero y la producción de bacterias metanogénicas.
Pero a partir del momento en el que el océano reductor ha sido suficientemente oxidado, el flujo de oxígeno hacia la atmósfera aumentó drásticamente.
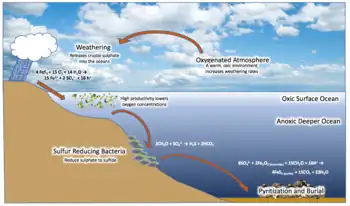
Tan pronto como el flujo de salida se hace más débil que el de la captura del O
2 por el CH
4, la concentración de O
2 se vuelve significativa en la atmósfera y puede comenzar a formar una capa de ozono. La formación de esta capa tuvo un efecto de bola de nieve, porque el bloqueo de la radiación ultravioleta por la alta atmósfera disminuyó la disociación del metano presente y, por tanto, inhibió su captura por el oxígeno, que puede fortalecer aún más la capa de ozono.[134]
La existencia de esta oxigenación se puede leer en la separación isotópica de los sulfuros, lo que permite mostrar que hasta −2450 Ma el nivel de oxígeno era como máximo una cien milésima parte de la actual, mientras que se elevó al 1 al 10% del nivel presente a partir de −2330 Ma.[134] También se ve una disminución en ese momento en las arenas sedimentarias de los yacimientos de minerales sensibles al oxígeno como la uranita, la pirita o la siderita.[97] A medida que aumenta el contenido de oxígeno, el metano permanece inicialmente presente y continúa desempeñando su papel en el efecto invernadero, pero el oxígeno producido también se acumula en la capa superior del océano. Esto resultará, −2400 Ma, en una crisis ecológica llamada la «Gran Oxidación». El modelo oceánico de Canfield, sin embargo, considera que el agua en los fondos marinos profundos permaneció anóxica mucho después de la Gran Oxigenación.
En un primer momento oxida las sustancias reducidas que pueden estar presentes en la atmósfera, las aguas de superficie o los suelos alterados.[135] El oxígeno reaccionó con las grandes superficies oxidables presentes en la superficie de la Tierra (principalmente el hierro ).
El nivel de oxígeno parece haber alcanzado inicialmente niveles altos durante el «evento de Lomagundi», que registró un exceso de 13C en depósitos de 2200 a 2300 Ma.[89] El origen puede ser que el oxígeno emitido por las cianobacterias permitió oxidar más completamente los depósitos de materia orgánica, liberando así al nitrógeno fijado contenido. Ese suministro de nitrógeno podría, a su vez, conducir a una proliferación adicional de cianobacterias, provocando una bola de nieve.[89] Fue solo después de haber agotado esos recursos fósiles cuando el nitrógeno volvió a convertirse en un factor limitante, y que la biomasa de cianobacterias se fue reduciendo lentamente, bajo el efecto de la desnitrificación progresiva en el ambiente anaeróbico, y de la oxidación directa del amoníaco por el oxígeno. Con esta asfixia de las cianobacterias, el oxígeno ya no se producía en cantidades significativas y luego se eliminaba lentamente con la oxidación de la superficie terrestre y de los gases volcánicos, hasta un nivel que permitía restaurar el funcionamiento de la nitrogenasa, devolviendo a la nitrogenasa su ventaja selectiva.
El oxígeno permaneció entonces en un nivel limitado, del orden del 2 al 10% de la concentración actual.[136] La nitrogenasa, que cataliza la secuencia completa de las reacciones en las que la reducción de dinitrógeno N
2 conduce a la formación de amoniaco NH
3, es una proteína de hierro-azufre que es oxidada e inactivada irreversiblemente por el dioxígeno (O
2).[136][119][89] Como resultado, el flujo de oxígeno generado por la fotosíntesis está limitado por la capacidad de oxidación de los suelos: si la biosfera produce demasiado oxígeno, destruye demasiado rápidamente la nitrogenasa, reduciendo la biodisponibilidad del nitrógeno y por lo tanto reduciendo la expansión de la biosfera misma.
−2400 a −2100 Ma: gran glaciación


El metano desapareció gradualmente de la atmósfera, el potencial reductor del hidrógeno hizo que reaccionase con el oxígeno recién formado para formar dióxido de carbono y agua. Pero el metano es un gas de efecto invernadero mucho más potente que el dióxido de carbono.[87] Esa sustitución provocó una fuerte disminución de la temperatura del globo, agravada por el hecho de que el Sol, aún en su primera juventud, todavía emitía solo el 85% de su potencia actual.[31] Siguió un episodio de glaciación global, la glaciación Huroniana. El poder reflectante de la tierra, el albedo, valorado actualmente en 0,3, cambió a valores mucho más altos, de 0,6 a 0,8, cuando el planeta tomó la forma de una «tierra de bola de nieve». Ese aumento del albedo con la aparición de los primeros casquetes polares reforzó aún más la glaciación, que acaba extendiéndose de forma duradera por todo el planeta.[69]
Bajo el efecto de la glaciación global, la alteración de las rocas por el ácido carbónico ya no puede tener lugar, y el ciclo del carbono químico se fija, cesando de consumir dióxido de carbono de la atmósfera.
Los indicadores muestran que la biosfera quedó prácticamente aniquilada durante ese período. El análisis isotópico del fraccionamiento entre el C
12 y el C
13 refleja la actividad de la biosfera, porque las velocidades de reacción del metabolismo celular son ligeramente diferentes según el isótopo en cuestión, lo que lleva al fraccionamiento del carbono al entrar en la biosfera. Sin embargo, para esos períodos, ese fraccionamiento ya no se observa, la tasa del el C
13 sigue siendo idéntica a la de la fuente volcánica, lo que muestra para ese tiempo una cuasi-desaparición de la biosfera.[69] El mismo fenómeno de fraccionamiento del azufre se observa en los yacimientos de sulfuros.[137]
La biosfera ya no produce metano y el metano atmosférico residual sigue escapándose, lo que acentúa la glaciación. Sin embargo, por encima, el dióxido de carbono sigue produciéndose en pequeñas cantidades por el volcanismo y se acumula muy gradualmente en la atmósfera. Después de 300 Ma, en el Riásico, el efecto invernadero se vuelve suficiente para desencadenar un calentamiento que hizo derretirse al hielo. La pérdida resultante de albedo aceleró el proceso, y la Tierra pasó abruptamente de una glaciación completa a un clima tropical generalizado en el Orosírico.[31]
Termostato continental

2 en exceso. CO
2.
Al final de esta gran glaciación Huroniana, el retroceso de los glaciares dejó expuestos los continentes desnudos y desencadenó una erosión masiva, que disolvió los silicatos, absorbio el CO
2.en exceso, y lo hizo precipitar en los océanos en forma de silicatos. Esta eliminación del CO
2 atenúa el fuerte efecto invernadero que había permitido salir de la glaciación y permitió el retorno a temperaturas más moderadas.
De una manera general, a lo largo del tiempo, el contenido de CO
2 de la atmósfera, y a partir de ahí la temperatura y el pH del océano, fueron controlados por el ciclo del carbono mineral, por un «termostato» que tomará cada vez más importancia con el crecimiento de los continentes. El contenido de dióxido de carbono de la atmósfera estará regulado por la capacidad de las superficies continentales de consumir ese CO
2, siendo menor el contenido de equilibrio cuanto mayor es la superficie de la corteza continental expuesta.
- Si el contenido de CO
2 aumenta más allá de su valor de equilibrio, el efecto invernadero aumenta, lo que hace que aumente la temperatura media del globo. - En la corteza continental, las altas temperaturas atmosféricas provocan una erosión acelerada de los silicatos, lo que resulta en la captura de CO
2.en exceso.[93][117] - Por otro lado, en el océano, el calentamiento global conduce a mares cálidos, donde precipitan los carbonatos, acelerando el ciclo del carbono químico.[69]
Esta regulación es más aleatoria que la resultante de la emisión de metano, porque el equilibrio resultante del total de las superficies continentales depende de la ordenación geográfica efectiva de los diferentes cratones de la corteza continental:
- Cuando los cratones forman un solo supercontinente, la erosión efectiva solo afecta el margen del mismo, y no al centro generalmente desértico. Las superficies así neutralizadas no pueden participar en la erosión, lo que generalmente conduce a un aumento de las temperaturas en comparación con el equilibrio teórico.
- Cuando una parte de la corteza continental está cubierta por capas de hielo bajo el efecto de la glaciación o de la latitud polar, su oxidación se neutraliza de facto, reduciendo localmente el efecto de la erosión. Sin embargo, la formación de un inlandsis hace bajar el nivel del océano, descubriendo además más superficie ofrecidas a la erosión, si los elementos de la corteza continental permanecen en latitudes suaves. El efecto puede ser positivo o negativo según la geografía real del momento.
- Cuando un supercontinente se desintegra, las superficies previamente desérticas contribuyen nuevamente a la regulación, lo que, en igualdad de condiciones, conduce a una caída de las temperaturas. Esta caída puede atenuarse aún más a medida que toda o parte de la corteza continental migra a latitudes altas y luego se cubre con un inlandsis: la temperatura es regulada por la formación de ese inlandsis: bloquea la erosión, lo que bloquea la captura de CO
2, limitando así la pérdida de efecto invernadero y la caída de la temperatura global.
Nivel cero de los mares
Otro aspecto de la erosión era que tendía a reducir la corteza continental al nivel cero marcado por el océano mundial: todo lo que se elevaba sobre ese nivel del mar tendía a ser erosionado y los aluviones correspondientes se depositaban en el medio marino, lo que contribuyó a la formación de depósitos sedimentarios. Inversamente, y sin considerar los depósitos sobre la corteza oceánica profunda, cualquier cosa por debajo del nivel medio del mar tendía a engrosarse progresivamente por los depósitos sedimentarios, lo que hacía que aumentase de altitud.
Globalmente, solo se alcanzaba un equilibrio (y un no-cambio de los perfiles) cuando el espesor de la corteza continental era tal que compensaba, por el volumen ocupado, la pérdida de superficie que sufría el océano global, debido a la acumulación de los cratones. El equilibrio global de la época, entre depósito y erosión, se alcanzaba cuando en la corteza continental, la parte emergida era (aproximadamente) equivalente a la parte sumergida, con las orogénesis en curso cercanas.
Con la acumulación progresiva de los cratones sobre las masas continentales cada vez más importantes, se asistira en paralelo, en promedio, a una profundización gradual de los océanos. Además, habrá un equilibrio global entre la superficie de la plataforma continental y la de la corteza continental expuesta a la erosión.
Esta lógica continúa en la actualidad: ahora se está al final de la glaciación, el nivel del mar está por debajo de su equilibrio y el ascenso natural de las aguas oceánicas cubrirá muchas superficies consideradas geológicamente como «llanuras oceánicas».
−2200 a −1600 Ma: primeros ensayos multicelulares y el supercontinente Columbia




Hace 2200 Ma, el aumento de δ13Corg en los carbonatos se explica por una mayor fosilización de la materia orgánica, en particular en los estromatolitos, estructuras de carbonato de calcio probablemente construidas por las cianobacterias. La actividad fotosintética tuvo el efecto de enriquecer la atmósfera en dioxígeno.

El grupo fósil de Franceville, fechado en −2100 Ma, muestra una vida multicelular compleja y organizada al comienzo del Orosírico.[138] Esta aparición no tuvo éxito, posiblemente debido a los impactos de Vredefort (−2020 Ma) y de Sudbury (1849 Ma), y de la subsecuente caída en los niveles de oxígeno. De todos los cráteres de impacto identificados, esos dos impactos son de hecho los más importantes, claramente superiores al de Chicxulub, que se cree que puso fin al reinado de los dinosaurios. Los impactos de ese nivel expulsan polvo y cenizas, provocando un invernio de impacto duradero, y la caída de la fotosíntesis por falta de luminosidad. Las formas de vida complejas, que dependían de la respiración aeróbica, no habrían podido sobrevivido a estas catástrofes.
Columbia fue uno de los primeros supercontinentes que se formó durante un período de colisión y de orogenia a gran escala que se extiende desde −2200 a 1800 Ma, durante la era Paleoproterozoico. A partir de −1800 Ma, los paleosuelos se enriquecieron en hierro. La presión parcial de dioxígeno es del orden del 15% de la actual. Tras su ensamblaje final, en el Estatérico, el continente experimentó un crecimiento duradero (1800 a 1300 Ma) con zonas de subducción al nivel de los márgenes continentales principales,[139] en el origen de un amplio cinturón de acreción magmático.
La fragmentación de Columbia comenzó alrededor de unos 1600 Ma, al comienzo del Calímmico, y continuó hasta la desaparición del continente, entre 1300 y 1200 Ma, al final del Ectásico.
Eucariotas y reproducción sexual
.svg.png.webp)

Los dominios de proteínas específicamente asociados con los eucariotas se fechan en −1500 Ma, sensiblemente la fecha de aparición de las proteínas específicas de las cápsides de los virus (−1600 Ma)[140] lo que sugiere un evento desencadenante común en la ecología bacteriana.
El microfósil más antiguo e indiscutiblemente eucariota está fechado en −1450 Ma.[141]
Alrededor de −1200 Ma, la presencia de los eucariotas, las algas rojas Bangiomorpha pubescens, está atestiguada por los microfósiles de la formación de Hunting, en la isla Somerset, Canadá. Es el organismo multicelular complejo más antiguo conocido, capaz de reproducirse sexualmente.[142] La multicelularidad compleja es diferente de la multicelularidad simple, la de las colonias de organismos que viven juntos. Los verdaderos organismos multicelulares presentan células especializadas en diferentes funciones. Esta es una característica esencial de la reproducción sexual, porque los gametos masculinos y femeninos son ellos mismos células especializadas. Los organismos que se reproducen sexualmente deben poder engendrar un organismo completo a partir de una sola célula germinal.
La estructura de los eucariotas permite, por ejemplo, varios movimientos de evitación.[143][144]
Endosimbiosis y los tres dominios de la vida

La moderna Taxonomía clasifica la vida en tres dominios. El momento del origen de estos dominios es teórico. El dominio Bacteria fue probablemente el primero que se separó de las otras formas de vida (que a veces se agrupan en Neomura), pero esta suposición es controvertida. Después de esto, hace 2000 Ma,[145] Neomura se dividió dando lugar a los otros dos dominios, Archaea (arqueas) y Eukaryota (eucariotas). Las células eucarióticas son más grandes y más complejas que las procarióticas (bacterias y arqueas), y el origen de su complejidad solo ahora está saliendo a la luz.
Sobre este período una pequeña proteobacteria alfa relacionada con las actuales Rickettsia[146] se introdujo en una célula procariota más grande. Tal vez fue un intento de ingestión por parte de la célula grande que falló (debido a la evolución de las defensas de la pequeña proteobacteria). Quizás la célula más pequeña trató de parasitar a la más grande. En cualquier caso, las células más pequeñas sobrevivieron en el interior de las más grandes. El uso del oxígeno, permitió metabolizar los desechos de las células más grandes y así obtener más energía. Parte de este excedente de energía fue devuelto a la reserva. Las células más pequeñas se reproducían en el interior de la más grande, y al poco tiempo dio lugar una relación simbiótica estable.
Con el tiempo la célula más grande adquirió algunos de los genes de las células más pequeñas, y los dos tipos llegaron a ser uno dependiente del otro: las células más grandes no podrían sobrevivir sin la energía producida por las más pequeñas, y estas, a su vez, no podrían prosperar sin la materia prima proporcionadas por las células mayores. La simbiosis que se consiguió, entre las células más grandes y el grupo de células más pequeñas que estaban en su interior, fue tal que se considera que se han convertido en un solo organismo. Las células más pequeñas están clasificadas como orgánulos llamados mitocondrias.
Algo parecido pasó con la fotosíntesis de las cianobacterias.[147] Entrando en las células heterótrofas más grandes y llegando a ser cloroplastos.[148],[149] Probablemente como resultado de estos cambios, un grupo de células capaces de realizar la fotosíntesis se separó de las demás eucariotas hará unos 1000 Ma. Había probablemente tal inclusión de eventos, como la figura de la izquierda indica. Además de la teoría endosimbiótica del origen celular de las mitocondrias y cloroplastos, se ha sugerido que las células que dieron lugar a las peroxisomas y spirochaetes también dieron lugar a los cilios y flagelos, y quizás a un virus ADN, además de dar lugar al núcleo celular,[150][151] aunque ninguna de estas teorías es generalmente aceptada.[152] Durante este período, se cree que ha existido un supercontinente llamado Columbia, probablemente, hace alrededor de 1800 a 1500 Ma; y que es el supercontinente más antiguo.[153]
Organismos pluricelulares

Las archaeas, bacterias y eucariotas continuaron dispersándose y llegando a ser más complejas y mejor adaptadas a su medio ambiente. Cada dominio continuamente se distribuía en múltiples linajes, aunque se sabe poco sobre la historia de las bacterias y archaeas. Hace alrededor de 1100 Ma, se formó el supercontinente Rodinia.[154] Estas células se diversificaron en las líneas de los tres reinos (plantae, animalia, y fungi), a pesar de que aún existen células solitarias. Algunas vivían en colonias, y gradualmente se produjo la división del trabajo: por ejemplo, las células de la periferia podrían haber comenzado a asumir funciones diferentes a las de las existentes en el interior. Aunque la división entre una colonia de células especializadas y un organismo pluricelular no siempre es clara, hace alrededor de 1000 Ma.[155]
Las primeras plantas pluricelulares surgieron, probablemente, de las algas verdes.[156] Probablemente hace unos 900 Ma,[157] el verdadero pluricelular también habría evolucionado a animales. Al principio, probablemente, algo semejante a la actual esponja, en el que todas las células eran totipotentes y un organismo mutilado podría regenerarse.[158] Como la división del trabajo se volvió más completa en todos los sentidos en los organismos pluricelulares, las células se volvieron más especializadas y más dependientes de las demás; las células aisladas morirían. Hay indicios de que una glaciación muy severa comenzó hace alrededor de 770 Ma, de tal gravedad que la superficie de todos los océanos se congeló por completo (la glaciación global). Finalmente, 20 Ma después, cuando una cantidad suficiente de dióxido de carbono volcánico llegó a la atmósfera, se produjo el consiguiente efecto invernadero, subiendo la temperatura global del planeta.[159] Por la misma época, hace unos 750 Ma,[160] Rodinia comenzó a fracturarse.
−1100 a −750 Ma: supercontinente Rodinia


El supercontinente Rodinia comenzó a formarse al comienzo del Esténico, en −1100 Ma. Hace 750 Ma, hacia el final del período Tónico, se escindió en ocho continentes y su deriva provocará su dislocación.
Los microfósiles del Tónico testimonian la primera radiación evolutiva de los Acritarcos.
La ruptura de este continente estaría en el origen del periodo glacial del Criogénico y de la rápida evolución de la vida en el Ediacárico y el Cámbrico.
Los cráteres mayores muy antiguos son difíciles de abordar en la Tierra, porque la erosión y la tectónica de placas difuminan y borran cualquier rastro que puedan haber dejado; pero el estudio de los cráteres lunares y su datación permite reconstituir una lluvia de asteroides que ocurrió en el sistema Tierra-Luna alrededor de −800 Ma, que en la Tierra marca la entrada al Criogenio.[161] Extrapolar a la Tierra el flujo de asteroides registrado en la Luna daría una serie de impactos que aportarían colectivamente el equivalente a un asteroide de 30 a 40 km de diámetro.[161] Además de la posibilidad de un invierno de impacto y de una perturbación importante de la composición y de la temperatura de los océanos, este impacto podría haber tenido una influencia significativa en el ciclo del fósforo. El contenido de fósforo de los depósitos a este fin del período Tónico es de hecho cuatro veces mayor que el de los depósitos anteriores; y la contribución de tal volumen en forma de Condrita CI, donde el fósforo está presente a una tasa del orden del 1 ‰, habría entrañado un aporte de un orden de magnitud mayor que el contenido actual de los océanos.[161]
−720 a −635 Ma: Tierra bola de nieve

Al final del Proterozoico, hace 800 Ma, el supercontinente Rodinia, que en ese momento estaba centrado en el ecuador y se extendía de los 60° de latitud norte a los 60° de latitud sur, comenzó a dislocarse, bajo el efecto de los puntos calientes. Este evento estuvo acompañado por la apertura de océanos y de brazos de mar que permitieron que las lluvias llegaran a todas las masas continentales. El CO
2 atmosférico, presente en las lluvias en forma de ácido carbónico, reanudó su labor de erosión, solubilizando las rocas en forma de bicarbonatos, luego precipitándose en el océano, atrapados en los sedimentos en forma de carbonatos. Por otro lado, los enormes flujos de lava asociados con la fractura de Rodinia formaron grandes superficies basálticas en la superficie de los continentes. Sin embargo, esas superficies, alteradas por el efecto de la humedad, consumieron ocho veces más carbono que una misma superficie granitica.
Estas circunstancias entrañaron una disminución significativa del nivel de dióxido de carbono en la atmósfera, reduciendo el efecto invernadero del dióxido de carbono y provocando que las temperaturas bajasen. Además, el Sol era más joven y emitía un 6% menos de calor.
En general, cuando la Tierra se enfría, el enfriamiento ralentiza esas reacciones de meteorización. Pero en el Criogénico, los continentes estaban en latitudes tropicales, lo que hizo que esa regulación fuera menos efectiva, continuando la erosión en niveles altos incluso en una Tierra más fría. Todos estos factores podrían haber llevado a un periodo glaciar particularmente intenso que cubrió la superficie terrestre con glaciares hasta las latitudes 30°. Una vez que se hubieron alcanzado esos límites, el albedo global era tal que se estableció un bucle de autoamplificación que permitió que todo el planeta se cubriese de hielo. El inicio de la glaciación está marcado por una fuerte caída en el valor δ13Corg en los sedimentos, lo que se puede atribuir a la caída de la productividad biológica, debido a las bajas temperaturas y a los océanos cubiertos de hielo.
En el escenario anterior de la gran glaciación Huroniana, el «termostato», inicialmente proporcionado principalmente por el metano, había desaparecido por completo, y la glaciación había durado tanto que la acumulación del CO
2 atmosférico no permitió lograr un efecto invernadero suficiente. Aquí, por el contrario, el «termostato» terrestre fue desde el principio proporcionado por el dióxido de carbono, cuyo nivel inicial parte del que permite el inicio de la glaciación. La reconstrucción por las emisiones volcánicas del nivel del CO
2 necesario para salir de la glaciación fue, por tanto, más rápida.
Al final de un periodo glaciar, el bucle de retroalimentación positiva pudo hacer derretir el hielo en muy poco tiempo a escala geológica, quizás en menos de 1000 años. Al final de la glaciación, los glaciares que se derritieron liberaron grandes cantidades de depósitos glaciares. Los sedimentos resultantes suministrados al océano serían ricos en elementos nutrientes, como el fósforo, que, junto con la abundancia del CO
2, desencadenaría una explosión demográfica de cianobacterias, que conduciría a una reoxigenación acelerada de la atmósfera. Pero la reposición del oxígeno atmosférico y el agotamiento del CO
2 en exceso pudo llevar decenas o centenas de miles de años.
Esta eliminación del CO
2 podría dar lugar a nuevos episodios glaciares, siempre que las superficies basálticas no se alterasen lo suficiente. El final del Neoproterozoico está así marcado por tres (¿o cuatro?) glaciaciones de amplitud decreciente.
Se produjo un estallido de oxigenación entre −800 Ma y −650 Ma, la oxigenación del Neoproterozoico (Neoproterozoic Oxyenation Event, o NOE).[99] Los océanos dejaron de ser anóxicos para enriquecerse en sulfatos. Esta oxigenación puede haber contribuido a la aparición de la fauna de la Ediacara, una concentración mayor del oxígeno que permitió el desarrollo de las grandes formas de vida multicelulares.
−600 a −540 Ma: supercontinente Pannotia y fauna de la Ediacara


Pannotia fue un antiguo supercontinente que habría existido al final del Precámbrico, de −650 a −540 Ma aproximadamente y a comienzos del Cámbrico.[163] Este hipotético supercontinente encaja en el modelo de los ciclos de Wilson lo que explicaría la periodicidad de los episodios de formación de las cadenas montañosas, las orogénesis. Se formó como resultado de varias colisiones, durante la orogenia panafricana,[164] de la que la orogenia brasileña, en América del Sur, y la orogenia cadomiana, en América del Norte y en Europa occidental, fueron fases locales.[165]
La fauna marina ediacarana, de 600 Ma de antigüedad, es evidencia de la existencia de este supercontinente. Se han encontrado fósiles de esta fauna en regiones actualmente muy distantes entre sí (Australia, Namibia, etc.). Esos animales no podían viajar grandes distancias, por lo tendrían que vivir en los márgenes continentales de un único continente.
Esta fauna del periodo Ediacárico se ha vuelto cada vez más enigmática. Actualmente, la clasificación de estas especies es controvertida. La determinación de la ubicación de los organismos del Ediacárico en el árbol de la vida ha resultado difícil; no es seguro que fueran animales y podrían ser líquenes, algas, foraminíferos, hongos, colonias microbianas o intermediarios entre plantas y animales. La morfología de ciertos taxones sugiere una relación con las esponjas, los ctenóforos e incluso con los cnidarios.[166] Si algunos de estos fósiles, como Kimberella, Bomakellia y Xenusion, o incluso algunas faunas de pequeñas conchas, pueden ser relacionadas con formas de vida del Cámbrico, muchas otras, por ejemplo, en forma de lágrima, de disco, de tirachinas o de dominó, no tienen relaciones conocidas con una fauna posterior. La mayoría de los macrofósiles son morfológicamente distintos de las formas de vida posteriores: parecen discos, tubos o bolsas de vellón. Debido a las dificultades para establecer relaciones entre estos organismos, algunos paleontólogos han sugerido que podrían representar una forma de vida extinta diferente a cualquier organismo vivo, una especie de «experimento perdido» de la vida multicelular.[167] El paleontólogo Adolf Seilacher propuso un nuevo subreino denominado Vendozoa para agrupar estos organismos enigmáticos.[168] Más recientemente, muchos de estos animales han sido agrupados en Petalonamae, un grupo que muestra afinidades con los ctenóforos.[169]
Los fragmentos salidos de Pannotia más tarde formaron Pangea.
Fanerozoico (después de −541 Ma)
| Supereón | Eón[170] | Millones años |
|---|---|---|
| Fanerozoico | 538,8 ±0,2 | |
| Precámbrico | Proterozoico | 2500 |
| Arcaico | 3.800 | |
| Hádico | ca. 4.570 |
El Fanerozoico o eón fanerozoico es una división de la escala temporal geológica que se extiende desde hace 542,0 ±1,0 millones de años hasta nuestros días.[171][172][173] Sucede al supereón Precámbrico, que abarca el tiempo restante desde la formación de la Tierra. Su nombre deriva del griego (φανερός phanerós «visible», ζῷον zôon «ser vivo») y significa «vida visible», refiriéndose al tamaño de los organismos que surgen en esta época. Mucho antes de este eón ya existía vida en la Tierra, sin embargo es durante este período cuando los organismos vivientes ya toman formas complejas, evolucionan y se diversifican ampliamente.[174][175]
Geológicamente, el Fanerozoico se inicia poco después de la desintegración del supercontinente Pannotia; con el tiempo, los continentes se vuelven a agrupar en otro supercontinente, Pangea; y por último, este se disgrega originando los continentes actuales.−541 Ma: explosión cámbrica

La explosión del Cámbrico tuvo lugar hace 550 Ma. Alrededor de 530 Ma, aparecieron en los océanos los primeros peces con espinas, los primeros vertebrados,[176] que son los antepasados de todos los vertebrados modernos.
Gracias al oxígeno se formó la capa de ozono, que protegió a los seres vivos de las radiaciones, permitiéndoles aventurarse en tierra firme: la extinción del Ordovícico-Silúrico y la del Devónico, marcadas por importantes crisis biológicas que empobrecieron la vida hasta entonces exclusivamente marina favorecieron la conquista de las tierras emergidas por plantas clorofílicas y por varios grandes grupos de animales, principalmente artrópodos y vertebrados. Este proceso de adaptación se llama la salida del agua o terrestrificación.
Fue durante el Ordovícico superior cuando las plantas no vasculares se asentaron y se desarrollaron en tierra firme.[177] Esta importante modificación de la biosfera habría acelerado el proceso de alteración de los silicatos en los continentes. Este proceso, al fijar cantidades muy grandes de dióxido de carbono, habría provocado la caída de la temperatura de la Tierra y el desarrollo de los casquetes polares.[177]
−445 Ma: extinciones del Ordovícico-Silúrico
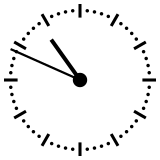
El Ordovícico se correlaciona con una explosión de la actividad volcánica, que depositó nuevas rocas silicatadas, que extraejon CO
2 del aire a medida que se erosionan. Esto resultó en una disminución del dióxido de carbono atmosférico (de 7000 a 4400 ppm).
La aparición y desarrollo de plantas terrestres y del microfitoplancton, que consumían dióxido de carbono atmosférico, redujeron el efecto invernadero y favorecieron la transición del sistema climático al modo glacial. El estudio de sedimentos marinos antiguos que datan de alrededor de 444 Ma (fin del Ordovícico) muestra una gran abundancia de derivados de la clorofila, cuya composición isotópica del nitrógeno coincide con la de las algas modernas. En solo unos pocos millones de años, la cantidad de algas muertas sedimentadas se ha más que quintuplicado. Esas algas habrían prosperado a expensas de otras especies y, en particular, de las cianobacterias. Al menos dos veces más grandes que estas últimas, las algas muertas se habrían acumulado rápidamente en el fondo de los océanos en lugar de reciclar su carbono, lo que provocaría un agotamiento de los organismos marinos (y en ese momento la vida se limitaba esencialmente a la marina media) y una gran glaciación (por reducción del efecto invernadero).[178][179]
Gondwana estaba entonces ubicado en el polo sur, lo que entrañó una glaciación continental rápida, la glaciación del Ordovícico superior. La consiguiente caída del nivel en el océano mundial hizo emerger las plataformas continentales y cuencas poco profundas, haciendo desaparecer el nicho principal del biotopo del Ordovícico y sometiendo a toda la biosfera a una situación de estrés.
Al igual que con otros episodios de extinción masiva, esta situación de crisis encontró factores desencadenantes, en forma de una gran fase de vulcanismo o del impacto de uno o varios asteroides, que habría oscurecido la atmósfera y provocado un invierno de impacto. La reducción de la fotosíntesis suprimió la producción primaria y destruyó las cadenas alimentarias que dependían de ella.
La extinciones masivas del Ordovícico-Silúrico provocaron la desaparición del 27% de las familias y del 57% de los géneros de animales marinos.[180] Se considera la segunda más importante de las cinco grandes extinciones masivas del Fanerozoico,[181] después de la extinción del Pérmico-Triásico que ocurrirá aproximadamente 200 Ma después.[182] la cual terminó hace 488 Ma.[183]
La tasa de desaparición de familias de animales marinos en el Ordovícico superior, durante aproximadamente 20 Ma, es la más alta jamás registrada en la historia de la Tierra, del orden de 20 familias por millón de años.[184]
Colonización de la superficie

La acumulación del oxígeno de la fotosíntesis dio lugar a la formación de una capa de ozono que absorbió gran parte de la radiación ultravioleta del Sol. Así, los organismos unicelulares que llegaron a la superficie de la tierra tenían mayores probabilidades de sobrevivir. Los procariotas empezaron a multiplicarse y a adaptarse mejor a la supervivencia fuera del agua. Los procariotas probablemente habían colonizado la Tierra hacía ya 2600 Ma[185] incluso antes de que el origen de las eucariotas. Durante mucho tiempo, se mantuvo la superficie estéril y sin organismos multicelulares. El supercontinente Pannotia fue formado alrededor de 600 Ma y luego se fracturó (solo 50 Ma más tarde).[186]
Hace varios cientos de millones de años, las plantas (organismos probablemente parecidos a las algas) y los hongos, se empezaron a desarrollar en los bordes del agua, y después fuera de ella.[187] Los fósiles más antiguos de la tierra, hongos y plantas, se datan alrededor de 480 a 460 Ma, aunque la evidencia molecular sugiere que los hongos pudieron haber colonizado la tierra hace 1000 Ma, y las plantas hace 700 Ma.[188] La colonización de la vida comenzó, al principio en los bordes del agua, y después las mutaciones y variaciones dieron lugar a sucesivas colonizaciones de nuevos entornos.
El momento en que los primeros animales salieron de los océanos no se conoce con precisión: la evidencia clara más antigua en la superficie son los artrópodos hace alrededor de 450 Ma,[189] prósperos y cada vez mejor adaptados, debido a la gran fuente de alimento proporcionado por las plantas terrestres. También hay algunas pruebas no confirmadas de que los artrópodos pueden haber aparecido en la tierra hace 530 Ma.[190] Al final del período Ordovícico, hace 440 Ma, se produjeron otras extinción masiva, debido, quizá, a una glaciación.[191] Hace alrededor de 380 a 375 Ma, los primeros tetrápodos evolucionaron a partir de los peces.[192]
Se piensa que quizás las aletas evolucionaron hasta convertirse en las extremidades que permitían a los primeros tetrápodos levantar la cabeza fuera del agua para respirar aire. Esto les permitiría sobrevivir en aguas pobres en oxígeno o perseguir pequeñas presas en aguas poco profundas.[192] Más tarde podrían aventurarse en tierra por breves períodos. Progresivamente, algunos se adaptaron tan bien a la vida terrestre que pasaban su vida adulta en la tierra, a pesar de nacer y tener que poner los huevos en el agua. Este fue el origen de los anfibios.
El límite entre las aves y los dinosaurios no-aves no está claro. El Archaeopteryx, considerado tradicionalmente una de las primeras aves, vivó hace alrededor de 150 Ma.[193] Las primeras evidencias de las angiospermas es durante el período Cretácico, unos 20 millones de años más tarde (hace 132 Ma)[194] La competencia con las aves condujo a la extinción a muchos pterosaurios, y los dinosaurios comenzaron a declinar por diferentes causas.[195]
−440 Ma: salida de las aguas y segunda oxigenación
Desde −440 Ma, en el Silúrico, las algas salieron del agua, y esas formas primitivas de plantas multicelulares invadieron las tierras y comenzaron a dejar depósitos orgánicos en ellaa. Algunos raros artrópodos migraron hacia la tierra e inauguran las clases de artrópodos terrestres: arácnidos (−435 Ma), miriápodos (−428 Ma).
Las plantas vasculares salieron del agua a su vez hacia −420 Ma, a inicios del Devónico. A diferencia de las algas, las plantas vasculares tienen un sistema de raíces con el que extraen nutrientes de la litosfera. Los suelos resultantes de la transformación de la capa superficial de la roca madre, degradados y enriquecidos en aportes orgánicos por los procesos vivos de la pedogénesis, constituyeron gradualmente la pedosfera. Los primeros hexápodos aparecieron en la tierra alrededor de −395 Ma, y dominaron el vuelo alrededor de −380 Ma.
La aparición de plantas terrestres volvió obsoleta la regulación que la nitrogenasa hacía del contenido de oxígeno, debido a que la producción aérea de oxígeno por esas plantas se volvió independiente de la fijación del nitrógeno en los suelos y los ambientes acuáticos.[89] Eso entrañó un aumento gradual del contenido atmosférico de oxígeno, lo que condujo a una nueva crisis en la biosfera.
En respuesta al mayor nivel de oxígeno, las cianobacterias que vivían en colonias cohesivas (en tricomas que forman películas, amas o filamentos) fijaron el nitrógeno del aire vía las células especializadas llamadas heterocistos que funcionan independientemente de otras células, en la anaerobiosis.[89] Algunos muestran muy buena resistencia al frío, al calor y a las radiaciones ionizantes o ultravioleta, lo que les permite vivir en particular en la zona polar.[196] Cuando faltan los nitratos o el amoniaco, algunas de las células de estas cianobacterias (aproximadamente un 10%) engrosan sus paredes, excretan sus pigmentos y sintetizan una enzima (nitrogenasa) que fija el nitrógeno (almacenado en forma de glutamina que puede ser utilizado por otras células que viven aeróbicamente).
Las variaciones repetidas y significativas del nivel del mar y del clima, así como la aparición de una importante cubierta vegetal en los continentes, podrían estar en el origen de fenómenos de anoxia de los océanos y de crisis biológicas mayores que condujeron a la Extinción masiva del Devónico. Las causas de estos cambios aún se debaten.
Hace cerca de 365 Ma, se produjo una nueva extinción masiva, tal vez como resultado de un enfriamiento global.[197]
Regulación del nivel de oxígeno
La evolución de las plantas terrestres en el Devónico temprano llevó a un aumento a largo plazo en el nivel de oxígeno a través de la fotosíntesis, formando hidratos de carbono genéricamente representados por C(H
2O):
CO
2 + H
2O + hν → C(H
2O) + O2 ↑
Pero por sí sola, la fotosíntesis no permitía que el oxígeno se acumulase mientras la materia orgánica permaneciese expuesta a la oxidación química o a la respiración celular, que consumían ese oxígeno y restituían el dióxido de carbono:
C(H
2O) + O2 → CO
2 ↑ + H
2O + energía
El oxígeno solo podía acumularse en la atmósfera si la materia orgánica desaparecía en la sedimentación, capturada en la litosfera.
Ese entierro condujo a la regulación a largo plazo del contenido atmosférico de oxígeno, a través de la fracción de materia orgánica producida que quedó atrapada en los sedimentos. Esa fracción es actualmente muy baja (alrededor del 0,1%) debido a la eficiencia de la descomposición aeróbica;[198] esa sedimentación compensaría globalmente la oxidación de las rocas recién expuestas, lo que evitaría una acumulación adicional de oxígeno. Una caída en el contenido atmosférico disminuiría la eficiencia de la descomposición, permitiendo una mayor sedimentación de materia orgánica. En particular, si los fondos oceánicos tienden a volverse anóxicos, ya no puede permitir la descomposición de partículas orgánicas provenientes de la superficie.
−359 a −299 Ma: Carbonífero


El Carbonífero fue un período de orogenia activa: Pangea estaba en proceso de formación. Después de que comenzase el enfriamiento durante el Devónico, la temperatura permaneció cálida, a pesar del nivel de CO
2 estimado en 0,9% (equivalente a treinta veces el del siglo XIX) y estable durante la primera parte de Carbonífero; y durante la segunda parte del Carbonífero el clima se enfrió de nuevo.
Las plantas desarrollaron semillas, y se aceleró drásticamente su propagación en la tierra en esta época (hace unos 360 Ma).[199][200] Ese período se caracteriza por los primeros grandes árboles. El alto nivel de CO
2 de la atmósfera (30 veces superior al del siglo XIX) indudablemente fomentó el crecimiento de la vegetación. Los grandes depósitos de carbón se deben a dos factores:
- la aparición de árboles con corteza y en particular de aquellos con corteza leñosa;
- el nivel de los mares, bajo comparado con los mares del Devónico, lo que permitió la extensión de vastos pantanos.
Se ha planteado la hipótesis de que el enterramiento de grandes cantidades de madera se debe al hecho de que las bacterias aún no estaban lo suficientemente evolucionadas para ser capaces de digerir y de descomponer las nuevas plantas leñosas. La lignina es difícil de descomponer. No es soluble y puede permanecer en el suelo durante cientos de años e inhibir la descomposición de otras sustancias vegetales.[201]
El enterramiento masivo del carbono pudo haber dado lugar a un exceso de oxígeno en el aire llegando hasta el 35%,[202] pero los modelos revisados consideran que esta cifra es poco realista y estiman que el porcentaje de oxígeno en el aire debería oscilar entre el 15 y el 25%.[203] Los altos niveles de oxígeno son una de las causas planteadas para el gigantismo de ciertos insectos y anfibios, cuyo tamaño se correlaciona con su capacidad para absorber oxígeno. Grandes helechos arborescentes, que alcanzaban los 20 metros de altura, acompañados de licópodos de 30 a 40 metros, dominaban los bosques del Carbonífero que prosperó en las marismas del tipo ecuatorial, desde los Apalaches hasta Polonia, luego, más tarde, en las laderas de los montes Urales.
El carbón dejó de formarse allí hace casi 290 Ma (Carbonífero tardío). Según un estudio que comparó el reloj molecular y el genoma de 31 especies de basidiomicetos (agaricomicetos: «podredumbre blanca», grupo que también contiene hongos que no degradan la lignina —podredumbre parda— y especies ectomicorrízicas), esta parada de formación del carbón parece poder ser explicada por la aparición de nuevas especies de hongos lignívoros (también conocidos como xilófagos) capaces de degradar la lignina a través de enzimas (las lignina peroxidasas).[204][205]
El alto contenido de oxígeno y la alta presión atmosférica permitieron metabolismos más energéticos que favorecieron la aparición de grandes vertebrados terrestres y de grandes insectos voladores.[206]
Unos 20 millones de años más tarde (hace 340 Ma),[207] evolucionó el huevo amniótico, que podría ponerse en la tierra, dando una ventaja en la supervivencia de los embriones de tetrápodos. Esto dio lugar a la divergencia de los amniotas y los anfibios. Otros 30 millones de años después (hace 310 Ma),[208] se observa la divergencia de los synapsidas (incluidos los mamíferos) y los saurópsidos (incluidas las aves, no aves y los reptiles no mamíferos).[209] Otros grupos de organismos continuaron evolucionando en líneas divergentes (en peces, insectos, bacterias, etc.), pero se conocen menos detalles.
−360 a −260 Ma: glaciación del Karoo

Desde el comienzo de esta era Carbonífera, el ensamblaje de las placas tectónicas de Laurussia y del proto-Gondwana, formando Pangea, generó una importante masa continental en la región antártica; el cierre del océano Reico y del océano Iapétus perturbbaa la circulación de las corrientes cálidas en el Panthalassa y el océano Thetys, lo que provocó un enfriamiento gradual de los veranos, así como acumulaciones de nieve en el invierno, lo que aumentó la talla de los glaciares que cubrían la mayor parte de Gondwana. Además, con la captura de carbono, se reduce la tasa global de dióxido de carbono. El Carbonífero está marcado por una tendencia al enfriamiento y la formación deinlandsis en los continentes polares. Se han identificado al menos dos episodios importantes de glaciación.
El descenso de temperatura limitó el crecimiento de las plantas y el alto nivel de oxígeno favoreció los incendios; incluso las plantas mojadas podían arder. Esos dos fenómenos contribuyeron a la liberación de dióxido de carbono en la atmósfera, ralentizando el efecto «Tierra bola de nieve» y generando un calentamiento por efecto invernadero.
−300 a −250 Ma: Pangea



Pangea, que apareció a principios del Pérmico, se formó a finales del Carbonífero de la colisión de Laurussia y Protogondwana. Todas las masas de tierra, excepto una parte del sudeste asiático, se aglomeraron en un solo supercontinente, que se extendía desde el ecuador hasta los polos, rodeado por un océano llamado Panthalassa (el «mar universal»).
El nivel medio del mar se mantuvo bastante bajo durante el Pérmico.
La formación del supercontinente Pangea tuvo importantes consecuencias para la vida: la longitud de las costas y, por tanto, de la superficie de las aguas costeras que albergaban la mayoría de las especies marinas, se vio reducida considerablemente. La reunificación de todos los continentes en un solo supercontinente hizo que desaparecieran las plataformas continentales, que albergaban un gran número de especies, a los niveles de la colisión formando la cadena herciniana; después, el paso de varios continentes a uno solo, aunque pudiera conservar la superficie total de tierra emergida, redujo claramente la longitud total de las costas. Las zonas costeras, sujetas a un clima oceánico, fueron por tanto más restringidas. Finalmente, en tierra, la lejanía de las tierras del centro de Pangea (América del Norte, América del Sur y África) en relación con el mar provocó una fuerte caída de las precipitaciones en esas regiones y, por tanto, la expansión de gigantescos desiertos.
Pangea comenzó a fracturarse al final del Pérmico (−252 Ma) pero de una manera verdaderamente intensa solo al final del Triásico (~ −200 Ma), por sistemas de rifts que separaron América del Norte y África. En el Triásico, Hace unos 180 Ma, se dividió en Laurasia, en el norte, y Gondwana, en el sur.
−252 Ma: extinción del Pérmico-Triásico (Gran Extinción)

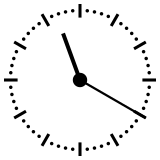
Una intensa actividad volcánica continental (trapps de Emeishan en China, alrededor de −258 Ma y una actividad muy importante de las dorsales oceánicas del océano Tetis produjeron un volumen considerable de lavas basálticas que causaron una transgresión que afectó a las costas de Pangea y que duró una decena de millones de años.
La extinción masiva del Pérmico-Triásico, la extinción más grave hasta hoy, tuvo lugar hace 250 Ma, en el límite de los períodos Pérmico y Triásico, posiblemente debida la erupción de un supervolcán en Siberia[210][211] (causado por la llegada a la superficie de la Tierra de un punto caliente y del cual los trapps de Siberia son la traza), que habría liberado a la atmósfera cantidades fenomenales de gas sulfuroso, y acompañada de una fuerte acidificación de los océanos.[212] El descubrimiento del cráter de la Tierra de Wilkes en la Antártida podría sugerir una conexión con la extinción del Pérmico-Triásico, pero la edad del cráter no se conoce.[213]
Otras hipótesis consideran que habría sido causado por uno o más impactos de meteoritos o por la liberación repentina de CO
2 y de hidratos de metano a partir de los océanos —hipótesis del fusil de clatratos—, lo que resulta en una disminución significativa en el contenido en la atmósfera de O
2.
El cráter de impacto Bedout data de esta época. Se encuentra frente a la costa noroeste de Australia. Es el tercer cráter de impacto más grande de la Tierra. Algunos científicos creen que podría ser el impacto de un meteorito gigante el que provocó esta extinción.
Esta extinción, llamada también de manera informal la Gran Mortandad,[214] está marcada por la desaparición del 95% de las especies marinas (principalmente especies costeras como corales, braquiópodos, equinodermos, etc.) y del 70% de las especies que viven en los continentes (en particular por la disminución de muchos grupos de plantas y de animales, incluidos los insectos ), lo que la convierte en la mayor extinción masiva que afectó a la biosfera.[215] Como resultado, recuperar un nivel equivalente de biodiversidad tomó mucho más tiempo que en otras extinciones masivas.[216] Este evento fue descrito por el paleobiólogo Douglas Erwin como «la madre de todas las extinciones masivas».[217]
−201 Ma: extinción del Triásico-Jurásico

Pero la vida continuó, y en torno a 230 Ma,[218] los dinosaurios se separaron de sus antepasados reptiles.
El evento de extinción Triásico-Jurásico (Tr-J), a veces llamado extinción final del Triásico, marca el límite entre los períodos Triásico y Jurásico, hace 201,3 millones de años, —algunos autores proponen que el Triásico Tardío fue un intervalo prolongado de aproximadamente 30 millones de años—,[219] afectó profundamente la vida en la tierra y en los océanos. En los mares, desapareció toda la clase de conodontos[220] y entre el 23-34% de los géneros marinos.[221][222] En tierra, todos los arcosauromorfos, excepto los crocodilomorfos, los pterosaurios y los dinosaurios, se extinguieron; algunos de los grupos que murieron habían sido abundantes anteriormente, como los aetosaurios, fitosaurios y rauisúquidos. Algunos terápsidos no-mamíferos restantes y muchos de los grandes anfibios temnospondilo también se habían extinguido antes del Jurásico. Sin embargo, todavía hay mucha incertidumbre con respecto a una conexión entre el límite Tr-J y los vertebrados terrestres, debido a la escasez de fósiles terrestres de la etapa rética (última) del Triásico.[223] Lo que quedó bastante intacto fueron plantas, dinosaurios, pterosaurios y mamíferos; esto permitió que los dinosaurios y pterosaurios se convirtieran en los animales terrestres dominantes durante los siguientes 135 millones de años.[224] Si bien los mamíferos empezaron a diferenciarse durante este periodo, tenían todos probablemente semejanzas con pequeñas musarañas.[225]
El análisis estadístico de las pérdidas marinas en ese momento sugiere que la disminución de la diversidad se debió más a una disminución de la especiación que a un aumento de las extinciones.[226] Sin embargo, un cambio pronunciado en las esporas de las plantas y el colapso de las comunidades de los arrecifes de coral indican que efectivamente ocurrió una catástrofe ecológica en el límite Triásico-Jurásico. Otras hipótesis sobre la extinción habían propuesto que las causas podrían haber estado relacionadas con la actividad de la provincia magmática del Atlántico Central y su vinculación con el cambio del clima o del nivel del mar,[227] o quizás uno o más impactos de asteroides.[228][229] Sin embargo, la teoría mejor apoyada y sostenida sobre la causa de la extinción del Tr-J atribuye al inicio de erupciones volcánicas en la provincia magmática del Atlántico Central (en inglés, Central Atlantic magmatic province, también conocida por sus siglas CAMP). La CAMP es la provincia ígnea conocida más grande geográficamente y fue responsable de producir una gran cantidad de dióxido de carbono para inducir un calentamiento global profundo y la acidificación de los océanos.[230][231] Este evento dejó vacantes los nichos ecológicos terrestres, lo que permitió a los dinosaurios asumir los roles dominantes en el período Jurásico. Este evento ocurrió en menos de 10,000 años y ocurrió justo antes de que Pangea comenzara a romperse. En la zona de Tübingen (Alemania), se puede encontrar un lecho óseo Triásico-Jurásico, que es característico de este límite.[232] El evento de extinción también marca un cambio floral. Aproximadamente el 60% de los diversos conjuntos de polen de monosacatos y bisacatos desaparecen en el límite Tr-J, lo que indica una extinción importante de los géneros de plantas. Los conjuntos de polen del Jurásico temprano están dominados por Corollina, un nuevo género que aprovechó los nichos vacíos que dejó la extinción.[233]
−66 Ma: extinción del Cretácico




La extinción masiva del Cretácico-Paleógeno (K–Pg)[234] (anteriormente conocida como Cretácico-Terciario (K–T)[235] fue una extinción masiva repentina de tres cuartas partes de las especies de plantas y animales de la Tierra,[236][237][238] hace aproximadamente 66 millones de años.[237] Con la excepción de algunas especies ectotérmicas como las tortugas marinas y los cocodrilos, ningún tetrápodo que pesara más de 25 kilogramos sobrevivió.[239] Marcó el final del período Cretácico y el de la Era Mesozoica, al tiempo que presagiaba el comienzo del Paleógeno, primer periodo de la Era Cenozoica, que continúa hasta nuestros días.
En el registro geológico, el evento K–Pg está marcado por una capa delgada de sedimento llamada límite K–Pg, que se puede encontrar en todo el mundo en rocas marinas y terrestres. La arcilla límite muestra niveles inusualmente altos de iridio metálico, un elemento que es más común en los asteroides que en la corteza terrestre.[240]
Como fue propuesto originalmente en 1980 por un equipo de científicos dirigido por Luis Alvarez y su hijo Walter,[241] ahora se piensa generalmente que la extinción K – Pg fue causada por el impacto de un cometa o asteroide masivo, de 10 a 15 km de ancho,[242][243] hace 66 millones de años,[237] que devastó el medio ambiente global, principalmente a través de un invierno de impacto prolongado que detuvo la fotosíntesis en plantas y plancton.[244][245] La hipótesis del impacto, también conocida como la hipótesis Álvarez, fue reforzada por el descubrimiento a principios de la década de 1990 del cráter Chicxulub, de 180 km, en el golfo de México, en la península de Yucatán,[246] que proporcionó evidencia concluyente de que la arcilla del límite K-Pg representaba escombros de un impacto de asteroide.[240] El hecho de que las extinciones ocurrieran simultáneamente proporciona una fuerte evidencia de que fueron causadas por el asteroide.[240] Un proyecto de 2016 de perforación en el anillo de pico de Chicxulub confirmó que el anillo estaba compuesto por granitos expulsados en minutos desde las profundidades de la tierra, pero casi no encontró yeso, la roca del fondo marino habitual en la región que contiene sulfato: el yeso se habría vaporizado y dispersado en forma de aerosol en la atmósfera, provocando efectos a largo plazo en el clima y en la cadena alimentaria. En octubre de 2019, investigadores informaron que el evento rápidamente acidificó los océanos, produciendo un colapso ecológico y, de esta manera, también produjo efectos duraderos en el clima, y en consecuencia fue una razón clave para la extinción masiva a fines del Cretácico.[247][248] En enero de 2020, científicos informaron de nuevas pruebas de que el evento de extinción fue principalmente el resultado del impacto de un meteorito y no del vulcanismo.[249][250][251]
Otros factores causales o que contribuyeron a la extinción pueden haber sido las erupciones volcánicas que ocasionaron los traps del Decán y otras erupciones,[252][253] el cambio climático y el cambio del nivel del mar.
Una amplia gama de especies perecieron en la extinción K – Pg, siendo las más conocidas los dinosaurios no aviares. También destruyó una miríada de otros organismos terrestres, incluidos algunos mamíferos, aves,[254] lagartijas,[255] insectos,[256][257] plantas y todos los pterosaurios.[258] En los océanos, la extinción K-Pg acabó con plesiosaurios y mosasaurios y devastó los peces teleósteos,[259] tiburones, moluscos (especialmente ammonites, que se extinguieron) y muchas especies de plancton. Se estima que el 75% o más de todas las especies de la Tierra desaparecieron.[260] Sin embargo, la extinción también brindó oportunidades evolutivas: a raíz de ello, muchos grupos sufrieron una notable radiación adaptativa, divergencia repentina y prolífica hacia nuevas formas y especies dentro de los desorganizados y vaciados nichos ecológicos. Los mamíferos, en particular, se convirtieron en el nuevo grupo dominante y se diversificaron en el Paleógeno,[261] desarrollando nuevas formas como caballos, ballenas, murciélagos y primates. El grupo superviviente de dinosaurios eran aves, aves terrestres y acuáticas que irradiaron a todas las especies modernas de aves.[262] Los peces teleósteos,[263] y quizás lagartos[255] también irradiaron.

 Una roca de Wyoming con una capa intermedia de arcilla que contiene 1000 veces más iridio que las capas superior e inferior. Fotografía tomada en el Museo de Historia Natural de San Diego.
Una roca de Wyoming con una capa intermedia de arcilla que contiene 1000 veces más iridio que las capas superior e inferior. Fotografía tomada en el Museo de Historia Natural de San Diego. Capa de arcilla del complejo Cretácico-Paleógeno (gris) en los túneles de Geulhemmergroeve, cerca de Geulhem, Países Bajos. (El dedo está por debajo del límite real entre el Cretácico y el Paleógeno)
Capa de arcilla del complejo Cretácico-Paleógeno (gris) en los túneles de Geulhemmergroeve, cerca de Geulhem, Países Bajos. (El dedo está por debajo del límite real entre el Cretácico y el Paleógeno)
Otro candidato potencial sería el cráter Shiva, que data del mismo período, un poco anterior a la formación de las trampas de Deccan.
La Tierra, que se ralentizaba gradualmente por el efecto de las mareas inducidas por la luna, giraba más rápido en ese momento, y entonces un año consistía en 372 días.[264]
Se cree que cuando, hace 65 Ma, un meteorito de 10 kilómetros chocó con la Tierra cerca de la península de Yucatán, expulsó grandes cantidades de partículas de polvo y vapor a la atmósfera impidiendo la llegada de luz solar a la superficie, y por tanto la fotosíntesis, durante años. La mayoría de los grandes animales, incluidos los dinosaurios no-aves, se extinguieron,[265] lo cual marca el fin del período Cretácico y la era Mesozoica.
Posteriormente, en el Paleoceno, los mamíferos se diversificaron rápidamente, aumentaron en tamaño y se convirtieron en los vertebrados dominantes. Tal vez un par de millones de años más tarde (hace alrededor de 63 Ma), vivió el último ancestro común de los primates.[266] A fines del Eoceno, hace 34 Ma, algunos mamíferos terrestres regresaron al mar para convertirse en animales como Basilosaurus, que más tarde dieron lugar a los delfines y ballenas.[267]
−2,58 Ma: Cuaternario
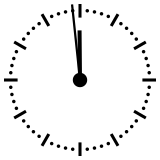
Según el análisis del ADN, en particular del reloj molecular, la rama que condujo a los humanos divergió de la de los primates superiores hace unos 7 millones de años.[268]
Lucy, un fósil de la especie Australopithecus afarensis, data de hace unos 3,2 millones de años.
Homo habilis, un homínido moderno, surgió en África oriental hace unos 2 millones de años.
El Homo sapiens moderno aparece en África hace unos 300 000 años.
−0,6 Ma: fin del Homo erectus

Hace 0,079 millones de años, un meteorito golpeó el sur de Laos.[269] Alrededor de los −10 000 años, las personas se unieron en sociedades organizadas. También fue en esta época cuando nació la agricultura y la ganadería, especialmente en Europa y Oriente Medio. Las primeras ciudades aparecieron en el Creciente Fértil (ejemplo: Babilonia ) hacia el 5000 a. C.), luego la escritura revolucionó la Humanidad hacia el 3000 a. C. y dio origen a los primeros reinos (Antiguo Egipto...): es el comienzo de la Antigüedad.
Después las civilizaciones modernas se desarrollaron en el Mediterráneo y en el Medio Oriente con las ciudades griegas y luego con el Imperio romano que duró hasta 476. Los primeros vínculos entre las civilizaciones mediterráneas y las civilizaciones del Lejano Oriente durante la Antigüedad se hicieron en particular gracias a las conquistas de Alejandro Magno alrededor de 330 a. C. y permitió difundir la cultura griega hasta el actual Irán. Posteriormente, fue Marco Polo y luego los grandes exploradores marítimos (Cristóbal Colón, Fernando de Magallanes-Elcano (expedº), Vasco de Gama, ...) quienes permitieron el descubrimiento (europeo) de Asia y de las costas africanas; luego de haber dado comienzo a la era moderna con el descubrimiento de América en ese final del siglo XV.
Homínidos
Un pequeño simio africano que vivió hace unos seis millones de años fue el primero de los animales cuyos descendientes incluyen tanto a los humanos modernos como a sus parientes más cercanos, los bonobos y chimpancés.[270] Solo sobreviven dos ramas de este árbol familiar. Muy poco después de la división la rama humana desarrolló la capacidad de caminar en posición vertical.[271] El tamaño del cerebro aumentó rápidamente, y hace 2 Ma, aparecieron los primeros animales clasificados en el género Homo.[272] En la misma época, la otra rama dio lugar a los antepasados del chimpancé común y bonobo, que evolucionaron independientemente.[270] La capacidad de controlar el fuego que comenzó con Homo erectus (u Homo ergaster), probablemente hace por lo menos 790 000 años[273] o quizás más temprano, hace unos 1,5 millones de años.[274] Es más difícil establecer el origen del lenguaje, no está claro si Homo erectus podía hablar o si esa capacidad no empezó hasta Homo sapiens.[275] Con el aumento de tamaño del cerebro, se adelantó el momento del parto, pues sus cabezas serían demasiado grandes como para pasar a través de la pelvis. Como resultado, exhiben más plasticidad, y por lo tanto poseen una mayor capacidad de aprender y requiere un período más largo de dependencia. Las habilidades sociales se hicieron más complejas, el lenguaje se hizo más avanzado, y las herramientas eran más elaboradas. Esto contribuyó a aumentar la cooperación y el desarrollo cerebral.[276] Los humanos anatómicamente modernos, Homo sapiens, se originaron hace alrededor de 200 000 años o antes en África; los fósiles más antiguos datan de hace unos 160 000 años.[277] Los primeros seres humanos que mostraron signos de espiritualidad fueron los neandertales, enterraban a sus muertos, al parecer a menudo con alimentos o herramientas.[278] Sin embargo, las pruebas de las creencias más sofisticadas, como la de los primeros cromañones, las pinturas rupestres (probablemente con significado religioso o mágico)[279] no aparecieron hasta hace unos 32 000 años.[280] Los cromañones también dejaron figuras de piedra como la Venus de Willendorf, que probablemente también tuviera significado religioso.[279] Hace unos 11 000 años, Homo sapiens había llegado a la punta sur de América del Sur, el último de los continentes deshabitados.[281] Las herramientas continuaron mejorándose.
Civilización
A lo largo de más del 90 % de su historia, el Homo sapiens vivió en pequeños grupos de nómadas cazadores-recolectores.[282] Mientras que la lengua llegó a ser más compleja, la capacidad de recordar y de transmitir la información dio lugar a una nueva clase de replicador: el meme.[283] Ahora las ideas se intercambiaban más rápido y era más sencillo transmitirlas de generación a generación: la evolución cultural superando la evolución biológica.
En algún punto entre 8500 y 7000 a. C., los seres humanos que vivían en el llamado creciente fértil, actual Oriente Medio, comenzaron, de manera sistemática, la cría de animales y plantas: la agricultura.[284] Esto se extendió a las regiones vecinas y/o surgió de forma independiente en otros lugares, hasta que la mayoría de Homo sapiens optaron por la vida sedentaria en pequeños asentamientos como agricultores pero no todas las sociedades abandonaron el nomadismo, en especial los que están en zonas aisladas del planeta pobres en especies de plantas domesticables, tales como Australia.[285] Sin embargo, entre esas civilizaciones que adoptaron la agricultura, la seguridad y la productividad creciente relativas proporcionadas cultivando permitió que la población se ampliara. La agricultura tenía un impacto importante; los seres humanos comenzaron a afectar el ambiente como nunca antes. Los excedentes de alimentos permitieron surgir a la clase sacerdotal o gobernante, seguido por un aumento de la división del trabajo. Esto condujo a la primera civilización de la tierra en Sumeria en el Oriente Medio, entre 4000 y 3000 a. C..[286] Otras civilizaciones surgieron rápidamente en Egipto y en el valle del río Indo.
A partir de alrededor de 3000 a. C., el hinduismo, una de las religiones más antiguas todavía se practica hoy en día, comenzó a tomar forma.[287] Surgieron otras pronto. La invención de la escritura permitió a sociedades complejas presentarse: el mantenimiento de registros y las bibliotecas sirvieron como almacén del conocimiento y aumentaron la transmisión cultural de la información. Los seres humanos ya no tenían que gastar todo su tiempo en la supervivencia y la educación llevó a la transmisión del conocimiento y la sabiduría. Diversas disciplinas, incluyendo la ciencia (en una forma primitiva) aparecieron. Nueva civilizaciones surgieron, comerciando entre ellas, o participando en guerras por territorios y recursos: se empezaban a formar los imperios. alrededor del 500 a. C., hubo imperios en el Medio Oriente, Irán, la India, China y Grecia, aproximadamente de la misma forma.[288]
En el siglo XIV el Renacimiento comenzó en Italia con los avances en religión, arte y ciencia.[289] A comienzos de 1500, la civilización europea comenzó a experimentar los cambios que conducían a la revolución científica e industrial: ese continente comenzó a ejercer una dominación política y cultural sobre las sociedades humanas de todo el planeta.[290] De 1914 a 1918 y de 1939 a 1945, la mayoría de las naciones del mundo estuvieron envueltas en las guerras mundiales. Creada después de la Primera Guerra Mundial, la Sociedad de Naciones fue un primer paso hacia un gobierno mundial; después de la Segunda Guerra Mundial que fue sustituido por la ONU. En 1992, varios países europeos, se unieron para formar la Unión Europea. Como el transporte y la mejora de la comunicación, la economía y los asuntos políticos de las naciones de todo el mundo se han vuelto cada vez más interrelacionadas. Esta globalización ha producido con frecuencia la discordia, aunque también una mayor colaboración internacional.
Hechos recientes

El cambio ha continuado a un ritmo rápido a partir de mediados de la década de 1940. Los progresos tecnológicos incluyen armas nucleares, ordenadores, ingeniería genética y nanotecnología. La globalización de la economía impulsada por los avances tecnológicos en comunicación y transporte ha influido en la vida cotidiana de muchas partes del mundo. Formas culturales e institucionales, tales como democracia, capitalismo, y el movimiento ecologista han aumentado su influencia. Las principales preocupaciones y problemas como enfermedades, guerra, pobreza, radicalismo violento, y más recientemente, el calentamiento global han aumentado a medida que aumenta la población mundial.
En 1957, la Unión Soviética lanzó el primer satélite artificial en órbita y, poco después, Yuri Gagarin se convirtió en el primer humano en el espacio. Neil Armstrong, un estadounidense, fue el primero en poner pie sobre otro objeto espacial, el satélite de la Tierra (la Luna). Sondas no tripuladas han sido enviadas hacia todos los planetas en el sistema solar, y algunos como los Voyager han abandonado el sistema solar. La Unión Soviética y los Estados Unidos fueron al principio los principales líderes en la exploración espacial en el siglo XX. Cinco agencias espaciales, que representan a más de quince países,[291] han trabajado juntos para construir la Estación Espacial Internacional. A bordo de ella, ha habido una continua presencia humana en el espacio desde el 2000.[292]
Véase también
Referencias
- «"Una nueva imagen del comienzo del universo muestra la época de las primeras estrellas, la edad del cosmos y más cosas"». NASA (publicado el 26 de marzo de 2006). 11 de febrero de 2003.
- Sarah Kaplan (6 de marzo de 2017). «Dear Science: How do we know how old the Earth is?» (en inglés). The Washintong Post.
- «Age of the Earth» (en inglés). Servicio Geológico de los Estados Unidos. 1997. Archivado desde el original el 23 de diciembre de 2005.
- Dalrymple, G. Brent (2001). «The age of the Earth in the twentieth century: a problem (mostly) solved». Special Publications, Geological Society of London (en inglés) 190 (1): 205-221. Bibcode:2001GSLSP.190..205D. S2CID 130092094. doi:10.1144/GSL.SP.2001.190.01.14.
- Manhesa, Gérard; Allègre, Claude J.; Dupréa, Bernard; Hamelin, Bruno (1980). «Lead isotope study of basic-ultrabasic layered complexes: Speculations about the age of the earth and primitive mantle characteristics». Earth and Planetary Science Letters (en inglés) 47 (3): 370-382. Bibcode:1980E&PSL..47..370M. doi:10.1016/0012-821X(80)90024-2.
- Schopf, J. William; Kudryavtsev, Anatoliy B.; Czaja, Andrew D.; Tripathi, Abhishek B. (5 de octubre de 2007). «Evidence of Archean life: Stromatolites and microfossils». Precambrian Research (en inglés) (Amsterdam: Elsevier) 158 (3–4): 141-155. Bibcode:2007PreR..158..141S. ISSN 0301-9268. doi:10.1016/j.precamres.2007.04.009.
- Schopf, J. William (29 de junio de 2006). «Fossil evidence of Archaean life». Philosophical Transactions of the Royal Society B (Londres: Royal Society) 361 (1470): 869-885. ISSN 0962-8436. PMC 1578735. PMID 16754604. doi:10.1098/rstb.2006.1834.
- Raven y Johnson, 2002, p. 68
- Borenstein, Seth (13 de noviembre de 2013). «Oldest fossil found: Meet your microbial mom». Washington Examiner (en inglés). Consultado el 21 de junio de 2021.
- Pearlman, Jonathan (13 de noviembre de 2013). «Oldest signs of life on Earth found». The Daily Telegraph. Londres. Archivado desde el original el 6 de marzo de 2015.
- Noffke, Nora; Christian, Daniel; Wacey, David; Hazen, Robert M. (1 de diciembre de 2013). «Microbially Induced Sedimentary Structures Recording an Ancient Ecosystem in the ca. 3.48 Billion-Year-Old Dresser Formation, Pilbara, Western Australia». Astrobiology (en inglés) (New Rochelle, NY: Mary Ann Liebert, Inc.) 13 (12): 1103-1124. Bibcode:2013AsBio..13.1103N. ISSN 1531-1074. PMC 3870916. PMID 24205812. doi:10.1089/ast.2013.1030.
- Ohtomo, Yoko; Kakegawa, Takeshi; Ishida, Akizumi; Nagase, Toshiro; Rosing, Minik T. (Enero de 2014). «Evidence for biogenic graphite in early Archaean Isua metasedimentary rocks». Nature Geoscience (en inglés) (Londres: Nature Publishing Group) 7 (1): 25-28. Bibcode:2014NatGe...7...25O. ISSN 1752-0894. doi:10.1038/ngeo2025.
- Borenstein, Seth (19 de octubre de 2015). «Hints of life on what was thought to be desolate early Earth». Excite (en inglés). Yonkers, NY: Mindspark Interactive Network. Archivado desde el original el 23 Ode octubre de 2015.
- Bell, Elizabeth A.; Boehnike, Patrick; Harrison, T. Mark; Mao, Wendy L. (19 de octubre de 2015). «Potentially biogenic carbon preserved in a 4.1 billion-year-old zircon». Proceedings of the National Academy of Sciences U.S.A. (en inglés) (Washington, DC: National Academy of Sciences) 112 (47): 14518-14521. Bibcode:2015PNAS..11214518B. ISSN 1091-6490. PMC 4664351. PMID 26483481. doi:10.1073/pnas.1517557112.
- Michael L. Kinney (2012). «7 - How do rare species avoid extinction? A paleontological view». En Kunin, W.E.; Gaston, Kevin, eds. The Biology of Rarity: Causes and consequences of rare–common differences (en inglés). Springer Science & Business Media. ISBN 978-0-412-63380-5.
- Rodríguez Luna, Ernesto; Shedden González, Aralisa (Septiembre-Diciembre de 2009). «El concepto de especie y la explicación de la extinción». La Ciencia y el Hombre - REVISTA DE DIVULGACIÓN CIENTÍFICA Y TECNOLÓGICA DE LA UNIVERSIDAD VERACRUZANA (Universidad Veracruzana) XXII (3).
- Novacek, Michael J. (8 de noviembre de 2014). «Prehistory's Brilliant Future». New York Times (en inglés). Archivado desde el original el 14 de noviembre de 2014.
- G. Miller; Scott Spoolman (2012). Environmental Science – Biodiversity Is a Crucial Part of the Earth's Natural Capital (en inglés). Cengage Learning. p. 62. ISBN 978-1-133-70787-5.
- Geoffrey Giller (8 de abril de 2014). «Are We Any Closer to Knowing How Many Species There Are on Earth?». Scientific American (en inglés).
- Mora, C.; Tittensor, D.P.; Adl, S.; Simpson, A.G.; Worm, B. (23 de agosto de 2011). «How many species are there on Earth and in the ocean?». PLOS Biology (en inglés) 9 (8): e1001127. PMC 3160336. PMID 21886479. doi:10.1371/journal.pbio.1001127.
- «Researchers find that Earth may be home to 1 trillion species». National Science Foundation (en inglés). 2 de mayo de 2016.
- Carlos M. Duarte (coord.); Sergio Alonso; Gerardo Benito; Jordi Dachs; Carlos Montes; Mercedes Pardo; Aida F. Ríos; Rafel Simó et al. (2006). Cambio global - Impacto de la actividad humanasobre el sistema Tierra. Madrid: CSIC - Consejo Superior de Investigaciones Científicas. ISBN 978-84-00-08452-3.
- «Extinciones masivas». Biodiversidad mexicana. CONABIO - Comisión Nacional para el Conocimiento y Uso de la Biodiversidad. 9 de octubre de 2020.
- Cohen, K. M.; Finney, S.; Gibbard, P. L. y Fan, J. X. (2015). «International Chronostratigraphic Chart» (en inglés). Comisión Estratigráfica Internacional. Consultado el 25 de marzo de 2015.
- Pellé, J. M. (2006). «Standard Color Codes for the Geological Time Scale» (PDF) (en inglés). Comisión del Mapa Geológico Mundial.
- C. L. Bennett; D. Larson; J. L. Weiland; N. Jarosik; G. Hinshaw; N. Odegard; K. M.Smith; R. S. Hill; B. Gold; M. Halpern; E. Komatsu; M. R. Nolta; L. Page; D.N. Spergel; E. Wollack; J. Dunkley; A. Kogut; M. Limon; S. S. Meyer; G. S.Tucker; L. Wright (4 de junio de 2013). «Nine-Year Wilkinson Microwave Anisotropy Probe (WMAP) Observations: Final Maps and Results». Astrophysics (en inglés) (Cornell University): 2. doi:10.1088/0067-0049/208/2/20.
- «La teoria del Big Bang y el origen del Universo». AstroMía.
- Muriel Gargaud; Ricardo Amils; Henderson James Cleaves, eds. (2011). Encyclopedia of Astrobiology, Volumen 1 (en inglés). Springer Science & Business Media. p. 1534. ISBN 9783642112713.
- «Origen del Sistema Solar». GeoEnciclopedia.
- George H. Shaw. (5 de agosto de 2008). «Earth's atmosphere – Hadean to early Proterozoic». Geochemistry (en inglés) 68 (3). doi:10.1016/j.chemer.2008.05.001.
- Quand la Terre était une boule de neige, Anne-Sophie Boutaud, Le journal du CNRS, 05.12.2017
- Étienne Klein (5 de diciembre de 2015). «La Terre a-t-elle toujours été aussi bleue qu’une orange?». France Culture (en francés).
- «El origen del campo magnético de la Tierra primitiva». Investigación y Ciencia. Prensa Científica. 6 de marzo de 2020.
- James F. Kasting (1993). «Earth's early atmosphere». Science (en inglés) 259 (5097): 920-926. PMID 11536547. doi:10.1126/science.11536547.
- "International Stratigraphic Chart". International Commission on Stratigraphy
- Luis Álvaro Cadena Monroy (Julio-diciembre de 2013). «De los primeros homínidos al Homo sapiens». Revista Colombiana de Bioética (Bogotá, Colombia: Universidad El Bosque) 8 (2): 59. ISSN 1900-6896.
- Los colores corresponden a los códigos RGB aprobados por la Comisión Internacional de Estratigrafía. Disponible en el sitio de la International Commision on Stratigraphy, en «Standard Color Codes for the Geological Time Scale».
- Comisión Internacional de Estratigrafía (2013) Tabla cronoestratigráfica internacional v2013/01 (en español)
- Cohen, K. M., Finney, S. C., Gibbard, P. L. & Fan, J.-X. (2013; actualizado 2022). «The ICS International Chronostratigraphic Chart». Episodes 36. pp. 199-204. Consultado el 30 de diciembre de 2022.
- Cloud, Preston (1972). «A working model of the primitive Earth». American Journal of Science 272 (6): 537-548. Bibcode:1972AmJS..272..537C. doi:10.2475/ajs.272.6.537.
- Bleeker, W. (2004). «10. Toward a "natural" Precambrian time scale». En Gradstein, Felix M.; Ogg, James G.; Smith, Alan G., eds. A Geologic Time Scale 2004. Cambridge, England, UK: Cambridge University Press. p. 145.
- «Oxford Dictionary, "Priscoan"». Archivado desde el original el 29 de noviembre de 2018. Consultado el 14 de octubre de 2020.
- Shaw, D.M. (1975). «Early History of the Earth». Proceedings of the NATO Advanced Study Institute (Leicester: John Wiley (London)): 33-53.
- Jarvis, Gary T.; Campbell, Ian H. (December 1983). «Archean komatiites and geotherms: Solution to an apparent contradiction». Geophysical Research Letters 10 (12): 1133-1136. doi:10.1029/GL010i012p01133.
- Courtland, Rachel (2 de julio de 2008). «Did newborn Earth harbour life?». New Scientist. Consultado el 27 de septiembre de 2014.
- Dodd, Matthew S.; Papineau, Dominic; Grenne, Tor; Slack, John F.; Rittner, Martin; Pirajno, Franco; O’Neil, Jonathan; Little, Crispin T. S. (2 de marzo de 2017). «Evidence for early life in Earth’s oldest hydrothermal vent precipitates». Nature (en inglés) 543 (7643): 60-64. ISSN 0028-0836. doi:10.1038/nature21377. Consultado el 13 de junio de 2017.
- Allen P. Nutman; Vickie C. Bennett; Clark R. L. Friend; Martin J. Van Kranendonk; Allan R. Chivas (31 de agosto de 2016). «Rapid emergence of life shown by discovery of 3,700-million-year-old microbial structures». Nature (en inglés). doi:10.1038/nature19355.
- Zhu, Q., Mai, U., Pfeiffer, W. et al. (2 de diciembre de 2019). «Phylogenomics of 10,575 genomes reveals evolutionary proximity between domains Bacteria and Archaea». Nature (en inglés). doi:10.1038/s41467-019-13443-4.
- Fabia U. Battistuzzi; Andreia Feijao; S. Blair Hedges (9 de noviembre de 2004). «A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land». BMC Ecology and Evolution (en inglés).
- Stein B. Jacobsen; Charles L. Harper Jr. (1996). «Accretion and early history of the earth». En Asish Basu; Stan Hart, eds. Earth Processes — Reading the Isotopic Code (en inglés). American Geophysical Union. p. 63. ISBN 9780875900773..
- Laura Schaefer; Linda T. Elkins-Tanton (1 de octubre de 2018). «Magma oceans as a critical stage in the tectonic development of rocky planets». The Royal Society (en inglés). doi:10.1098/rsta.2018.0109.
- Alain R. Meunier (2014). La naissance de la Terre. De sa formation à l'apparition de la vie (en francés). Dunod. p. 101. ISBN 9782100708697..
- S. T. Petsch (2003). «8.11 - The Global Oxygen Cycle». En Heinrich D. Holland; Karl K. Turekian)), eds. Treatise on Geochemistry (en inglés). Elsevier. ISBN 978-0-08-043751-4.
- Carsten Münker; Jörg A. Pfänder; Stefan Weyer; Anette Büchl; Thorsten Kleine; Klaus Mezger (4 de julio de 2003). «Evolution of Planetary Cores and the Earth-Moon System from Nb/Ta Systematics». Science (en inglés) 301 (5629): 84-87. doi:10.1126/science.1084662.
- José Ospina Valencia (17 de mayo de 2006). «Marte y la Tierra: dos hermanos distintos». Deutsche Welle.
- G. Jeffrey Taylor. «Origin of the Earth and Moon». Solar System Exploration (en inglés) (National Aeronautics and Space Administration (NASA)). Archivado desde el original el 31 de octubre de 2004.
- Norman H Sleep (Junio de 2010). «The Hadean-Archaean Environment». Cold Spring Harbor perspectives in biology (en inglés) 2 (6). doi:10.1101/cshperspect.a002527.
- Paul Gilster (1 de noviembre de 2016). «Untangling the Effects of the ‘Big Whack’». Centauri Dreams (en inglés).
- Ian Moffat (Diciembre de 1982). «Paradigmas en Geología: Del catastrofismo a la tectónica de placas». Geo Crítica. Año VII (42). Universidad de Barcelona. ISSN 0210-0754.
- Nola Taylor Redd (15 de noviembre de 2017). «How Was the Moon Formed?». Space (en inglés).
- Simon A. Wilde; John W. Valley; William H. Peck; Colin M. Graham (11 de enero de 2001). «Evidence from detrital zircons for the existence of continental crust and oceans on the Earth 4.4 Gyr ago». Nature (en inglés) 409. doi:10.1038/35051550.
- Bernard Bourdon (1 de mayo de 2005). «Sur la piste de l'écorce primitive». La Recherche (en francés) (386). Archivado desde el original el 3 de septiembre de 2014.
- Guillaume Caro; Bernard Bourdon; Bernard J. Wood; Alexandre Corgne (14 de julio de 2005). «Trace-element fractionation in Hadean mantlegenerated by melt segregation from a magma ocean». Nature (en inglés) (436): 246-249. doi:10.1038/nature03827.
- P. Richard; N. Shimizu; C. Allègre (Julio de 1976). «143Nd/146Nd, a natural tracer: an application to oceanic basalts». Earth and Planetary Science Letters (en inglés) 31 (2): 269-278. doi:10.1016/0012-821X(76)90219-3.
- Cristina Agüera-Àngel (12 de marzo de 2018). «Cuando y como se creó la corteza continental: Cuando el presente no es la clave del pasado». Tierra y Tecnología - T&T (España: Ilustre Colegio Oficial de Geólogos) (51). doi:10.21028/caa.2018.05.12.
- Alfvén Hannes; Gustaf Arrhenius (1976). Evolution of the Solar System (en inglés). National Aeronautics and Space Administration (NASA).
- A.J.Cavosie; J.W.Valley; S.A.Wilde; E.I.M.F. (15 de julio de 2005). «Magmatic δ18O in 4400–3900 Ma detrital zircons: A record of the alteration and recycling of crust in the Early Archean». Earth and Planetary Science Letters (en inglés) 235 (3-4). doi:10.1016/j.epsl.2005.04.028.
- Edward Young (2005). «Executive Summary 2005». NAI Team Pages (en inglés) (Los Angeles: University of California). Archivado desde el original el 14 de noviembre de 2007.
- Gilles Ramstein (Octubre-noviembre de 2017). «Une brève histoire du climat de la Terre». Reflets de la Physique (en francés) (Revue de la Société Française de Physique) (55). doi:10.1051/refdp/201755006.
- Robert Roy Britt (24 de julio de 2002). «Evidence for Ancient Bombardment of Earth». SPACE.com (en inglés). Archivado desde el original el 4 de octubre de 2002.
- «Le phosphore des météorites a permis la vie sur Terre». Futura Santé (en francés). 3 de septiembre de 2004.
- Samuel A. Bowring; Ian S. Williams (Enero de 1999). «Priscoan (4.00–4.03 Ga) orthogneisses from northwestern Canada». Contributions to Mineralogy and Petrology (en inglés) 134. doi:10.1007/s004100050465.
- Andrea Thompson (25 de septiembre de 2008). «Oldest Rocks on Earth Found». Live Science (en inglés).
- Cristina Agüera Àngel. Origen y evolución de la corteza continental. p. 6.
- Los colores corresponden a los códigos RGB aprobados por la Comisión Internacional de Estratigrafía. Disponible en el sitio de la International Commision on Stratigraphy, en «Standard Color Codes for the Geological Time Scale».
- Real Academia Española. «eón arcaico». Diccionario de la lengua española (23.ª edición).
- Global Boundary Stratotype Section and Point (GSSP) of the International Commission of Stratigraphy.
- International Stratigraphic Chart
- François Robert and Marc Chaussidon, A palaeotemperature curve for the Precambrian oceans based on silicon isotopes in cherts, Nature, 443, 26 octobre 2006, p. 969-972.
- «What Is A Comet?». Deutsche Welle 26.02.2004 (en inglés). 2004. Consultado el 30 de diciembre de 2007.
- Fortey, Richard (Septiembre de 1999) [1997]. «Dust to Life». Life: A Natural History of the First Four Billion Years of Life on Earth. New York: Vintage Books. p. 40. ISBN 0-375-70261-X.
- Fortey, Richard (Septiembre de 1999) [1997]. «Dust to Life». Life: A Natural History of the First Four Billion Years of Life on Earth. New York: Vintage Books. pp. 42-44. ISBN 0-375-70261-X.
- Dawkins, Richard (2004). «Canterbury». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. p. 580. ISBN 0-618-00583-8.
- Penny, David; Anthony Poole (Diciembre de 1999). «The nature of the last universal common ancestor». Current Opinions in Genetics and Development 9 (6): 672-677. PMID 1060760. Archivado desde el original el 19 de marzo de 2009. (PDF)
- «Earliest Life». Universidad de Münster. 2003. Archivado desde el original el 8 de agosto de 2012. Consultado el 28 de marzo de 2006.
- On the Origin of Heterotrophy. Peter Schönheit, Wolfgang Buckel, William F. Martin. Trends in Microbiology, January 2016, Vol. 24, No. 1.
- A Coupled Ecosystem-Climate Model for Predicting the Methane Concentration in the Archean Atmosphere. James F. Kasting, Alexander A. Pavlov, Janet L. Siefert. Origins of life and evolution of the biosphere, June 2001, Volume 31, Issue 3, pp 271–285.
- L’origine de la vie et les métalloenzymes à fer-soufre. Juan C. Fontecilla-Camps. Exposé au Collège de France, 26 mai 2010.
- Nitrogenase Inhibition Limited Oxygenation of Earth’s Proterozoic Atmosphere. John F.Allen, BrendaThake, William F.Martin. Trends in Plant Science, Elsevier, November 2019.
- (en inglés) Ilana Berman-Frank, Yi-bu Chen, Yuan Gao, Katja Fennel, Mick Follows, Allen J. Milligan, et Paul Falkowski, — PDF Feedbacks Between the Nitrogen, Carbon and Oxygen Cycles. Nitrogen in the Marine Environment 2.ª Edition - 2008), Academic Press, pp.1537-1563.
- A reduced, abiotic nitrogen cycle before the rise of oxygen. Ward, Lewis M, James Hemp, and Woodward W. Fischer.
- The Nitrogen Cycle Before the Rise of Oxygen. Ward, L. M.; Hemp, J.; Fischer, W. W. American Geophysical Union, Fall Meeting 2016.
- (en inglés) Earth: Atmospheric Evolution of a Habitable Planet. Stephanie L. Olson, Edward W. Schwieterman, Christopher T. Reinhard, Timothy W. Lyons. arXiv:1803.05967 [astro-ph.EP].
- Jean-François Deconinck; Benjamin Brigaud; Pierre Pellenard (2016). Pétrographie et environnements sédimentaires (en francés). Éditions Dunod. p. 223. ISBN 978-2-10-074001-7.
- Donald E. Canfield; Alexander Glazer; Paul Falkowski. «The Evolution and Future of Earth's Nitrogen Cycle». Science (en inglés) 330 (6001). doi:10.1126/science.1186120.
- Quentin Mauguit (28 de febrero de 2013). «La photosynthèse prend de l’âge: elle a 3,8 milliards d’années». Futura (en francés).
- Andrew H. Knoll; Kristin D. Bergmann; Justin V. Strauss (5 de noviembre de 2016). «Life: the first two billion years». Philosophical Transactions of the Royal Society B - Biological Sciences (en inglés) 371 (1707). doi:10.1098/rstb.2015.0493.
- Alex L. Sessions; David M. Doughty; Paula V. Welander; Roger E. Summons; Dianne K.Newman (28 de julio de 2009). «The Continuing Puzzle of the Great Oxidation Event». Current Biology (en inglés) 19 (14). doi:10.1016/j.cub.2009.05.054.
- (en inglés) The evolution of Earth's biogeochemical nitrogen cycle Archivado el 8 de diciembre de 2019 en Wayback Machine.. Eva E. Stüeken, Michael A. Kipp, Matthew C. Koehler, Roger Buick. Earth-Science Reviews, 160 (2016) 220-239.
- Dawkins, Richard (2004). «Canterbury». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. pp. 564-566. ISBN 0-618-00583-8.
- De Marais, David J. (8 de septiembre, 2000). «Evolution: When Did Photosynthesis Emerge on Earth?». Science 289 (5485): 1703-1705. PMID 11001737. (full text)
- Fortey, Richard (September de 1999) [1997]. «Dust to Life». Life: A Natural History of the First Four Billion Years of Life on Earth. New York: Vintage Books. pp. 50-51. ISBN 0-375-70261-X.
- Chaisson, Eric J. (2005). «Early Cells». Cosmic Evolution. Universidad Tufts. Archivado desde el original el 11 de abril de 2006. Consultado el 29 de marzo de 2006.
- Tanai Cardona (20 de marzo de 2019). «Thinking twice about the evolution of photosynthesis». Royal Society (en inglés). doi:10.1098/rsob.180246.
- Katharine Davis (1 de octubre de 2004). «Photosynthesis got a really early start». New Scientist.
- Hayley Dunning (14 de marzo de 2016). «Photosynthesis more ancient than thought, and most living things could do it». Imperial College London (en inglés).
- Tanai Cardona (6 de marzo de 2018). «Early Archean origin of heterodimeric Photosystem I». Heliyon 4 (3). PMC 5857716. PMID 29560463. doi:10.1016/j.heliyon.2018.e00548.
- «Photosynthesis originated a billion years earlier than we thought, study shows». Science Daily (en inglés). 6 de marzo de 2018.
- The evolution of plate tectonics. Robert J. Stern. One contribution of 14 to a discussion meeting issue ‘Earth dynamics and the development of plate tectonics’. Published by the Royal Society.
- The inception of plate tectonics: a record of failure. Craig O'Neill, Simon Turner, Tracy Rushmer. 01 October 2018. One contribution of 14 to a discussion meeting issue ‘Earth dynamics and the development of plate tectonics’. Published by the Royal Society.
- The growth of continental crust. FrancisAlbarède. Tectonophysics, Volume 296, Issues 1–2, 30 octobre 1998, Pages 1-14.
- Genèse et Origine de la Croûte Continentale. Christian Nicollet,
- Nebel, O.; Capitanio, F. A.; Moyen, J.-F.; Weinberg, R. F.; Clos, F.; Nebel-Jacobsen, Y. J. y Cawood, P. A. (2018). «When crust comes of age: on the chemical evolution of Archaean, felsic continental crust by crustal drip tectonics». Phil. Trans. R. Soc. A 376 (2132): 20180103. doi:10.1098/rsta.2018.0103.
- The evolving nature of terrestrial crust from the Hadean, through the Archaean, into the Proterozoic. Balz S.Kamber. Precambrian Research, Volume 258, March 2015, Pages 48-82.
- The Evolution of Continental Crust. S. Ross Taylor, Scott M. McLennan, July 1, 2005. Scientific American.
- Statistical geochemistry reveals disruption in secular lithospheric evolution about 2.5 Gyr ago. Keller, C., Schoene, B. Nature 485, 490–493 (2012) doi:10.1038/nature11024
- (en inglés) — PDF Constraining the climate and ocean pH of the early Earth with a geological carbon cycle model, Krissansen-Totton et al., PNAS Direct Submission, 7 de marzo de 2018.
- Carbon dioxide cycling and implications for climate on ancient Earth. Sleep NH, Zahnle K (2001). J Geophys Res Planets 106:1373–1399.
- Electrons, life and the evolution of Earth's oxygen cycle. Paul G Falkowski, Linda V Godfrey. Philos Trans R Soc Lond B Biol Sci. 2008 Aug 27; 363(1504): 2705-2716.
- The relative influences of nitrogen and phosphorus on oceanic primary production. Tyrrell, T. Nature 400, 525–531 (1999).
- Vonne Lara (28 de septiembre de 2016). «La Gran Oxidación, cuando el oxígeno provocó una catástrofe mundial». Hipertextual.
- François Ramade (2011). «2 Origine nature et évolution de lécosphère». Introduction à l'écochimie (en francés). Lavoisier. p. 41. ISBN 9782743019266..
- David Quintero Plaza (1 de mayo de 2019). «Una breve historia de la atmósfera terrestre». AEMET - Agencia Estatal de Meteorología. España.
- Los colores corresponden a los códigos RGB aprobados por la Comisión Internacional de Estratigrafía. Disponible en el sitio de la International Commision on Stratigraphy, en «Standard Color Codes for the Geological Time Scale».
- Real Academia Española. «eón proterozoico». Diccionario de la lengua española (23.ª edición).
- Global Boundary Stratotype Section and Point (GSSP) of the International Commission of Stratigraphy, Status on 2009.
- International Stratigraphic Chart, 2008
- Phanerozoic atmospheric oxygen, Berner et al., Annual Review of Earth and Planetary Sciences, Vol. 31:105-134 (May 2003).
- Biogeochemical Controls and Feedbacks on Ocean Primary Production. Paul G. Falkowski, Richard T. Barber, Victor Smetacek. Science 10 Jul 1998: Vol. 281, Issue 5374, pp. 200-206
- Garcia-Vallvé S, Romeu A, Palau J (novembre 2000). «Horizontal gene transfer in bacterial and archaeal complete genomes». Genome research (en inglés) 10 (11): 1719-25. PMID 11076857..
- Katerina Stamati, Vivek Mudera et Umber Cheema, Evolution of oxygen utilization in multicellular organisms and implications for cell signalling in tissue engineering, J. Tissue Eng., 2011, 2(1).
- Cyanobacteria and the Great Oxidation Event: evidence from genes and fossils. Schirrmeister, Gugger & Donoghue. Palaeontology, the online library, juin 2015.
- Evolution of multicellularity coincided with increased diversification of cyanobacteria and the Great Oxidation Event. Bettina E. Schirrmeister, Jurriaan M. de Vos, Alexandre Antonelli, and Homayoun C. Bagheri. PNAS January 29, 2013 110 (5) 1791-1796.
- Colin Goldblatt, Timothy M. Lenton & Andrew J. Watson, Bistability of atmospheric oxygen and the Great Oxidation, Nature volume 443, pages: 683–686 (2006).
- Beginnings of Biospheric Evolution and Their Biogeochemical Consequences. Preston Cloud. Paleobiology, Vol. 2, No. 4 (Autumn, 1976), pp. 351-387.
- Did Bacterial Enzymes Cap the Oxygen in Early Earth’s Atmosphere? Sarah Derouin, Earth & Space Science News, 25 September 2019.
- Timothy W. Lyons, Christopher T. Reinhard, & Noah J. Planavsky., The rise of oxygen in Earth’s early ocean and atmosphere, Nature, Vol 506, Février 2014.
- Une vie complexe il y a 2 milliards d’années: l’hypothèse se confirme ! futura-sciences.com, 26 Juin 2014.
- Guochun Zhao; M. Sun; Simon A. Wilde; S.Z. Li (11 de 2004). «A Paleo-Mesoproterozoic supercontinent: assembly, growth and breakup». Earth-Science Reviews (en inglés) 67: 91-123. .
- Viral evolution: Primordial cellular origins and late adaptation to parasitism. Arshan Nasir, Kyung Mo Kim & Gustavo Caetano-Anollés (2012), Mobile Genetic Elements, 2:5, 247-252, DOI: 10.4161/mge.22797.
- The Origin of Mitochondria. William F. Martin, Ph.D. Nature Education 3(9):58.
- Nicholas J. Butterfield (2000). «Bangiomorpha pubescens n. gen., n. sp.: implications for the evolution of sex, multicellularity, and the Mesoproterozoic/Neoproterozoic radiation of eukaryotes». Paleobiology (en inglés) 26 (3): 386-404. doi:10.1666/0094-8373(2000)026<0386:BPNGNS>2.0.CO;2..
- A Complex Hierarchy of Avoidance Behaviors in a Single-Cell Eukaryote.
-
- The hydrogen hypothesis for the first eukaryote. Martin W, Muller M. Nature 1998, 392(6671):37-41.
- Animals and the invention of the Phanerozoic Earth system. Nicholas J.Butterfield. Trends in Ecology & Evolution. Elsevier, February 2011 .
- Woese, Carl; J. Peter Gogarten (21 de octubre, 1999). «When did eukaryotic cells evolve? What do we know about how they evolved from earlier life-forms?». Scientific American. Archivado desde el original el 10 de octubre de 2007. Consultado el 9 de marzo de 2008.
- Andersson, Siv G. E.; Alireza Zomorodipour, Jan O. Andersson, Thomas Sicheritz-Pontén, U. Cecilia M. Alsmark, Raf M. Podowski, A. Kristina Näslund, Ann-Sofie Eriksson, Herbert H. Winkler, & Charles G. Kurland (12 de noviembre, 1998). «The genome sequence of Rickettsia prowazekii and the origin of mitochondria». Nature 396 (6707): 133-140. PMID 9823893. doi:10.1038/24094. Archivado desde el original el 11 de diciembre de 2005.
- Berglsand, Kristin J.; Robert Haselkorn (Junio de 1991). «Evolutionary Relationships among the Eubacteria, Cyanobacteria, and Chloroplasts: Evidence from the rpoC1 Gene of Anabaena sp. Strain PCC 7120». Journal of Bacteriology 173 (11): 3446-3455. PMID 1904436. (PDF)
- Dawkins, Richard (2004). «The Great Historic Rendezvous». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. pp. 536-539. ISBN 0-618-00583-8.
- Fortey, Richard (Septiembre de 1999) [1997]. «Dust to Life». Life: A Natural History of the First Four Billion Years of Life on Earth. New York: Vintage Books. pp. 60-61. ISBN 0-375-70261-X.
- Takemura, Masaharu (Mayo de 2001). «Poxviruses and the origin of the eukaryotic nucleus.». Journal of Molecular Evolution 52 (5): 419-425. PMID 11443345.
- Bell, Philip J (Septiembre de 2001). «Viral eukaryogenesis: was the ancestor of the nucleus a complex DNA virus?». Journal of Molecular Evolution 53 (3): 251-256. PMID 11523012.
- Gabaldón, Toni; Berend Snel, Frank van Zimmeren, Wieger Hemrika, Henk Tabak, and Martijn A. Huynen (23 de marzo de 2006). «Origin and evolution of the peroxisomal proteome.». Biology Direct 1 (1): 8. PMID 16556314. Archivado desde el original el 13 de mayo de 2006. Consultado el 9 de marzo de 2008. (PDF)
- Whitehouse, David (2002). «Ancient supercontinent proposed». BBC. Consultado el 16 de abril de 2006.
- Hanson, Richard E.; James L. Crowley, Samuel A. Bowring, Jahandar Ramezani, Wulf A. Gose, et al. (21 de mayo de 2004). «Coeval Large-Scale Magmatism in the Kalahari and Laurentian Cratons During Rodinia Assembly». Science 304 (5674): 1126-1129. doi 10.1126/science.1096329.
- Chaisson, Eric J. (2005). «Ancient Fossils». Cosmic Evolution. Universidad Tufts. Archivado desde el original el 15 de abril de 2006. Consultado el 31 de marzo de 2006.
- Bhattacharya, Debashish; Linda Medlin (1998). «Algal Phylogeny and the Origin of Land Plants». Plant Physiology 116: 9-15. (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última). (PDF)
- Dawkins, Richard (2004). «Choanoflagellates». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. p. 488. ISBN 0-618-00583-8.
- Dawkins, Richard (2004). «Sponges». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. pp. 483-487. ISBN 0-618-00583-8.
- Hoffman, Paul F.; Alan J. Kaufman, Galen P. Halverson, & Daniel P. Schrag (28 de agosto de 1998). «A Neoproterozoic Snowball Earth». Science 281 (5381): 1342-1346. doi 10.1126/science.281.5381.1342. Consultado el 16 de abril de 2006. (abstract)
- Torsvik, Trond H. (30 de mayo de 2003). «The Rodinia Jigsaw Puzzle». Science 300 (5624): 1379-1381. doi 10.1126/science.1083469.
- Asteroid shower on the Earth-Moon system immediately before the Cryogenian period revealed by KAGUYA. Terada, K., Morota, T. & Kato, M. Nat Commun 11, 3453 (2020).
- A.G. Smith (2009). «Neoproterozoic timescales and stratigraphy». Geological Society, London, Special Publications (en inglés) 326: 27-54. Bibcode:2009GSLSP.326...27S. doi:10.1144/SP326.2..
- R. Damian Nance; J. Brendan Murphy (Marzo de 2018). «Supercontinents and the case for Pannotia». Geological Society London Special Publications (en inglés) 470 (1). doi:10.1144/SP470.5.
- Philip J. Heron; J. Brendan Murphy; R. Damian Nance; R. N. Pysklywec (8 de septiembre de 2020). «Pannotia's mantle signature: the quest for supercontinent identification». Geological Society, London, Special Publications (en inglés) 503. doi:10.1144/SP503-2020-7.
- A. Kröner, R.J. Stern (2005). «Pan-African Orogeny». Encyclopedia of Geology (en inglés). doi:10.1016/B0-12-369396-9/00431-7.
- M. L. Droser; J. G. Gehling (2008). «Synchronous Aggregate Growth in an Abundant New Ediacaran Tubular Organism». Science (en inglés) 319 (5870): 1660-1662. Bibcode:2008Sci...319.1660D. PMID 18356525. doi:10.1126/science.1152595..
- Guy Narbonne (Junio de 2006). «The Origin and Early Evolution of Animals» (en inglés). Department of Geological Sciences and Geological Engineering - Queen's University. Archivado desde el original el 15 de junio de 2006. Consultado el 24 de mayo de 2021.
- Adolf Seilacher (1992). «Vendobionta and Psammocorallia: lost constructions of Precambrian evolution». Journal of the Geological Society (en inglés) (Londres) 149 (4): 607-613. doi:10.1144/gsjgs.149.4.0607. Consultado el 21 de junio de 2007.
- Jennifer F. Hoyal Cuthill; Jian Han (2018.). Cambrian petalonamid Stromatoveris phylogenetically links Ediacaran biota to later animals (en inglés). doi:10.1111/pala.12393.
- Los colores corresponden a los códigos RGB aprobados por la Comisión Internacional de Estratigrafía. Disponible en el sitio de la International Commision on Stratigraphy, en «Standard Color Codes for the Geological Time Scale».
- Real Academia Española. «eón fanerozoico». Diccionario de la lengua española (23.ª edición).
- Global Boundary Stratotype Section and Point (GSSP) of the International Commission of Stratigraphy, Status on 2009.
- International Stratigraphic Chart, 2008
- Markov, Alexander V.; Korotayev, Andrey V. (2007). «Phanerozoic marine biodiversity follows a hyperbolic trend». Palaeoworld 16 (4): 311-318. doi:10.1016/j.palwor.2007.01.002.
- Miller, K. G.; et al. (2005). «The Phanerozoic record of global sea-level change». Science 310 (5752): 1293-1298. doi:10.1126/science.1116412.
- Dawkins, Richard (2004). «Lampreys and Hagfish». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. p. 354. ISBN 0-618-00583-8.
- (en inglés) Timothy M. Lenton, Michael Crouch Martin Johnson, Nuno Pires, Liam Dolan, First plants cooled the Ordovician., Nature Geoscience. Band 5, 2012, S. 86–89, doi:10.1038/ngeo1390,
- Katherine Kornei (11 de julio de 2018). «Tiny Algae May Have Prompted a Mass Extinction». Eos (en inglés). doi:10.1029/2018EO102539.
- Jiaheng Shen; Ann Pearson; Gregory A. Henkes; Yi Ge Zhang; Kefan Chen; Dandan Li; Scott D. Wankel; Stanley C. Finney et al. (11 de junio de 2018). «Improved efficiency of the biological pump as a trigger for the Late Ordovician glaciation». Nature Geoscience (en inglés) 11: 510-514. doi:10.1038/s41561-018-0141-5.
- J. John Sepkoski Jr. (1981). «A factor analytical description of the Phanerozoic marine fossil record». Paleobiology (en inglés) 7 (1): 36-53.
- Cecilia Prados Télles (Julio de 2014). «Grandes catástrofes en la historia de La Tierra: extinciones en masa». Facultad de Ciencias Experimentales - Universidad de Jaén. p. 17.
- «The Mass Extinctions: The Late Cambrian Extinction». BBC. Archivado desde el original el 7 de abril de 2000. Consultado el 9 de abril de 2006.
- Landing, E.; S. A. Bowring, K. L. Davidek, R. A. Fortey, & W. A. P. Wimbledon (2000). «Cambrian–Ordovician boundary age and duration of the lowest Ordovician Tremadoc Series based on U–Pb zircon dates from Avalonian Wales». Geological Magazine 137 (5): 485-494. doi 10.1017/S0016756800004507. (abstract)
- (en inglés)Raup, D. M. and J. John Sepkoski Jr., Mass extinctions in the marine fossil record Archivado el 2 de abril de 2015 en Wayback Machine., Science, 215, 1982, — PDF p. 1501-1503.
- Pisani, Davide; Laura L. Poling, Maureen Lyons-Weiler, & S. Blair Hedges (19 de enero de 2004). «The colonization of land by animals: molecular phylogeny and divergence times among arthropods». BMC Biology 2 (1). doi 10.1186/1741-7007-2-1.
- Lieberman, Bruce S. (2003). «Taking the Pulse of the Cambrian Radiation». Integrative and Comparative Biology 43 (1): 229-237. doi 10.1093/icb/43.1.229.
- Fortey, Richard (septiembre de 1999) [1997]. «Landwards». Life: A Natural History of the First Four Billion Years of Life on Earth. New York: Vintage Books. pp. 138-140. ISBN 0-375-70261-X.
- Heckman, D. S.; D. M. Geiser, B. R. Eidell, R. L. Stauffer, N. L. Kardos, & S. B. Hedges (10 de agosto de 2001). «Molecular evidence for the early colonization of land by fungi and plants.». Science 10 (293): 1129-1133. PMID 11498589. doi:10.1126/science.1061457. (abstract)
- Johnson, E. W.; D. E. G. Briggs, R. J. Suthren, J. L. Wright, & S. P. Tunnicliff (Mayo de 1994). «Non-marine arthropod traces from the subaereal Ordivician Borrowdale volcanic group, English Lake District». Geological Magazine 131 (3): 395-406. (abstract)
- MacNaughton, Robert B.; Jennifer M. Cole, Robert W. Dalrymple, Simon J. Braddy, Derek E. G. Briggs, & Terrence D. Lukie (2002). =30&page=391 «First steps on land: Arthropod trackways in Cambrian-Ordovician eolian sandstone, southeastern Ontario, Canada». Geology 30 (5): 391-394. Archivado desde el original el 27 de abril de 2012. Consultado el 2 de julio de 2022. (abstract)
- «The Mass Extinctions: The Late Ordovician Extinction». BBC. Archivado desde el original el 11 de octubre de 1999. Consultado el 22 de mayo de 2006.
- Clack, Jennifer A. (Diciembre de 2005). «Getting a Leg Up on Land». Scientific American.
- «Archaeopteryx: An Early Bird». Universidad de California, Berkeley Museo de paleontología. 1996. Consultado el 9 de abril de 2006.
- Soltis, Pam; Doug Soltis, & Christine Edwards (2005). Spermatopsida «Angiosperms». The Tree of Life Project. Consultado el 9 de abril de 2006.
- «Death of a Dynasty». Walking with Dinosaurs. 1999. (description)
- Antonio Quesada; Warwick F. Vincent; David R.S. Lean (1 de abril de 1999). «Community and pigment structure of Arctic cyanobacterial assemblages: the occurrence and distribution of UV-absorbing compounds». FEMS Microbiology Ecology (en inglés) 28 (4): 315-323. doi:10.1111/j.1574-6941.1999.tb00586.x.
- «The Mass Extinctions: The Late Devonian Extinction». BBC. Archivado desde el original el 9 de octubre de 1999. Consultado el 4 de abril de 2006.
- The Proterozoic Biosphere: A Multidisciplinary Study. J. William Schopf, Cornelis Klein. Cambridge University Press, junio de 1992.
- Willis, K. J.; J. C. McElwain (2002). The Evolution of Plants. Oxford: Oxford University Press. p. 93. ISBN 0-19-850065-3.
- «Plant Evolution». Universidad de Waikato. Consultado el 7 de abril de 2006.
- Jennifer M. Robinson (1990). «Lignin, land plants, and fungi: Biological evolution affecting Phanerozoic oxygen balance». Geology (en inglés) 18 (7): 607-610. doi:10.1130/0091-7613(1990)018<0607:LLPAFB>2.3.CO;2.
- Robert A. Berner (1999). «Atmospheric oxygen over Phanerozoic time». PNAS (en inglés) 96 (20): 10955-10957. doi:10.1073/pnas.96.20.10955.
- Timothy M. Lenton (2001). «The role of land plants, phosphorus weathering and fire in the rise and regulation of atmospheric oxygen». Global Change Biology (en inglés) 7 (6): 613-629. doi:10.1046/j.1354-1013.2001.00429.x.
- Floudas D. et al. (2012). «The Paleozoic Origin of Enzymatic Lignin Decomposition Reconstructed from 31 Fungal Genomes». Science (en inglés) 336: 1715-1719. doi:10.1126/science.1221748.
- David Garon; Jean-Christophe Guéguen (2014). Biodiversité et évolution du monde végétal (en francés). EDP Sciences. p. 166.
- «Período Carbonífero». National Geographic. 5 de septiembre de 2010.
- Dawkins, Richard (2008). «Encuentro 17 - Anfibios». El cuento del antepasado: Un viaje a los albores de la evolución (Víctor V. Úbeda, trad.). Antoni Bosch. p. 399. ISBN 9788495348289.
- Dawkins, Richard (2008). «Encuentro 16 - Saurópsidos». El cuento del antepasado: Un viaje a los albores de la evolución (Víctor V. Úbeda, trad.). Antoni Bosch. p. 349. ISBN 9788495348289.
- David López Bosch (10 de enero de 2016). «Reptiles y mamíferos: mismo origen, diferentes historias». All you need is Biology.
- Pauline Gravel (31 janvier 2011). «Sciences - Le mystère de la grande extinction enfin élucidé». Le Devoir..
- Stephen E. Grasby; Hamed Sanei autor3=Benoit Beauchamp (23 de janvier de 2011). «Catastrophic dispersion of coal fly ash into oceans during the latest Permian extinction». Nature Geoscience (en inglés) 4: 104-107. doi:10.1038/ngeo1069. .
- Alexandra Witze (9 de avril de 2015). «Acidic oceans linked to greatest extinction ever — Rocks from 252 million years ago suggest that carbon dioxide from volcanoes made sea water lethal». Nature (en inglés). .
- «Big crater seen beneath ice sheet». . BBC News. 3 de junio de 2006. Consultado el 15 de noviembre de 2006.
- «The Great Dying - NASA Science». Consultado el 30 de abril de 2011.
- «The Day the Earth Nearly Died». Horizon. BBC. 2002. Consultado el 9 de abril de 2006.
- Michael Benton (2005). When Life Nearly Died —The Greatest Mass Extinction of All Time (en inglés). Thames & Hudson. p. 336. ISBN 978-0-500-28573-2..
- D. H. Erwin (1993). The great Paleozoic crisis; Life and death in the Permian (en inglés). Columbia University Press. ISBN 0-231-07467-0..
- «New Blood - Life in the late triassic». BBC (en inglés). 12 de diciembre de 2005. Archivado desde el original el 12 de diciembre de 2005. Consultado el 9 de marzo de 2008.
- Spencer G.Lucas; Lawrence H.Tanner (Octubre de 2015). «End-Triassic nonmarine biotic events». Journal of Palaeogeography (en inglés) 4 (4): 331-348. doi:10.1016/j.jop.2015.08.010.
- Budurov, Kiril; De Renzi, Miquel; Sudar, Milan (1996). «The extinction of conodonts —in terms of discrete elements— at the Triassic–Jurassic boundary». Journal of Iberian Geology (en inglés).
- Graham Ryder; David E. Fastovsky; Stefan Gartner (1996). The Cretaceous-Tertiary Event and Other Catastrophes in Earth History (en inglés). Geological Society of America. p. 19. ISBN 9780813723075.
- Sepkoski, J. John (1984). «A kinetic model of Phanerozoic taxonomic diversity. III. Post-Paleozoic families and mass extinctions». Paleobiology 10 (2): 246-267. ISSN 0094-8373. doi:10.1017/s0094837300008186.
- Tanner, L. H.; Lucas, S. G.; Chapman, M. G. (2004). «Assessing the record and causes of Late Triassic extinctions». Earth-Science Reviews (en inglés) 65. Archivado desde el original el 25 de octubre de 2007.
- David López Bosch (11 de marzo de 2015). «El reinado de los reptiles: ¿qué es un dinosaurio?». All you need is Biology.
- Richard Dawkins (2008). «La gran catástrofe del cretácico». El cuento del antepasado: Un viaje a los albores de la evolución (Víctor V. Úbeda, trad.). 9788495348289. p. 241. ISBN 9788495348289.
- Bambach, R. K.; Knoll, A. H.; Wang, S. C. (2004). «Origination, extinction, and mass depletions of marine diversity». Paleobiology (en inglés) 30 (4): 522-542. doi:10.1666/0094-8373(2004)030<0522:OEAMDO>2.0.CO;2.
- Michael Hautmann (2012). «Extinction: end-Triassic mass extinction». eLS - Encyclopedia of Life Sciences (en inglés).
- Olsen, P. E.; Shubin, N. H.; Anders, M. H. (28 de agosto de 1987). «New early Jurassic tetrapod assemblages constrain Triassic–Jurassic tetrapod extinction event». Science (en inglés) 237 (4818): 1025-1029. ISSN 0036-8075. doi:10.1126/science.3616622.
- Spray John G.; Kelley Simon P.; Rowley David B. (12 de marzo de 1998). «Evidence for a late Triassic multiple impact event on Earth». Nature (en inglés) 392 (6672): 171-173.
- Hautmann, Michael (28 de julio de 2004). «Effect of end-Triassic CO2 maximum on carbonate sedimentation and marine mass extinction». Facies (en inglés) 50 (2): 257-261. doi:10.1007/s10347-004-0020-y.
- Terrence J. Blackburn; Paul E. Olsen; Samuel A. Bowring; Noah M. McLean; Dennis V. Kent; John Puffer; Greg McHone; Mohammed Et-Touhami (2013). «Zircon U-Pb Geochronology Links the End-Triassic Extinction with the Central Atlantic Magmatic Province». Science (en inglés) 340: 941-945.
- Johannes Baier: Der Geologische Lehrpfad am Kirnberg (Keuper; SW-Deutschland) Archivado el 2 de octubre de 2011 en Wayback Machine.. - Jber. Mitt. oberrhein. geol. Ver, N. F. 93, 9–26, 2011.
- Fowell, S. J.; Cornet, B.; Olsen, P. E. (1994), «Geologically rapid Late Triassic extinctions: Palynological evidence from the Newark Supergroup», Geological Society of America Special Papers (Geological Society of America): 197-206, ISBN 978-0813722887, doi:10.1130/spe288-p197.
- La abreviatura deriva de la yuxtaposición de K, la abreviatura término alemán Kreide, abreviatura común del Cretácico, y Pg, que es la abreviatura del Paleógeno.
- La antigua designación incluía el término Terciario (abreviado como T), que ahora está desaconsejado como una unidad geocronológica formal por la Comisión Internacional de Estratigrafía (International Commission on Stratigraphy). Ogg, James G.; Gradstein, F. M. (2004). A geologic time scale 2004 (en inglés). Cambridge: Cambridge University Press. ISBN 978-0-521-78142-8.
- Bianca Bosker (7 de septiembre de 2018). «The Nastiest Feud in Science». The Atlantic (en inglés).
- Renne, Paul R.; Deino, Alan L.; Hilgen, Frederik J.; Kuiper, Klaudia F.; Mark, Darren F.; Mitchell, William S.; Morgan, Leah E.; Mundil, Roland et al. (7 de febrero de 2013). «Time scales of critical events around the Cretaceous-Paleogene boundary». Science (en inglés) 339 (6120): 684-687. Bibcode:2013Sci...339..684R. PMID 23393261. S2CID 6112274. doi:10.1126/science.1230492. Archivado desde el original el 7 de febrero de 2017. Consultado el 1 de diciembre de 2017.
- Fortey, Richard (1999). «Life: A natural history of the first four billion years of life on Earth». Vintage. pp. 238-260. ISBN 978-0-375-70261-7.
- Muench, David; Muench, Marc; Gilders, Michelle A. (2000). Primal Forces (en inglés). Portland, Oregon: Graphic Arts Center Publishing. p. 20. ISBN 9781558685222.
- Schulte, Peter et al. (5 de marzo de 2010). «The Chicxulub Asteroid Impact and Mass Extinction at the Cretaceous-Paleogene Boundary». Science (en inglés) 327 (5970): 1214-1218. Bibcode:2010Sci...327.1214S. JSTOR 40544375. PMID 20203042. S2CID 2659741. doi:10.1126/science.1177265.
- Victoria Jaggard (25 de junio de 2021). «¿Por qué se extinguieron los dinosaurios?». National Geographic.
- Sleep, Norman H.; Lowe, Donald R. (9 de abril de 2014). «Scientists reconstruct ancient impact that dwarfs dinosaur-extinction blast». American Geophysical Union (en inglés). Archivado desde el original el 1 de enero de 2017. Consultado el 1 de julio de 2021.
- Amos, Jonathan (15 de mayo de 2017). «Dinosaur asteroid hit 'worst possible place'». BBC News Online (en inglés). Archivado desde el original el 18 de marzo de 2018. Consultado el 1 de julio de 2021.
- Alvarez, L. W.; Alvarez, W.; Asaro, F.; Michel, H. V. (1980). «Extraterrestrial cause for the Cretaceous–Tertiary extinction». Science (en inglés) 208 (4448): 1095-1108. Bibcode:1980Sci...208.1095A. PMID 17783054. S2CID 16017767. doi:10.1126/science.208.4448.1095. Archivado desde el original el 24 de agosto de 2019.
- Vellekoop, J.; Sluijs, A.; Smit, J. et al. (May 2014). «Rapid short-term cooling following the Chicxulub impact at the Cretaceous-Paleogene boundary». Proc. Natl. Acad. Sci. U.S.A. 111 (21): 7537-41. Bibcode:2014PNAS..111.7537V. PMC 4040585. PMID 24821785. doi:10.1073/pnas.1319253111.
- Hildebrand, A. R.; Penfield, G. T. et al. (1991). «Chicxulub crater: a possible Cretaceous/Tertiary boundary impact crater on the Yucatán peninsula, Mexico». Geology 19 (9): 867-871. Bibcode:1991Geo....19..867H. doi:10.1130/0091-7613(1991)019<0867:ccapct>2.3.co;2.
- Joel, Lucas (21 de octubre de 2019). «The dinosaur-killing asteroid acidified the ocean in a flash: the Chicxulub event was as damaging to life in the oceans as it was to creatures on land, a study shows.». The New York Times. Archivado desde el original el 24 de octubre de 2019. Consultado el 24 de octubre de 2019.
- Henehan, Michael J. (21 de octubre de 2019). «Rapid ocean acidification and protracted Earth system recovery followed the end-Cretaceous Chicxulub impact». Proceedings of the National Academy of Sciences of the United States of America 116 (45): 22500-22504. Bibcode:2019PNAS..11622500H. PMC 6842625. PMID 31636204. doi:10.1073/pnas.1905989116.
- Joel, Lucas (16 de enero de 2020). «Meteorite or Volcano? New Clues to the Dinosaurs' Demise - Twin calamities marked the end of the Cretaceous period, and scientists are presenting new evidence of which drove one of Earth's great extinctions.». The New York Times. Consultado el 17 de enero de 2020.
- Hull, Pincelli M.; Bornemann, André; Penman, Donald E. (17 de enero de 2020). «On impact and volcanism across the Cretaceous-Paleogene boundary». Science 367 (6475): 266-272. Bibcode:2020Sci...367..266H. PMID 31949074. S2CID 210698721. doi:10.1126/science.aay5055. Consultado el 17 de enero de 2020.
- Chiarenza, Alfio Alessandro; Farnsworth, Alexander; Mannion, Philip D.; Lunt, Daniel J.; Valdes, Paul J.; Morgan, Joanna V.; Allison, Peter A. (21 de julio de 2020). «Asteroid impact, not volcanism, caused the end-Cretaceous dinosaur extinction». Proceedings of the National Academy of Sciences (en inglés) 117 (29): 17084-17093. ISSN 0027-8424. PMID 32601204. doi:10.1073/pnas.2006087117.
- Keller, Gerta (2012). The Cretaceous–Tertiary mass extinction, Chicxulub impact, and Deccan volcanism. Earth and life. En John Talent, ed. «Earth and Life: Global Biodiversity, Extinction Intervals and Biogeographic Perturbations Through Time». Springer. pp. 759–793. ISBN 978-90-481-3427-4.
- Bosker, Bianca (September 2018). «The nastiest feud in science: A Princeton geologist has endured decades of ridicule for arguing that the fifth extinction was caused not by an asteroid but by a series of colossal volcanic eruptions. But she's reopened that debate». The Atlantic Monthly. Archivado desde el original el 21 de febrero de 2019. Consultado el 30 de enero de 2019.
- Longrich, Nicholas R.; Tokaryk, Tim; Field, Daniel J. (2011). «Mass extinction of birds at the Cretaceous–Paleogene (K–Pg) boundary». Proceedings of the National Academy of Sciences 108 (37): 15253-15257. Bibcode:2011PNAS..10815253L. PMC 3174646. PMID 21914849. doi:10.1073/pnas.1110395108.
- Longrich, N. R.; Bhullar, B.-A. S.; Gauthier, J. A. (December 2012). «Mass extinction of lizards and snakes at the Cretaceous-Paleogene boundary». Proc. Natl. Acad. Sci. U.S.A. 109 (52): 21396-401. Bibcode:2012PNAS..10921396L. PMC 3535637. PMID 23236177. doi:10.1073/pnas.1211526110.
- Labandeira, C.C.; Johnso,n K.R. (2002). «Preliminary assessment of insect herbivory across the Cretaceous-Tertiary boundary: Major extinction and minimum rebound». En Hartman, J.H.; Johnson, K.R.; Nichols, D.J., eds. The Hell Creek formation and the Cretaceous-Tertiary boundary in the northern Great Plains: An integrated continental record of the end of the Cretaceous. Geological Society of America. pp. 297-327. ISBN 978-0-8137-2361-7.
- Rehan, Sandra M.; Leys, Remko; Schwarz, Michael P. (2013). «First evidence for a massive extinction event affecting bees close to the K-T boundary». PLOS ONE (en inglés) 8 (10): e76683. Bibcode:2013PLoSO...876683R. PMC 3806776. PMID 24194843. doi:10.1371/journal.pone.0076683.
- Nichols, D. J.; Johnson, K. R. (2008). Plants and the K–T Boundary. Cambridge, England: Cambridge University Press.
- Friedman M (2009). «Ecomorphological selectivity among marine teleost fishes during the end-Cretaceous extinction». Proceedings of the National Academy of Sciences (Washington, DC) 106 (13): 5218-5223. Bibcode:2009PNAS..106.5218F. PMC 2664034. PMID 19276106. doi:10.1073/pnas.0808468106.
- Jablonski, D.; Chaloner, W. G. (1994). «Extinctions in the fossil record (and discussion)». Philosophical Transactions of the Royal Society of London B 344 (1307): 11-17. doi:10.1098/rstb.1994.0045.
- Alroy, John (1999). «The fossil record of North American Mammals: evidence for a Palaeocene evolutionary radiation». Systematic Biology 48 (1): 107-118. PMID 12078635. doi:10.1080/106351599260472.
- Feduccia, Alan (1995). «Explosive evolution in Tertiary birds and mammals». Science 267 (5198): 637-638. Bibcode:1995Sci...267..637F. PMID 17745839. S2CID 42829066. doi:10.1126/science.267.5198.637.
- Friedman, M. (2010). «Explosive morphological diversification of spiny-finned teleost fishes in the aftermath of the end-Cretaceous extinction». Proceedings of the Royal Society B 277 (1688): 1675-1683. PMC 2871855. PMID 20133356. doi:10.1098/rspb.2009.2177.
- Ancient shell shows days were half-hour shorter 70 million years ago. AGU 100 news, 9 March 2020.
- Chaisson, Eric J. (2005). «Recent Fossils». Cosmic Evolution. Universidad Tufts. Archivado desde el original el 15 de abril de 2006. Consultado el 9 de abril de 2006.
- Dawkins, Richard (2004). «Lemurs, Bushbabies and their Kin». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. p. 160. ISBN 0-618-00583-8.
- «Whale Killer». Walking with Beasts. 2001.
- Jared Diamond, Le troisième chimpanzé, Folio Essais, p.40-45, ISBN 978-2-07-044133-4.
- (en inglés) Kerry Sieh et al, {https://www.pnas.org/content/early/2019/12/24/1904368116 Australasian impact crater buried under the Bolaven volcanic field, Southern Laos], PNAS, 30 décembre 2019.
- Dawkins, Richard (2004). «Chimpanzees». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. pp. 100-101. ISBN 0-618-00583-8.
- Dawkins, Richard (2004). «Ape-Men». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. pp. 95-99. ISBN 0-618-00583-8.
- Fortey, Richard (Septiembre de 1999) [1997]. «Humanity». Life: A Natural History of the First Four Billion Years of Life on Earth. New York: Vintage Books. p. 38. ISBN 0-375-70261-X.
- Goren-Inbar, Naama; Nira Alperson, Mordechai E. Kislev, Orit Simchoni, Yoel Melamed, Adi Ben-Nun, & Ella Werker (30 de abril de 2004). «Evidence of Hominin Control of Fire at Gesher Benot Ya`aqov, Israel». Science 304 (5671): 725-727. doi 10.1126/science.1095443. Consultado el 11 de abril de 2006. (abstract)
- Dawkins, Richard (2004). «Ergasts». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. p. 67. ISBN 0-618-00583-8.
- Dawkins, Richard (2004). «Ergasts». The Ancestor's Tale: A Pilgrimage to the Dawn of Life. Boston: Houghton Mifflin Company. pp. 67-71. ISBN 0-618-00583-8.
- McNeill, Willam H. (1999) [1967]. «In The Beginning». A World History (4th ed. edición). New York: Oxford University Press. p. 7. ISBN 0-19-511615-1.
- Gibbons, Ann (13 de junio de 2003). «Oldest Members of Homo sapiens Discovered in Africa». Science 300 (5626): 1641. doi 10.1126/science.300.5626.1641. Consultado el 11 de abril de 2006. (abstract)
- Hopfe, Lewis M. (1987) [1976]. «Characteristics of Basic Religions». Religions of the World (4th ed. edición). New York: MacMillan Publishing Company. pp. 17. ISBN 0-02-356930-1.
- Hopfe, Lewis M. (1987) [1976]. «Characteristics of Basic Religions». Religions of the World (4th ed. edición). New York: MacMillan Publishing Company. pp. 17-19. ISBN 0-02-356930-1.
- «Chauvet Cave». Metropolitan Museum of Art. Consultado el 11 de abril de 2006.
- Patrick K. O’Brien, ed., ed. (2003) [2002]. «The Human Revolution». Atlas of World History (concise edition edición). New York: Oxford University Press. p. 16. ISBN 0-19-521921-X.
- McNeill, Willam H. (1999) [1967]. «In The Beginning». A World History (4th ed. edición). New York: Oxford University Press. p. 8. ISBN 0-19-511615-1.
- Dawkins, Richard (1989) [1976]. «Memes: the new replicators». The Selfish Gene (2nd ed. edición). Oxford: Oxford University Press. pp. 189–201. ISBN 0-19-286092-5.
- Tudge, Colin (1998). Neanderthals, Bandits and Farmers: How Agriculture Really Began. London: Weidenfeld & Nicolson. ISBN 0-297-84258-7.
- Diamond, Jared. Guns, Germs, and Steel. W. W. Norton & Company. ISBN 0-393-31755-2.
- McNeill, Willam H. (1999) [1967]. «In The Beginning». A World History (4th ed. edición). New York: Oxford University Press. p. 15. ISBN 0-19-511615-1.
- «History of Hinduism». BBC. Archivado desde el original el 9 de febrero de 2006. Consultado el 27 de marzo de 2006.
- McNeill, Willam H. (1999) [1967]. «Emergence and Definition of the Major Old World Civilizations to 500 B.C. (introduction)». A World History (4th ed. edición). New York: Oxford University Press. pp. 3-6. ISBN 0-19-511615-1.
- McNeill, Willam H. (1999) [1967]. «Europe’s Self-Transformation: 1500–1648». A World History (4th ed. edición). New York: Oxford University Press. pp. 317-319. ISBN 0-19-511615-1.
- McNeill, Willam H. (1999) [1967]. «The Dominance of the West (introduction)». A World History (4th ed. edición). New York: Oxford University Press. pp. 295-299. ISBN 0-19-511615-1.
- «Human Spaceflight and Exploration — European Participating States». ESA. 2006. Consultado el 27 de marzo de 2006.
- «Expedition 13: Science, Assembly Prep on Tap for Crew». NASA. 11 de enero, 2006. Consultado el 27 de marzo de 2006.
- The hydrogen hypothesis for the first eukaryote. Martin W, Muller M. Nature 1998, 392(6671):37-41.
- Animals and the invention of the Phanerozoic Earth system. Nicholas J.Butterfield. Trends in Ecology & Evolution. Elsevier, February 2011
Enlaces externos
- Richard A. Fortey, «A la medida», Revista de Libros, 147, marzo de 2009.
- Página de la BBC donde se muestra la historia de la Tierra resumida