Gorgonopsia
Gorgonopsiens
Une proposition de fusion est en cours entre Gorgonopsidae et Gorgonopsia. Les avis sur cette proposition sont rassemblés dans une section de Wikipédia:Pages à fusionner. Les modifications majeures apportées, entre-temps, aux articles doivent être commentées sur la même page.
![]()

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Synapsida |
| Ordre | Therapsida |
| Clade | Theriodontia |
Genres de rang inférieur
- † Aelurosaurus
- † Aloposaurus
- † Cyonosaurus
- † Eriphostoma
- † Nochnitsa
- † Viatkogorgon
- † Phorcys
- † Gorgonopsidae (Lydekker, 1890)
- † Arctognathus
- † Arctops
- † Cynariops
- † Lycaenops
- † Njalila
- † Suchogorgon
- † Smilesaurus
- † Gorgonops (type)
- † Sauroctonus
- † Scylacops (en)
- † Inostranceviinae
- † Rubidgeinae
- Taxons douteux ou incertains :
- † Cerdodon
- † Kamagorgon
- † Leogorgon
- † Wangwusaurus
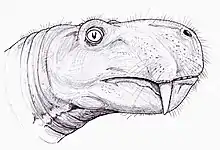
Les gorgonopsiens, de leur nom scientifique Gorgonopsia (du grec ancien Γοργόνες / gorgónes « gorgones » et ὄψ / óps « aspect », « yeux » ou « visage », pour donner littéralement « aspect de gorgone »), forment un sous-ordre éteint de thérapsides carnivores ayant vécu du milieu jusqu'à la fin du Permien, entre 265 et 252 millions d'années avant notre ère. Ils se caractérisent par un crâne long et étroit, ainsi que par des canines et des incisives supérieures et parfois inférieures allongées, les autres dents étant généralement réduites, voire absentes. Pour chasser des proies imposantes, ils auraient peut-être utilisé une tactique de morsure et de retraite, c'est-à-dire tendant une embuscade et prenant une bouchée débilitante de la cible, en leur suivant à une prudente distance attendant que les blessures infligées ne les épuisent, avant que les gorgonopsiens n'agrippent ces derniers en les mordant mortellement. Ils auraient eu une ouverture exorbitante de la mâchoire, probablement supérieure à 90°, sans avoir à décrocher la mandibule.
Leur taille augmentent considérablement au fil des périodes géologiques, passant des longueurs de crâne de 8 à 15 cm dans le Permien moyen à des proportions semblables à celles d'ours allant jusqu'à 60 cm durant le Permien supérieur. Les gorgonopsiens les plus récents, les rubidgeinés, sont les plus robustes du groupe et pouvaient produire des morsures particulièrement puissantes. Les gorgonopsiens seraient capables de marcher avec une démarche semi-dressée en plus d'une autonomie locomotrice terrestre similaire à celle des crocodiliens modernes. Ils seraient peut-être plus agiles que leurs proies mais seraient probablement des homéothermes inertiels plutôt que des endothermes, contrairement à leurs contemporains thérocéphales et cynodontes, et seraient donc probablement et relativement moins actifs. Bien que les gorgonopsiens serait capables de maintenir une température corporelle plutôt élevée, il n'est pas clair s'ils aurait également eu des glandes sudoripares ou de la fourrure, et par extension des vibrisses et des structures associées. Leurs cerveaux rappellent plus celui des reptiles que ceux des mammifères actuels. La plupart des espèces peuvent avoir été principalement diurnes, bien que certaines aient pu être également crépusculaires, voire nocturnes. Ils ont probablement eu une vision binoculaire, un œil pariétal (qui détecte la lumière du soleil et maintient le rythme circadien), un sens aigu de l'odorat, un organe voméronasal fonctionnel et éventuellement un tympan rudimentaire.
Les principaux groupes de thérapsides commencent à apparaitre vers 275 millions d'années à partir de leurs ancêtres nommée pélycosaures, un groupe mal défini comprenant tous les synapsides basaux. La prise de contrôle des thérapsides sur les pélycosaures a lieu durant le Permien moyen alors que la Terre devenait progressivement plus sec. Les gorgonopsiens deviennent les superprédateurs de leurs environnements à la suite d'une extinction de masse qui décime les dinocéphales et les grands thérocéphales. Malgré l'existence d'un seul supercontinent durant cette période, à savoir la Pangée, leurs fossiles ne sont trouvables que dans le continent africain, précisément dans le supergroupe du Karoo – incluant l'Afrique du Sud, la Tanzanie, la Zambie et le Malawi – ainsi qu'au Niger et la Russie européenne, avec des restes probables connus d'Inde. Ces endroits ont été identifiés comme des zones semi-arides ayant eu des précipitations très saisonnières. L'ensemble du groupe varient très peu en morphologie, de nombreux genres et espèces étant nommées sur la base de différences plus ou moins mineures et probablement liées à l'âge depuis leurs découvertes à la fin du XIXe siècle, ce qui fait que ce taxon fait l'objet de plusieurs révisions phylogénétiques.
Ils s'éteignent durant l'extinction Permien-Trias, au cours de laquelle une activité volcanique majeure, qui sont à l'origine des trapps de Sibérie, et un pic massif de gaz à effet de serre qui en résulte provoque une aridification rapide due aux pic de température, pluies acides, feux de forêts fréquents et une dégradation potentielle de la couche d'ozone. Leurs grandes niches prédatrices seront occupées plus tard par les archosaures, et plus précisément les dinosaures théropodes, durant le Mésozoïque.
Description
Description simplifié

Les premiers gorgonopsiens, qui datent du Permien moyen, sont assez petits, avec une longueur de crâne allant de 8 à 15 cm, tandis que certains genres ultérieurs atteignent des tailles massives similaire à des ours, le plus grand connu étant Inostrancevia, mesurant jusqu'à 3,5 mètres de longueur pour une masse corporelle de 300 kilos[1]. Néanmoins, les gorgonopsiens plus petits restent abondants jusqu'à leur extinction, bien que les petites espèces puissent en fait représenter des spécimens juvéniles d'autres taxons[2].
Comme les autres thérapsides du Permien, les gorgonopsiens se disposent de plusieurs caractéristiques « mammaliennes ». Celles-ci inclut une possible démarche parasagittale, les membres étant orientés verticalement et se déplaçant parallèlement à la colonne vertébrale, par opposition à la démarche tentaculaire des amphibiens et des synapsides antérieurs. Ce changement de démarche chez les thérapsides est peut-être lié à la réduction de la taille de la queue et de la formule phalangienne[3], le nombre d'os par doigt, qui pour les gorgonopsiens est de 2.3.4.5.3 comme les reptiles[4]. D'autres développements comprend l'os cortical lamellaire fibreux et les dents profondément enfoncées[3]. Comme les autres amniotes non euthériodontes, les gorgonopsiens ne possèdent pas de palais secondaire séparant la bouche de la cavité nasale, empêchant donc la mastication.
Crâne
L'anatomie varie très peu entre les gorgonopsiens[5]. De nombreuses espèces se distinguent par de vagues différences proportionnelles et, par conséquent, les espèces plus petites peuvent en fait représenter des juvéniles de taxons plus grands. Remarquablement, le vomer au bout du museau varie selon les espèces en termes de degré d'expansion, ainsi que les positions, le degré d'évasement et la forme des 3 crêtes[2]. Ils présentent généralement un crâne long et étroit[4]. Les juvéniles appartenant au genre Rubidgea semblent avoir des museaux plus larges que longs[6]. Contrairement aux euthériodontes, l'os occipital est rectangulaire, plus large que haut, et concave, par opposition à triangulaire[7]:279.
Le cerveau des gorgonopsiens, comme celui des autres thérapsides non mammaliaformes, ne possède pas d'expansion du néocortex et a un cerveau postérieur relativement grand par rapport au cerveau antérieur, un gros nerf épiphysaire, que l'on trouve chez les créatures avec un œil pariétal sur le dessus de la tête, une glande pituitaire, et une forme globalement allongée ; dans l'ensemble ressemblant à un cerveau « reptilien »[8]. La boîte crânienne est aussi de forme reptilienne et est comparativement plus petit et pas aussi épaisse que celles des mammifères[7]:280. Le floculus (un lobe du cervelet), est proportionnellement grand et est lié au réflexe vestibulo-oculaire (en), qui stabilise le regard tout en bougeant la tête. À en juger par l'orientation des canaux semi-circulaires dans l'oreille, qui doivent être orientés parallèlement au sol, la tête du spécimen du gorgonopsien catalogué GPIT/RE/7124 se serait inclinée vers l'avant d'environ 41°, augmentant le chevauchement entre les champs visuels des deux yeux et l'amélioration de la vision binoculaire, utile pour un prédateur. Contrairement aux reptiles ou aux mammifères, les canaux semi-circulaires sont plats, probablement parce qu'ils sont coincés entre les os opisthotiques (des os de l'oreille interne) et supraoccipitaux[8].
Dentition
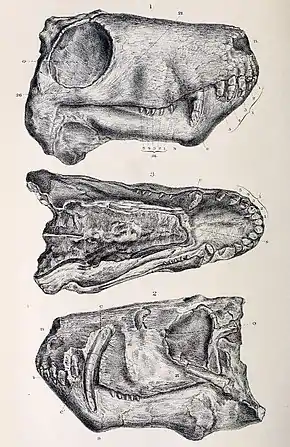
Comme de nombreux mammifères, les gorgonopsiens sont hétérodontes, avec des incisives, des canines et des dents postcanines clairement définies, homologues des prémolaires et des molaires[2]. Ils ont cinq incisives dans la mâchoire supérieure et quatre sur le bas[7]:17-18.
Chez la majorité des gorgonopsiens, les incisives sont grandes et les canines supérieures sont allongées, un peu comme celles des prédateurs à dents de sabre ultérieurs. Certains gorgonopsiens ont des canines supérieures exceptionnellement longues, comme Inostrancevia, et certains d'entre eux ont une collerette sur la mâchoire inférieure pour gainer la pointe de la canine lorsque la bouche est fermée. Les canines surdéveloppées sont généralement interprétées comme ayant été utilisées comme équivalent des armes tranchantes, ce qui aurait nécessité une ouverture extrêmement large. Les canines supérieures et inférieures de Rubidgea sont allongées et l'animal aurait eu besoin d'une ouverture encore plus grande[9]. Le modèle de denture des gorgonopsiens est plus similaire à celui des dinosaures théropodes qu'aux autres synapsides[10]. Le palais présente également des tubérosités et des crêtes qui ont souvent des dents fonctionnelles, qui peuvent avoir été utilisées pour retenir des proies en difficulté, détournant les forces puissantes des canines fragiles. Des crêtes similaires ont été également identifiées chez le machairodonte Homotherium[7]:280. Les dents postcanines sont réduites en taille et en nombre, de nombreux rubidgeinés n'ayant pas de postcanines dans la mâchoire inférieure[11], le genre Clelandina en manquant d'ailleurs totalement[6].
Les gorgonopsiens sont polyphyodontes (en), c'est-à-dire que leurs dents poussaient continuellement tout au long de leur vies[12]. Comme certains thérapsides, alors qu'il y a une canine fonctionnelle, une autre canine grandissait pour la remplacer quand elle se brisait inévitablement. Les côtés gauche et droit des mâchoires n'auraient donc pas besoin d'être synchrones. Ainsi, par exemple, la première canine du côté gauche pouvait être fonctionnelle tandis que la première canine du côté droit était encore en croissance[12]. Une telle méthode aurait pu être utilisée pour avoir toujours un ensemble de canines fonctionnelles, car avoir une seule ou aucune canine aurait gravement entravé la chasse, et la croissance de dents aussi grandes prendrait beaucoup de temps. D'un autre côté, étant donné que la canine fonctionnelle se trouve généralement dans l'alvéole dentaire la plus en avant (au lieu d'une occurrence égale dans une ou l'autre alvéole), il est possible que le remplacement des canines se soit produit un nombre limité de fois et que l'animal se retrouve finalement avec un seul ensemble permanent de canines fonctionnelles dans ces alvéoles. En 1984, les paléontologues britanniques Doris (en) et Kenneth Kermack (en) suggérent que les canines grandissaient pour correspondre à la taille du crâne et se cassaient continuellement jusqu'à ce que l'animal cesse de grandir, et que les gorgonopsiens présentaient une première version du remplacement dentaire présent chez de nombreux mammifères. Les modèles de remplacement des dents ne sont pas encore très clairs[9]. Les dents postcanines se font remplacer plus lentement que les autres dents, probablement en raison de leur manque de signification fonctionnelle[2].
Squelette postcrânien

Les sept vertèbres cervicales ont toutes la même taille sauf la dernière, qui est plus courte et plus basse. Comme chez les futurs prédateurs à dents de sabre, le cou est long avec des muscles bien développés, ce qui aurait été particulièrement utile pour enfoncer les canines dans la chair d'une proie. Comme les autres synapsides précoces, les gorgonopsiens ont un seul condyle occipital et l'articulation des vertèbres cervicales est globalement similaire à celle des reptiles, permettant un mouvement latéral de la tête mais limitant les mouvements de haut en bas. La dernière cervicale a plutôt la forme des vertèbres dorsales[7]:293–295.
Les vertèbres dorsales sont en forme de bobine et semblent toutes à peu près identiques les unes aux autres. Les apophyses épineuses dépassent fortement du centre et présentent des carènes acérées à l'avant et à l'arrière. Contrairement aux euthériodontes, les gorgonopsiens n'ont pas de vertèbres lombaires distinguées. Néanmoins, les vertèbres dorsales correspondant à cette série sont similaires aux lombaires des félins à dents de sabre avec des zygopophases fortement orientées, utiles pour stabiliser le bas du dos, en particulier lors de l'immobilisation de proies en difficultés[7]:293–295.
Il y a trois vertèbres sacrées, et la série attachée au bassin par la première vertèbre. Le bassin est de forme reptilienne, avec l'ilion, l'ischion et le pubis séparés. Le fémur est légèrement en forme de « S » et est court mais plus long et plus mince que l'humérus. Pour la plupart, le tibia et le péroné se courbent fortement l'un dans l'autre, et le tibia est plus robuste que le péroné[7]:295–299. L'articulation entre la cheville et les os du talon peut avoir été quelque peu mobile. Le cinquième doigt des pattes des gorgonopsiens n'est pas attaché au tarse, à la place il est connecté directement à l'os du talon[13].
Taxonomie
Sites fossilifères
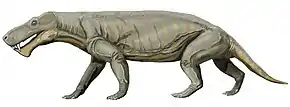
Les premiers restes de gorgonopsiens sont identifiés en 1876 dans le groupe de Beaufort, supergroupe du Karoo, en Afrique du Sud, par le célèbre biologiste et paléontologue britannique Richard Owen, ce dernier étant connu pour être à l'origine du terme « dinosaure ». Il classe les fossiles sous le nom Gorgonops torvus, combinant les mot du grec ancien Γοργόνες / gorgónes « gorgones », en références aux créatures de la mythologie grecque, et ὄψ / óps signifiant « aspect », « yeux » ou « visage »[14]. Dans le reste du continent africain, des gorgonopsiens sont également trouvables dans divers formations en Tanzanie, en Zambie et au Malawi[7]:7.
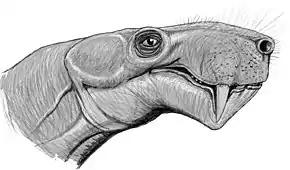
Les gorgonopsiens sont identifiés pour la première fois en Russie dans les années 1890 au sein la localité de Sokolki, sur la rivière Dvina septentrionale et sous la supervision du paléontologue Vladimir Prokhorovitch Amalitsky. Dans une publication publié à titre posthume, l'animal en question est décrit sous l'épithète spécifique d'Inostrancevia alexandri, qui n'est d'autre que l'un des gorgonopsiens les plus connus et les plus grands à avoir été découverts[15]. Depuis lors, seuls quelques autres genres russes sont décrits plus tard : Pravoslavlevia, Viatkogorgon, Suchogorgon et Nochnitsa[16]. Un des genres, Leogorgon, est désormais considéré comme un nomen dubium[6].
Les gorgonopsiens sont manifestement absents au-delà de ces deux zones[16]. En 1979, le paléontologue chinois Yang Zhongjian décrit une nouvelle espèce de potentiel gorgonopsien sous le nom de Wangwusaurus tayuensis, à partir des dents provenant de la formation chinoise de Jiyuan, datant du Permien supérieur[17]. Trois ans plus tard, en 1981, les paléontologues Denise Sigogneau-Russell et Ai-Lin Sun considèrent que les matériels assignées sont un assemblage aléatoire dont seulement deux ont même une similitude lointaine avec les celui des gorgonopsiens[18]. En 2003, les paléontologues indiens Sanghamitra Ray et Saswati Bandyopadhyay attribuent des fragments de crâne à un gorgonopsien de taille moyenne provenant de la formation indienne de Kundaram, datant également du Permien supérieur[19], bien que les caractéristiques de gorgonopsiens sont également documentées chez certains thérocéphales[16]. En 2008, un gros fragment d'une mâchoire supérieure et d'une canine provenant possiblement d'un rubidgeiné identifiés dans la formation de Moradi au Niger, datant du Permien supérieur, constitue la première preuve d'un gorgonopsien ayant vécu dans une zone de faible latitude[20].
Classification

Lors de sa découverte, Richard Owen présume que Gorgonops et plusieurs autres taxons qu'il a décrit du supergroupe du Karoo serait des reptiles à sang froid, bien qu'ils portent des dents ressemblant à celles des mammifères carnivores. Il propose donc de les classer tous sous le nouvel ordre Theriodontia, qu'il place dans la classe Reptilia. Il décide de subdiviser les thériodontes en trois groupes basées sur l'anatomie des narines : « Mononarialia » pour ceux avec une ouverture dans le crâne pour le nez comme chez les mammifères, « Binarialia » pour ceux avec deux ouvertures comme chez les reptiles, et « Tectinarialia » pour Gorgonops car son ouverture est éclipsée par un épais toit en os[14],[21]. En 1890, le naturaliste anglais Richard Lydekker fait de Gorgonops le genre type de la famille des Gorgonopsidae[22]. En 1895, le paléontologue britannique Harry Seeley croit que Gorgonops manque d'une ouverture dans l'os temporale, qui est une caractéristique diagnostique de Theriodontia et ramène ainsi Gorgonopsidae à Gorgonopsia, tout en le distinguant de Theriodontia. Il classe tous les matériaux sud-africains portant à la fois des traits reptiliens et mammaliens dans l'ordre « Theriosuchia » et considère les taxons Gorgonopsia et Theriodontia comme sous-ordres de ce dernier[23]. Le paléontologue américain Henry Fairfield Osborn retravaille complètement la classification de Reptilia en 1903, et érige deux grands sous-groupes : Diapsida et Synapsida[24]. En 1905, le paléontologue sud-africain Robert Broom crée un troisième groupe, Therapsida, pour abriter les « reptiles mammaliens », y compris le taxon Theriodontia. Il conteste également la revendication de Seeley et relègue Gorgonops à Theriodontia, mais il le place dans son sous-groupe nouvellement érigé Therocephalia, faisant de Gorgonopsia un taxon poubelle[25]. En 1913, surtout à la lumière d'un crâne presque complet de G. torvus découvert par le révérend John H. Whaits, Broom rétablit Gorgonopsia comme un taxon valide[26].
Le nombre de genres sud-africains augmente rapidement au cours du XXe siècle, dirigé principalement par Broom, dont les travaux approfondis sur les thérapsides du Karoo, depuis le début de sa carrière dans le pays en 1897 jusqu'à sa mort en 1951, conduisent à la description de 57 spécimens d'holotype de gorgonopsiens et de 29 genres. De nombreux taxons de Broom seront plus tard invalidés[27]. Beaucoup d'autres travailleurs contemporains nomment des espèces ou des genres entièrement nouveaux basés sur des spécimens uniques[7]:57. Par conséquent, les gorgonopsiens font l'objet de beaucoup de révisions taxonomiques et en fait donc l'un des groupes de synapsides les plus problématiques, en raison du fait que l'anatomie des crânes diffèrent très peu d'un genre à l'autre, beaucoup étant définis sur la base de vagues différences proportionnelles, y compris même les membres bien connus. Les espèces nominales se distinguent principalement par des traits connus pour être assez variables en fonction de l'âge de l'individu, notamment la taille de l'orbite oculaire, la longueur du museau et le nombre de dents postcanines. Ainsi, il est possible que certains taxons soient synonymes les uns des autres et que les spécimens référencés représentent différents stades de développement[28].
L'une des premières tentatives d'organisation du groupe est réalisée par le zoologiste britannique David Meredith Seares Watson et le paléontologue américain Alfred Romer en 1956, qui les divise en vingt familles, dont trois membres (Burnetiidae, Hipposauridae et Phthinosuchidae) ne sont plus considérés comme des gorgonopsiens[6]. En 1970 et encore en 1989, considérant principalement les taxons africains, Denise Sigogneau-Russell publie une monographie complète sur le taxon Gorgonopsia (le définissant comme un infra-ordre), et ne reconnait que deux familles : Watongiidae et Gorgonopsidae. Watongia est plus tard transféré chez les Varanopidae en 2004. Elle divise les Gorgonopsidae en trois sous-familles : Gorgonopsinae, Rubidgeinae et Inostranceviinae, et en réduit le nombre de genres à 23[29]. En 2002, le paléontologue Mikhail F. Ivakhnenko, considérant les taxons russes, considère plutôt Gorgonopsia comme un sous-ordre et le regroupe avec les Dinocephalia dans l'ordre « Gorgodontia ». Il divise les Gorgonopsia en deux super-familles : « Gorgonopsioidea », contenant les familles Gorgonopsidae, Cyonosauridae et Galesuchidae, et « Rubidgeoidea » contenant les Rubidgeidae, Phtinosuchidae et Inostranceviidae. En 2007, la biologiste Eva V. I. Gebauer, dans sa revue complète des gorgonopsiens (sa thèse de doctorat), rejette le modèle d'Ivakhnenko en faveur de celui de Sigogneau-Russell, et réduit encore le nombre de genres à 14 en plus des genres russes : Aloposaurus, Cyonosaurus, Aelurosaurus, Sauroctonus, Scylacognathus, Eoarctops, Gorgonops, Njalila, Lycaenops, Arctognathus, Aelurognathus, Sycosaurus, Clelandina et Rubidgea[7]:244. En général, le modèle de Sigogneau-Russell est supporté, mais il y a peu de consensus sur quels genres peuvent être attribués à quelles sous-familles[6]. En 2015, le paléontologue américain Christian F. Kammerer et ses collègues reclassent Eriphostoma, longtemps considéré comme un thériodonte indéterminé, au sein des gorgonopsiens[30] et le rendent synonyme avec Scylacognathus et l'année suivante avec Eoarctops[6].
La première phylogénie des membres des gorgonopsiens est publiée en 2016, toujours par Kammerer, qui étudie spécifiquement les rubidgéinés, et redécrit à la fois la sous-famille et les 9 espèces qu'il attribue, en réduisant le nombre de 36 espèces. Kammerer rend également valide les genres Dinogorgon, Leontosaurus, Ruhuhucerberus et Smilesaurus. Ce dernier étant rétissant à savoir si Leontosaurus, Clelandina, Dinogorgon et Rubidgea représentent tous le même taxon ou non, pour lequel Dinogorgon a la priorité, décide de les classer tous dans la tribu Rubidgeini en attendant un examen plus approfondi[6]. En 2018, Kammerer et le paléontologue russe Vladimir Masyutin identifie le nouveau genre Nochnitsa comme étant le gorgonopsien le plus basal connu et découvre que tous les taxons russes ultérieurs, à l'exception de Viatkogorgon, forment un clade complètement séparé des taxons africains[16]. Toujours en 2018, la paléobiologiste Eva-Maria Bendel, Kammerer et ses collègues rendent valide le genre Cynariops[2]. En 2022, Kammerer et son collègue paléontologue Bruce S. Rubidge décrivent Phorcys, l'un des plus vieux gorgonopsiens identifié à ce jour, connu d'Afrique du Sud[31].
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cladogramme du taxon Gorgonopsia selon Bendel et al. 2018[2]. |
Histoire évolutive
Le taxon Synapsida est traditionnellement divisée en « Pelycosauria » pour les taxons basaux et Therapsida pour les plus dérivées. Le premier comprend des créatures à sang froid avec une démarche tentaculaire et un métabolisme vraisemblablement plus faible qui apparaissent au Carbonifère supérieur. Du milieu à la fin du XXe siècle, le paléontologue américain Everett C. Olson (en) étudie la diversité des synapsides du Permien moyen en Amérique du Nord. Il note que la diversité des pélycosaures est réduite de six à trois dans ces formations, et qu'ils coexistent avec plusieurs spécimens fragmentaires qu'il interprète comme appartenant à celles des thérapsides. Il suggère ensuite que le passage adaptatif du grade pélycosaure au grade thérapside aurait lieu au cours du Permien moyen. Cependant, la classification de ces « thérapsides » et l'âge des formations sont fortement contestés. Ainsi, le moment exact de la prise de contrôle des thérapsides n'est pas clair, mais les six principaux groupes de thérapsides (Biarmosuchia, Dinocephalia, Anomodontia, Gorgonopsia, Therocephalia et Cynodontia) semblent apparaitre entre 270 et 265 millions d'années[32]. Le plus ancien spécimen de gorgonopsien connu est un museau partiel appartenant à un genre indéterminée provenant de la zone d'assemblage supérieure d'Eodicynodon (en) du supergroupe du Karoo, datant approximativement du Wordien. Le genre Phorcys datant de l'extrémité la plus basse de la zone d'assemblage supérieure de Tapinocephalus (en), c'est-à-dire à peu près plus tard de la limite Wordien/Capitanien, est le plus ancien taxon de gorgonopsien identifié à ce jour[31].
| |||||||||||||||||||||||||||||||||||||||
| Position phylogénétique simplifiée des gorgonopsiens au sein des synapsides[32]. |

Le Permien devient progressivement une période de plus en plus sèche. Au Carbonifère supérieur et au Permien inférieur, les pélycosaures semblent s'adapter à des marais de charbon toujours humides (en) des habitats proches de l'équateur (fossiles connus à moins de 10 °C de part et d'autre de l'équateur). Au-delà, jusqu'à environ 30 °C, se trouvait un vaste désert qui s'étendait jusqu'à la côte, séparant les marécages des régions tempérées. Au Permien moyen, les forêts équatoriales passent à un système saisonnier humide/sec, mais les marécages sont reliés aux zones tempérées par des passages côtiers le long de la Pangée orientale, permettant la migration transcontinentale de ce qui est maintenant l'Afrique du Sud vers ce qui est maintenant la Russie. Les thérapsides semblent avoir évolué dans ce paysage saisonnier, s'étendant même dans les zones tempérées. À ce stade, les thérapsides sont les seuls grands animaux terrestres de leurs environnements et les pélycosaures n'aurait peut-être pas été capables de s'adapter à l'aridification. Peu près l'extinction des pélycosaures, les thérapsides connaissent une adaptation majeure se poursuivant durant le Permien supérieur[32].
Tout au long du Permien moyen, les dinocéphales, souvent de grandes tailles, sont les animaux dominants de leurs écosystèmes. Ils disparaissent des archives fossiles au cours de l'extinction du Capitanien (en), causé par l'activité volcanique qui a formé les trapps d'Emeishan (en) en actuelle Chine. La cause exacte de leur extinction n'est pas claire, mais ils sont remplacés par les gorgonopsiens et les dicynodontes (qui commence à augmenter considérablement en taille durant le Trias) et les plus petits thérocéphales[33]. Les rubidgeinés sont les gorgonopsiens les plus dérivés, et par conséquent parmi les plus massifs et les plus lourdement bâtis du groupe[6].
Paléobiologie
Morsure

Les gorgonopsiens étaient probablement des prédateurs actifs. Les rubidgeinés ont un crâne spécialement construit chez les gorgonopsiens, comparable à ceux d'énormes superprédateurs qui aurait utilisées leur crâne comme arme principale, comme chez les mosasaures ou certains dinosaures théropodes. Les gorgonopsiens moins robustes avec une morsure beaucoup plus faible et des canines plus longues, comme Smilesaurus ou Inostrancevia, utilisaient probablement plutôt ces dernières pour tailler, tactique probable de certains félins à dents de sabre. Les dent postcanines de Clelandina ont été remplacées par une crête lisse contrairement aux dicynodontes qui ont une crête kératinique en forme de lame et il se peut qu'ils se soient attaqués principalement à des proies qu'ils pouvaient avaler en entier. Les taxons de gorgonopsiens coexistaient les uns avec les autres (jusqu'à sept à la fois) et le fait que certains rubidgeinés possèdent des postcanines alors que d'autres contemporains ne suggèrent pas qu'ils pratiquaient la partition de niche, indique que ces derniers poursuivaient différents types de proies[6].
Les chercheurs généralement que les canines allongées aurait joué un rôle dans leurs tactiques de chasse. Leurs charnières de mâchoires étaient à double articulation et composées d'os quelque peu mobiles et rotatifs, ce qui leur aurait permis d'ouvrir la bouche de manière remarquablement large, peut-être plus de 90°, sans avoir à décrocher la mâchoire[34]. Il a alternativement été suggéré, d'abord en 2002 par les biologistes Blaire Van Valkenburgh et Tyson Secco, mais en référence aux félins, que les canines ont évolué principalement en raison de la sélection sexuelle comme forme de parade nuptiale. Cela est présent chez certaines espèces de cerfs modernes, mais est difficile à tester étant donné le manque de prédateurs synapsides vivants à dents de sabre. Chez les machairodontes, on pense que les taxons à long sabre (« dents de poignard ») étaient des chasseurs de poursuite, tandis que les taxons à dents courtes (« dents de cimeterre ») auraient été des prédateurs en embuscade[35]. Parmi les félins à dents de cimeterre, il est suggéré que ces prédateurs tuaient avec une entaille bien placée à la gorge après avoir attrapé une proie, mais les gorgonopsiens ont peut-être été moins précis avec le placement des morsures, armés de mâchoires « reptiliennes » et de dispositions dentaires. Au lieu de cela, les gorgonopsiens ont peut-être utilisé une tactique de morsure et de retraite : le prédateur tendait une embuscade à sa proie et en prenait une morsure importante et débilitante, puis suivait la proie tentant de s'échapper avant de succomber à sa blessure, après quoi le gorgonopsien livrait une morsure mortelle. En raison du fait que les dents postcanines sont réduites ou totalement absentes, la viande aurait été arrachée de force de la carcasse et avalée entière[34]. On suppose aussi que cette stratégie de « piqûre-tirer » a été également utilisée par les dinosaures théropodes[10].

Les gorgonopsiens, ainsi que d'autres carnivores primitifs et des crocodiliens, s'appuyaient principalement sur le « système cinétique-inertiel » (KI) pour mordre leurs proies, dans lequel les muscles temporals serraient rapidement les mâchoires fermées, en utilisant l'élan et l'énergie cinétique des mâchoires et des dents pour saisir la victime. Les mammifères carnivores, y compris les ceux à dents de sabre, s'appuient principalement sur le « système de pression statique » (SP) où les muscles temporaux produisent une forte force de morsure pour tuer les proies[11]. Le muscle temporal ne s'était séparé que chez les mammifères, et les gorgonopsiens avaient plutôt un muscle s'étendant de la face inférieure du toit du crâne, jusqu'à l'os squamosal (situé à l'arrière du crâne) et à travers les joues. La partie ancrée par les joues stabilisait la mâchoire et lui permettait de se déplacer latéralement lors de la fermeture. Cela a peut-être été très important pour mordre, car les pommettes deviennent plus fortes en même temps que les canines s'allongent[7]:278.
Les gorgonopsiens plus petits, tels que Cyonosaurus, avaient des crânes et des canines graciles, et peuvent avoir agi un peu comme des chacals et des renards. Les gorgonopsiens plus gros, comme Gorgonops, avaient un long museau robuste avec des joues fortement évasées, qui auraient supporté de forts ptérygoïdes et une puissante morsure. Arctognathus, qui est un gorgonopsien de taille moyenne, avait un crâne en forme de boîte et un museau puissant, ce qui aurait permis de forts mouvements de flexion et de torsion ainsi qu'une combinaison d'éléments de morsure KI et SP. Même de gros gorgonopsiens, comme Arctops, avaient un museau plus court et plus convexe comme le célèbre sphénacodonte Dimetrodon et auraient pu serrer rapidement les mâchoires fermées à partir d'un large écartement (ce qui aurait été nécessaire compte tenu des longues canines). Les rubidginés, de plus grande taille, avaient des crânes à contreforts extrêmement puissants, fortement construits, avec un museau large, des joues fortement rebordées et des dents extrêmement longues, les canines de Rubidgea atrox étant plus longues que les dents de Tyrannosaurus[11].
Contrairement aux mammifères carnivores, les gorgonopsiens et les thérocéphales avaient des postcanines réduites ou complètement absentes, et la mâchoire ne pouvait probablement pas exercer la pression de cisaillement nécessaire pour écraser les os ouverts afin d'accéder à la moelle osseuse[36]. Il n'a pas été clair si la moelle osseuse avait encore évolué chez les synapsides du Permien (les poissons et de nombreux amphibiens en manquent de nos jours), mais en 2021, il a été prouvé que des reptiliomorphes datant du Cisuralien, Seymouria et Discosauriscus, avaient probablement une moelle osseuse hématopoïétique dans leurs membres[37].
Locomotion

Les gorgonopsiens sont considérés comme des animaux ayant un mode de vie strictement terrestre[38]. On pense[Qui ?] qu'ils ont pu se déplacer avec une démarche dressée similaire à celle utilisée par les crocodiliens, les membres étant positionnés presque verticalement par opposition à horizontalement comme dans la démarche tentaculaire des lézards. La cavité glénoïde de l'omoplate est fortement inclinée vers la queue, de sorte que les membres avaient un mouvement vers l'avant limité et qu'ils pouvaient avoir une courte longueur de foulée. Les lézards déplacent souvent leur colonne vertébrale d'un côté à l'autre pour augmenter la longueur de la foulée, mais les articulations facettaires plus verticales reliant les vertèbres chez les gorgonopsiens auraient rendu la colonne vertébrale plus rigide et stable, gênant un tel mouvement[7]:259–260.
L'articulation de l'épaule des gorgonopsiens a une configuration très inhabituelle. La tête humérale qui se connecte à l'épaule est plus longue que la glène, elle ne pourrait donc pas entrer dans la cavité. Par conséquent, ils peuvent avoir été attachés avec une grande masse de cartilage, l'humérus effectuant un mouvement de roulement sur la glène. Cela pourrait théoriquement faire en sorte que l'angle entre l'humérus et la glène soit compris entre 80 et 145° face à l'animal. Si l'angle était sur l'extrémité inférieure, cela aurait été un joint plutôt ferme, permettant aux muscles deltoïdes d'exercer une grande force à travers le membre antérieur, par exemple en immobilisant une proie en difficulté ou en tenant une carcasse tout en arrachant la chair. Si l'humérus était positionné à un angle plus élevé, cela aurait pu permettre une extension accrue vers l'avant et vers l'arrière (le long du grand axe) et donc une plus grande longueur de foulée, utile dans une attaque ou de courtes poursuites. L'omoplate s'étend sur les côtés latéraux de l'animal, fournissant également une grande attache pour les deltoïdes. Tous les muscles scapulo-huméraux avaient des attaches fortement développées, en particulier les deltoïdes. Lors de l'extension des membres antérieurs, les deltoïdes peuvent avoir soulevé la face avant (marge antérieure) de l'humérus, et le muscle coracobrachial a abaissé la face arrière (marge postérieure). Lors de la rétraction du membre antérieur, le muscle pectoral peut avoir poussé le bord antérieur vers le bas et le muscle subscapulaire a tiré le bord postérieur vers le haut.
L'articulation du bassin a la configuration habituelle des articulations sphéroïdes. La tête fémorale quelque peu aplatie aurait pu théoriquement s'insérer dans la cavité de la hanche à un large éventail d'angles. En 1982, le paléontologue Tom S. Kemp a suggéré que les premiers thériodontes, y compris les gorgonopsiens, pouvaient placer le fémur à la fois à un angle horizontal dans une démarche tentaculaire, ainsi qu'à un angle plus vertical dans une démarche dressée. Il a comparé les habitudes locomotrices de ces créatures à celles des crocodiliens, qui utilisent une démarche tentaculaire sur de courtes distances, mais passent à une démarche droite lorsqu'ils courent ou se déplacent sur de plus longues distances. Bien que la hanche de Sauroctonus semble être anatomiquement un intermédiaire entre celui de Dimetrodon et celle les mammifères disposant un ilium, ce dernier s'est élargi davantage vers la tête que vers la queue, et le pubis réduit quelque peu le muscle puboischiofémoral (un muscle volumineux porté uniquement par les reptiles qui va du bassin au fémur) largement attaché à la face inférieure du pubis et de l'ischion, qui aurait permis de produire une forte force d'adduction (rapprochant les jambes du corps), utile dans une démarche tentaculaire. Il est également concevable que les gorgonopsiens aient principalement engagé ce muscle tout en s'attaquant à des proies en difficulté[7]:264–270. Les tibias sont relativement courts par rapport au fémur, ce qui suggère que les gorgonopsiens n'étaient pas adaptés pour courir sur de longues distances[7]:298–299.

En ce qui concerne la façon dont les pieds étaient placés au sol, les gorgonopsiens sont les seuls premiers thérapsides qui présentent une ectataxonie (le dernier chiffre porte le plus de poids), une homopodie (les empreintes de pied et de main se ressemblent) et une semi-plantigradie (dans une certaine mesure, les pieds étaient posés à plat sur le sol)[39]. Ces adaptations ont peut-être rendu les gorgonopsiens plus rapides et plus agiles que leurs proies[34]. Les gorgonopsiens avaient des doigts plutôt agiles, indiquant une capacité de préhension à la fois pour les mains et les pieds, peut-être pour saisir des proies en difficulté afin d'éviter une charge excessive et la fracture ou la rupture consécutive des canines pendant qu'elles étaient enfoncées dans la victime[13].
Sens

Contrairement aux euthériodontes, mais comme certaines créatures ectothermes d'aujourd'hui, tous les gorgonopsiens possèdent un œil pinéal au sommet de la tête qui est utilisé pour détecter la lumière du jour et donc la température optimale pour être actif. Il est possible que d'autres thériodontes ne le possèdent pas en raison de l'évolution de l'endothermie, des cellules ganglionnaires rétiniennes intrinsèquement photosensibles dans les yeux, en tandem avec la perte de la vision des couleurs et un passage à la vie nocturne, voire les deux[40]. Il a été longtemps été supposé que le comportement nocturne serait exclusif aux mammifères, mais la grande taille de l'orbite et la présence d'anneaux sclérotiques chez de nombreux synapsides primitifs, remontant aussi loin que le Carbonifère, suggèrent que la capacité de s'aventurer dans des conditions de faible luminosité est apparue beaucoup plus tôt. Sur la base de ces aspects, Sauroctonus parringtoni pourrait avoir eu une vision mésopique, et Cyonosaurus une vision scotopique ou photopique[41]. Les diamètres des anneaux sclérotiques du petit Viatkogorgon sont proportionnellement grands, avec un diamètre intérieur de 1,5 cm et un diamètre extérieur de 2,3 cm, par rapport à un diamètre de 2,8 cm pour l'orbite en elle-même, ce qui suggère que l'animal faisait des excursions principalement nocturnes[16]. Le rubidgeiné Clelandina possède des anneaux sclérotiques inhabituellement petits, indiquant qu'il a une vision photopique et qu'il serait strictement diurne. Kammerer suggère que la division de niche parmi les rubidgeinés prendrait la forme d'espèces différentes étant actives à différents moments de la journée, mais en raison du fait que seuls les anneaux sclérotiques de Clelandina au sein cette sous-famille ont été identifiés, cette hypothèse reste spéculative jusqu'à preuve du contraire[6].
Les gorgonopsiens ont une cavité nasale plutôt courte, comme les pélycosaures, mais elle présente d'abondantes crêtes longitudinales situés derrière les narines internes qui relient la cavité nasale à la gorge. En raison du fait que l'air respiré ne les traverse pas, ceux-ci sont généralement interprétés comme étants des cornets olfactifs qui donnerait aux gorgonopsiens un sens de l'odorat assez développé[42]. Les gorgonopsiens possèdent un organe voméronasal qui est placé à la base de la cloison nasale et contrairement aux dicynodontes et aux thérocéphales, il semble y avoir un canal reliant l'organe à la bouche, indiquant qu'il serait fonctionnel chez les gorgonopsiens[43].
Les premiers thériodontes, y compris les gorgonopsiens, peuvent avoir possédé un tympan, contrairement aux premiers pélycosaures, ce qui est indiqué par la réduction de la connexion entre l'os carré, situé au niveau de la charnière de la mâchoire, et l'os ptérygoïdien, placé au palais, permettant au carré de vibrer indépendamment pour un degré. Cela permet la détection de sons aériens d'une faible amplitude inférieure à 1 mm, mais le tympan aurait été soutenu par du cartilage ou des ligaments au lieu d'os. Si cela s'avère correct, alors les os postdentaires (qui, chez les premiers mammifères, forment l'oreille moyenne) se détacheraient du dentaire (mâchoire). Les archives fossiles semblent indiquer que la connexion postdentaire-dentaire est réduite chez le gorgonopsiens. Cependant, étant donné les spécialisations requises pour mordre, la condition d'un carré isolant chez les gorgonopsiens pourrait alternativement être expliquée comme une streptostylie (carré rotatif) afin d'élargir la béance plutôt que de faciliter l'audition[3].
Thermorégulation
Un changement anatomique majeur s'est produit entre les premiers pélycosaures et les thérapsides, qui est supposé avoir été lié à un métabolisme croissant et aux origines de l'homéothermie. L'évolution d'un palais secondaire et la séparation de la bouche de la cavité nasale peuvent avoir augmenté l'efficacité de la ventilation associée à des niveaux élevés d'activité aérobie. Les gorgonopsiens n'avaient pas de palais secondaire osseux, mais avaient peut-être un palais de tissus mous, voire qu'il est également possible que ce soit principalement pour le comportement alimentaire à la place[pas clair]. La réorganisation du squelette (d'une démarche tentaculaire à une démarche parasagittale) a été postulée pour indiquer la présence d'un diaphragme, et donc également une ventilation améliorée pour l'activité d'aérobie ; mais cela aurait pu plutôt avoir pour finalité d'augmenter l'accélération ou l'agilité, ce qui n'équivaut pas nécessairement à une activité aérobie intense, un peu comme chez les crocodiles. L'os cortical lamellaire fibreux, que possédaient tous les premiers thérapsides, indiquerait un taux de croissance accru, mais cela peut ne pas être lié au taux métabolique[44].
Les grands reptiles modernes dégagent naturellement de la chaleur corporelle à un rythme plus lent que les plus petits et sont considérés comme des « homéothermes inertiels », mais ils maintiennent une température corporelle basse de 25 à 30 °C. Si les thérapsides nécessitaient une température corporelle plus élevée de 35 à 40 °C, ils auraient dû être soit des endothermes (générant leur propre chaleur corporelle), soit avoir eu un meilleur contrôle sur la perte de chaleur (c'est-à-dire une meilleure homéothermie). La démarche parasagittale a peut-être aidé ce dernier, car elle aurait maintenu la majeure partie du corps hors du sol et aurait permis au sang de rester dans l'abdomen au lieu d'avoir à circuler à travers les appendices, ce qui réduirait le transfert de chaleur au sol et stabilise la température à cœur. La queue réduite aurait également réduit la surface totale de l'animal, minimisant davantage les pertes de chaleur[45]. Parmi les thérapsides, seuls les euthériodontes (clade n'incluant pas les gorgonopsiens) ont des cornets nasaux respiratoires, qui aident à retenir l'humidité tout en respirant de grandes quantités d'air, et leurs évolution est généralement associée au début des taux de consommation d'oxygène dite « mammalienne » et aux origines de l'endothermie[42].
Si les gorgonopsiens étaient des homéothermes inertiels, il n'est pas impossible qu'ils aient eu de la fourrure. Leur museau est généralement criblé de foramens, ce qui pourrait potentiellement indiquer l'existence d'une peau lâche (par opposition aux écailles), de poils, de diverses glandes cutanées (telles que les glandes sudoripares) et des vibrisses. Cependant, certains reptiles présentent une structuration similaire des foramens, qui sont plutôt liés au développement dentaire plutôt qu'à celle de la peau[46].
Paléopathologie


L'aspect antérolatéral du radius gauche de l'échantillon du gorgonopsien catalogué NHCC LB396 présente une lésion osseuse circulaire, comportant des pointes irrégulières à radiales (en) constituées d'os cortical entouré d'une fine couche de périoste, qui se serait développée rapidement sur une seule saison de croissance. Ceci est cohérent avec une périostite résultant très probablement d'un hématome sous périosté. Cet état spécifique ainsi que le taux de croissance rapide rappellent davantage les mammifères et les dinosaures que les crocodiliens ou les varans. Parmi les synapsides précoces, la seule autre pathologie notée est l'ostéomyélite dans plusieurs groupes de pélycosaures[47].
Le côté labial de la racine dentaire d'une canine fonctionnelle du spécimen catalogué RB382 présente jusqu'à 8 lésions, groupées le long de la ligne médiane de la dent, qui ressemblent à des dents miniatures avec une pulpe, une dentine et une fine couche d'émail. Elles sont à peu près circulaires, avec des diamètres variant de 0,3 à 3,9 mm, bien qu'elles deviennent moins circulaires autour du point médian de la racine jusqu'au passage du col de la dent. Ceci est à peu près cohérent avec l'odontome (en) humain, le type de tumeur odontogène (en) le plus fréquent, qui ne s'étendait auparavant que quelques millions d'années dans les archives fossiles. Âgé de 255 millions d'années, RB382 représente le plus ancien cas connu d'odontome[48].
Le museau fossile du spécimen SAM-PK-11490, provenant d'une espèce indéterminée de gorgonopsien datant du Permien moyen, possède une dent incrustée d'un animal non identifiable. L'os a développé un cal osseux autour de la dent, indiquant qu'il aurait guéri et que l'individu a survécu à l'attaque. La blessure provient soit d'un prédateur (à savoir un biarmosuchien, un dinocéphale, un thérocéphale voire un autre gorgonopsien), soit d'une morsure intraspécifique du visage comme c'est généralement le cas chez les prédateurs sociaux, tels que les grands félins ou les varans. Les morsures sociales visent à affirmer la domination ou à faciliter la reproduction et, si elles sont correctes, suggèrent qu'au moins certains gorgonopsiens du Permien moyen serait des carnivores sociaux. La dent étant initialement négligée, il est donc difficile de savoir à quel point cette pathologie serait courante[49].
Paléoécologie
Environnement

Après l'extinction des dinocéphales et des grands thérocéphaliens basaux appartenant aux familles des Scylacosauridae et des Lycosuchidae, les gorgonopsiens passent de formes petites et peu communes à de robustes superprédateurs. Du Guadalupien au Lopingien, en actuelle Afrique du Sud, les dicynodontes étaient les animaux les plus communs, tandis que les paréiasaures Deltavjatia et Scutosaurus sont les plus abondants dans les formations russes[50]. Au cours du Permien supérieur, le groupe sud-africain de Beaufort formait une steppe froide semi-aride caractérisée par de grandes étendues saisonnières, les rivières et les plaines inondables drainant des sources d'eau beaucoup plus au nord dans la mer du Karoo, avec quelques occurrences de crues soudaines après de fortes pluies[51],[52], la distribution des carbonates étant cohérente avec les dépôts de caliches actuels qui se forment dans des climats avec une température moyenne de 16 à 20 °C et 100 à 500 mm de précipitations saisonnières[52]. Une formation contenant des gorgonopsiens à l'ouest de la Russie se serait également et probablement déposée dans un environnement semi-aride avec des précipitations très saisonnières, comportant des plantes hygrophytes et halophytes dans des zones côtières ainsi que des conifères plus résistants à la sécheresse à des altitudes plus élevées[53]. La formation de Moradi, situé au nord-ouest du Niger, était un désert aride principalement dominé par des sauropsides tels que le captorhinidé Moradisaurus et le paréiasaure Bunostegos[20]. Il comporte le taxon éteint de conifères Voltziales et est comparé au point de vue environnemental aux actuels désert du Namib et bassin du lac Eyre[54].
Disparition
Les gorgonopsiens s'éteignent durant la fin du Lopingien lors de l'extinction Permien-Trias, principalement à cause des activités volcaniques qui sont à l'origine des trapps de Sibérie. Le pic massif de gaz à effet de serre qui en résulte provoque une rapide aridification due à un pic de température (jusqu'à 8-10 °C à l'équateur, avec des températures équatoriales moyennes de 32-35 °C au début du Trias), des pluies acides (avec un pH aussi bas que 2 ou 3 pendant l'éruption et 4 dans le monde, et la pénurie subséquente de forêts pendant les 10 premiers millions d'années du Trias), les feux de forêt fréquents (bien qu'ils sont déjà assez communs durant tout le Permien) et une rupture potentielle de la couche d'ozone (éventuellement en augmentant brièvement le bombardement de rayonnement UV de 400 % à l'équateur et de 5 000 % aux pôles)[55]. Parmi les thérapsides, les thérocéphales de petite taille et des grands anomodontes réussissent à traverser la limite Permien-Trias et survivent respectivement jusqu'au Trias moyen et supérieur, mais seul les cynodontes de petite taille survivent au-delà du Jurassique, dont les descendants donneront plus tard naissance aux mammifères. Les niches laissées ouvertes par les gorgonopsiens seront comblées par les archosaures, notamment les premiers dinosaures théropodes, durant les premiers stades du Trias[56].
Culture populaire
Les gorgonopsiens forment l'un des groupes de thérapsides non mammaliens les plus connus du grand public et constitue un large imaginaire des faunes de la fin du Paléozoique, apparaissant principalement dans des documentaires et parfois même dans la science-fiction, souvent imagé par Inostrancevia, bien que de rares exceptions sont aussi présentes :
- un Gorgonops longifrons apparaît dans le premier épisode de la première saison de Nick Cutter et les Portes du temps, ou il s'attaque à un prédateur du futur, la série étant basée sur le thème du voyage dans le temps[57] ;
- le documentaire d'animation produit par la National Geographic, Il était une fois notre planète, montre un Inostrancevia en train de chasser un Scutosaurus[58] ;
- des Inostrancevia apparaissent dans une séquence mettant en scène l'extinction Permien-Trias dans le documentaire Le Royaume des dinosaures[59] ;
- un couple de Lycaenops apparaissent dans le cinquième épisode de la série Les Portes du temps : Un nouveau monde[60] ;
- une espèce non identifié est relatée dans le troisième épisode du documentaire Animal Armageddon[61] ;
- une des gorgonopsiens présent dans la sixième séquence du documentaire Sur la terre des géants. Bien que le sources officiels disent qu'ils appartiennent au genre Gorgonops, l'animal est représenté avec une morphologie similaire à Inostrancevia, en raison du fait que le narrateur les décrit avec des caractères attribués exclusivement à cet animal, notamment pour lieu ou ils vivent, le fait qu'ils chassent des Scutosaurus (connu de Russie et non d'Afrique du Sud, endroit d'où est connu Gorgonops) ainsi que par la taille des canines[62] .
Notes et références
Notes
- e, cervelet ; cnI, nerf olfactif ; cnV + vcm, nerf trijumeau et veine de la tête médiale ; cnVI, nerf abducens ; cnVII, nerf facial ; cnIX-XI, nerf glossopharyngien et vagoaccessoires ; cnXII, nerf hypoglosse ; en, nerf épiphysaire ; fb, cerveau antérieur ; fcl, floculus ; ibic, branche interne de la carotide interne ; lob, bulbe olfactif gauche ; ob, bulbe olfactif ; ot, tractus olfactif ; pg, glande pituitaire ; pgll, lobes latéraux de l'hypophyse ; pf, flexion pontine ; rob, bulbe olfactif droit ; vc, nerf du canal ptérygoïdien ; vc=spa, canal vidien où passe l'artère sphénopalatine ; vcd, veine dorsale de la tête.
Références
- (en) Donald R. Prothero, Vertebrate Evolution: From Origins to Dinosaurs and Beyond, Boca Raton, CRC Press, (ISBN 9780367473167, DOI 10.1201/9781003128205-4), « 20. Synapsids: The Origin of Mammals »
-
(en) Eva-Maria Bendel, Christian F. Kammerer, Nikolay Kardjilov, Vincent Fernandez et Jörg Fröbisch, « Cranial anatomy of the gorgonopsian Cynariops robustus based on CT-reconstruction », PLOS ONE, vol. 13, no 11, , e0207367 (PMID 30485338, PMCID 6261584, DOI 10.1371/journal.pone.0207367
 , Bibcode 2018PLoSO..1307367B).
, Bibcode 2018PLoSO..1307367B). - (en) Michel Laurin, « New data on the cranial anatomy of Lycaenops (Synapsida, Gorgonopsidae), and reflections on the possible presence of streptostyly in gorgonopsians », Journal of Vertebrate Paleontology, vol. 18, no 4, , p. 765–776 (DOI 10.1080/02724634.1998.10011105, S2CID 84910018).
- (en) W. E. Swinton, Fossil amphibians and reptiles, British Museum (Natural History), (lire en ligne), p. 33.
- (en) Kenneth D. Angielczyk et Christian F. Kammerer, Mammalian Evolution, Diversity and Systematics, Berlin, De Gruyter, (ISBN 9783110275902), « Non-Mammalian synapsids: the deep roots of the mammalian family tree ».
- (en) Christian F. Kammerer, « Systematics of the Rubidgeinae (Therapsida: Gorgonopsia) », PeerJ, vol. 4, , e1608 (PMID 26823998, PMCID 4730894, DOI 10.7717/peerj.1608
 ).
). - (en) E. V. I. Gebauer, « Phylogeny and Evolution of the Gorgonopsia with a Special Reference to the Skull and Skeleton of GPIT/RE/7113 », Université Eberhard Karl de Tübingen, (lire en ligne).
- (en) Ricardo Araújo, Vincent Fernandez, Michael J. Polcyn, Jörg Fröbisch et Rui M. S. Martins, « Aspects of gorgonopsian paleobiology and evolution: insights from the basicranium, occiput, osseous labyrinth, vasculature, and neuroanatomy », PeerJ, vol. 5, , e3119 (PMID 28413721, PMCID 5390774, DOI 10.7717/peerj.3119
 ).
). - (en) D. M. Kermack et K. A. Kermack, The Evolution of Mammalian Characters, (ISBN 978-1-4684-7817-4, DOI 10.1007/978-1-4684-7817-4_5), « Dentitions, Tooth-Replacement and Jaw Articulation », p. 71–79.
- (en) M. R. Whitney, A. R. H. LeBlanc, A. R. Reynolds et K. S. Brink, « Convergent dental adaptations in the serrations of hypercarnivorous synapsids and dinosaurs », Biology Letters, vol. 16, no 12, (PMID 33321067, PMCID 7775981, DOI 10.1098/rsbl.2020.0750
 ).
). - (en) B. Van Valkenburgh et I. Jenkins, « Evolutionary Patterns in the History of Permo-Triassic and Cenozoic Synapsid Predators », The Paleontological Society Papers, vol. 8, , p. 273–275 (DOI 10.1017/S1089332600001121).
- (en) K. A. Kermack, « Tooth replacement in mammal-like reptiles of the suborders Gorgonopsia and Therocephalia », Philosophical Transactions of the Royal Society of London B: Biological Sciences, vol. 240, no 670, , p. 95–133 (DOI 10.1098/rstb.1956.0013, Bibcode 1956RSPTB.240...95K).
- (en) S. B. Kümmell et E. Frey, « Range of Movement in Ray I of Manus and Pes and the Prehensility of the Autopodia in the Early Permian to Late Cretaceous Non-Anomodont Synapsida », PLOS ONE, vol. 9, no 12, , e113911 (PMID 25517726, PMCID 4269487, DOI 10.1371/journal.pone.0113911
 , Bibcode 2014PLoSO...9k3911K).
, Bibcode 2014PLoSO...9k3911K). - (en) R. Owen, Descriptive and illustrated catalogue of the fossil Reptilia of South Africa in the collection of the British museum, British Museum (Natural History), (lire en ligne), p. 27–29.
- (en) V. P. Amalitsky, « Diagnoses of the new forms of vertebrates and plants from the upper Permian of North Dvina. », Bulletin of the Russian Academy of Sciences, Saint Petersburg, vol. 16, no 6, , p. 329–340
- (en) C. F. Kammerer et V. Masyutin, « Gorgonopsian therapsids (Nochnitsa gen. nov. and Viatkogorgon) from the Permian Kotelnich locality of Russia », PeerJ, vol. 6, , e4954 (PMID 29900078, PMCID 5995105, DOI 10.7717/peerj.4954
 ).
). - (en) C. C. Young, « A Late Permian fauna from Jiyuan, Henan », Vertebrata PalAsiatica, vol. 17, no 2, , p. 99–113.
- (en) D. Sigogneau-Russell et A.-L. Sun, « A brief review of Chinese synapsids », Geobios, vol. 14, no 2, , p. 276 (DOI 10.1016/S0016-6995(81)80012-5).
- (en) Sanghamitra Ray et Saswati Bandyopadhyay, « Late Permian vertebrate community of the Pranhita–Godavari valley, India », Journal of Asian Earth Sciences, vol. 21, no 6, , p. 643 (DOI 10.1016/S1367-9120(02)00050-0, Bibcode 2003JAESc..21..643R).
- (en) T. M. Smiley, C. A. Sidor, A. Maga et O. Ide, « The vertebrate fauna of the Upper Permian of Niger. VI. First evidence of a gorgonopsian therapsid », Journal of Vertebrate Paleontology, vol. 28, no 2, , p. 543–547 (DOI 10.1671/0272-4634(2008)28[543:TVFOTU]2.0.CO;2).
- (en) tectus in Charlton T. Lewis (1891) An Elementary Latin Dictionary, Harper & Brothers.
- (en) R. Lydekker, Catalogue of the fossil Reptilia and Amphibia in the British Museum (Natural history) Part IV, British Museum (Natural History), (lire en ligne), p. 111.
- (en) H. G. Seeley, « Researches on the structure, organization, and classification of the fossil reptilia.—Part IX. section 1. On the Therosuchia », Annals and Magazine of Natural History, vol. 13, no 6, , p. 375 (DOI 10.1080/00222939408677718, lire en ligne).
- (en) H. F. Osborn, « The Reptilian Subclasses Diapsida and Synapsida and the Early History of the Diaptosauria. Volume I. Part VIII », PDF, , p. 451–466 (lire en ligne [PDF]).
- (en) R. Broom, « On the use of the term Anomodontia », Records of the Albany Museum, vol. 1, no 4, , p. 266-269.
- (en) R. Broom, « On the Gorgonopsia, a Suborder of the Mammal-like Reptiles », Proceedings of the Zoological Society of London, vol. 1913, no 2, , p. 225–230 (DOI 10.1111/j.1469-7998.1913.tb07574.x, lire en ligne).
- (en) A. Wyllie, « A review of Robert Broom's therapsid holotypes: Have they survived the test of time? », Palaeontologia Africana, vol. 39, no 39, , p. 2 (lire en ligne [PDF]).
- (en) C. F. Kammerer, Early Evolutionary History of the Synapsida, Springer, coll. « Vertebrate Paleobiology and Paleoanthropology », (ISBN 978-94-007-6841-3, DOI 10.1007/978-94-007-6841-3_10), « Theriodontia: Introduction », p. 165–169.
- (en) Denise Sigogneau-Russell, Theriodontia I: Phthinosuchia, Biarmosuchia, Eotitanosuchia, Gorgonopsia, vol. 17 B/I, Stuttgart, Gustav Fischer Verlag, coll. « Encyclopedia of Paleoherpetology », (ISBN 978-3437304873).
- (en) C. F. Kammerer, R. M. H. Smith, M. O. Day et B. S. Rubidge, « New information on the morphology and stratigraphic range of the mid‐Permian gorgonopsian Eriphostoma microdon Broom, 1911 », Papers in Palaeontology, vol. 1, no 2, , p. 201–221 (DOI 10.1002/spp2.1012).
- (en) C. F. Kammerer et B. S. Rubidge, « The earliest gorgonopsians from the Karoo Basin of South Africa », Journal of African Earth Sciences, vol. In press, , p. 104631 (DOI 10.1016/j.jafrearsci.2022.104631)
- (en) T. S. Kemp, « The origin and early radiation of the therapsid mammal‐like reptiles: a palaeobiological hypothesis », Journal of Evolutionary Biology, vol. 19, no 4, , p. 1231–1247 (PMID 16780524, DOI 10.1111/j.1420-9101.2005.01076.x
 , S2CID 3184629).
, S2CID 3184629). - (en) M. O. Day, J. Ramezani, S. A. Bowring et al., « When and how did the terrestrial mid-Permian mass extinction occur? Evidence from the tetrapod record of the Karoo Basin, South Africa », Proceedings of the Royal Society B, vol. 282, no 1811, , p. 20150834 (PMID 26156768, PMCID 4528552, DOI 10.1098/rspb.2015.0834
 ).
). - (en) Mauricio Antón, Sabertooth, Bloomington, Indiana, University of Indiana Press, (ISBN 9780253010421), p. 204–207.
- (en) M. Randau, C. Carbone et S. T. Turvey, « Canine Evolution in Sabretoothed Carnivores: Natural Selection or Sexual Selection? », PLOS ONE, vol. 8, no 8, , e72868 (PMID 23951334, PMCID 3738559, DOI 10.1371/journal.pone.0072868
 , Bibcode 2013PLoSO...872868R).
, Bibcode 2013PLoSO...872868R). - (en) A. R. I. Cruikshank, « The Mode of Life of Gorgonopsians », Palaeontologica Africana, vol. 15, nos 1–2, , p. 65–67 (lire en ligne [PDF]).
- (en) J. Estefa, P. Tafforeau, A. M. Clement et al., « New light shed on the early evolution of limb-bone growth plate and bone marrow », eLife, vol. 10, , p. 51581 (PMID 33648627, PMCID 7924947, DOI 10.7554/eLife.51581
 ).
). - (en) A. Kriloff, D. Germain, A. Canoville, P. Vincent, M. Sache et M. Laurin, « Evolution of bone microanatomy of the tetrapod tibia and its use in palaeobiological inference », Journal of Evolutionary Biology, vol. 21, no 3, , p. 807–826 (PMID 18312321, DOI 10.1111/j.1420-9101.2008.01512.x
 ).
). - (en) L. Marchetti, H. Klein, M. Buchwitz et al., « Permian-Triassic vertebrate footprints from South Africa: Ichnotaxonomy, producers and biostratigraphy through two major faunal crises », Gondwana Research, vol. 72, , p. 159 (DOI 10.1016/j.gr.2019.03.009, Bibcode 2019GondR..72..139M).
- (en) J. Benoit, F. Abdala, P. R. Manger et B. S. Rubidge, « The Sixth Sense in Mammalian Forerunners: Variability of the Parietal Foramen and the Evolution of the Pineal Eye in South African Permo-Triassic Eutheriodont Therapsids », Acta Palaeontologica Polonica, vol. 61, no 4, , p. 777–789 (DOI 10.4202/app.00219.2015
 , S2CID 59143925).
, S2CID 59143925). - (en) K. D. Angielczyk et L. Schmitz, « Nocturnality in synapsids predates the origin of mammals by over 100 million years », Proceedings of the Royal Society B, vol. 281, no 1793, (PMID 25186003, PMCID 4173690, DOI 10.1098/rspb.2014.1642
 ).
). - (en) W. J. Hillenius, « Nasal turbinates and the evolution of mammalian endothermy », Oregon State University, , p. 74–76 (hdl 1957/35986, lire en ligne).
- (en) W. J. Hillenius, « Septomaxilla of nonmammalian synapsids: Soft‐tissue correlates and a new functional interpretation », Journal of Morphology, vol. 245, no 1, , p. 29–50 (DOI 10.1002/1097-4687(200007)245:1<29::AID-JMOR3>3.0.CO;2-B).
- (en) T. S. Kemp, « The origin of mammalian endothermy: a paradigm for the evolution of complex biological structure », Zoological Journal of the Linnean Society, vol. 147, no 4, , p. 473–488 (DOI 10.1111/j.1096-3642.2006.00226.x
 ).
). - (en) J. S. Turner et C. R. Tracey, The Ecology and Biology of Mammal-like reptiles, Smithsonian Institution Press, , PDF (lire en ligne), « Body Size, Homeothermy and the Control of Body Heat in Mammal-like Reptiles »
- (en) L. Van Velan, « Therapsids as Mammals », Evolution, vol. 14, no 3, , p. 304–313 (DOI 10.2307/2405973, JSTOR 2405973).
- (en) K. M. Kato, E. A. Rega, C. A. Sidor et A. K. Huttenlocker, « Investigation of a bone lesion in a gorgonopsian (Synapsida) from the Permian of Zambia and periosteal reactions in fossil non-mammalian tetrapods », Philosophical Transactions of the Royal Society B, vol. 375, no 1793, (PMID 31928188, PMCID 7017433, DOI 10.1098/rstb.2019.0144
 ).
). - (en) M. R. Whitney, L. Mose et C. A. Sidor, « Odontoma in a 255-Million-Year-Old Mammalian Forebear », JAMA Oncology, vol. 3, no 7, , p. 998–1000 (PMID 27930769, PMCID 5824274, DOI 10.1001/jamaoncol.2016.5417
 ).
). - (en) J. Benoit, C. Browning et L. A. Norton, « The First Healed Bite Mark and Embedded Tooth in the Snout of a Middle Permian Gorgonopsian (Synapsida: Therapsida) », Frontiers in Ecology and Evolution, vol. 6, , p. 699298 (DOI 10.3389/fevo.2021.699298
 ).
). - (en) Christian F. Kammerer et Vladimir Masyutin, « A new therocephalian (Gorynychus masyutinae gen. et sp. nov.) from the Permian Kotelnich locality, Kirov Region, Russia », PeerJ, vol. 6, , e4933 (PMID 29900076, PMCID 5995100, DOI 10.7717/peerj.4933
 ).
). - (en) A. Wilson, S. Flint, T. Payenberg et E. Tohver, « Architectural Styles and Sedimentology of the Fluvial Lower Beaufort Group, Karoo Basin, South Africa », Journal of Sedimentary Research, vol. 84, no 4, , p. 326–348 (DOI 10.2110/jsr.2014.28, Bibcode 2014JSedR..84..326W).
- (en) R. M. H. Smith, « Morphology and depositional history of exhumed Permian point bars in the southwestern Karoo, South Africa », Journal of Sedimentary Research, vol. 57, no 1, , p. 19–20 (DOI 10.1306/212F8A8F-2B24-11D7-8648000102C1865D).
- (en) E. Yakimenko, S. A. Inozemtsev et S. V. Naugolnykh, « Upper Permian paleosols (Salarevskian Formation) in the central part of the Russian Platform: Paleoecology and paleoenvironment », Revista Mexicana Ciencias Geologicas, vol. 21, no 1, , p. 110–119 (lire en ligne).
- (en) Cindy V. Looy, Stephanie L. Ranks, Dan S. Chaney, Sophie Sanchez, Jean-Sébastien Steyer, Roger M.H. Smith, Christian A. Sidor, Timothy S. Myers, Oumarou Ide et Neil J. Tabor, « Biological and physical evidence for extreme seasonality in central Permian Pangea », Palaeogeography, Palaeoclimatology, Palaeoecology, vol. 451, , p. 210–226 (DOI 10.1016/j.palaeo.2016.02.016
 , Bibcode 2016PPP...451..210L).
, Bibcode 2016PPP...451..210L). - (en) M. J. Benton, « Hyperthermal-driven mass extinctions: killing models during the Permian–Triassic mass extinction », Philosophical Transactions of the Royal Society A, vol. 376, no 2130, (PMID 30177561, PMCID 6127390, DOI 10.1098/rsta.2017.0076
 , Bibcode 2018RSPTA.37670076B).
, Bibcode 2018RSPTA.37670076B). - (en) R. B. Sookias, R. J. Butler et R. B. J. Benson, « Rise of dinosaurs reveals major body-size transitions are driven by passive processes of trait evolution », Proceedings of the Royal Society B, vol. 279, no 1736, , p. 2180–2187 (PMID 22298850, PMCID 3321709, DOI 10.1098/rspb.2011.2441
 , S2CID 1231897)
, S2CID 1231897) - (en) « Primeval Creatures » [archive du ], sur primeval.tv (consulté le )
- « Il était une fois notre planète », sur National Geographic.fr
- (en) « Dinosaur Revolution Episode Guide » [archive du ], Discovery Channel (consulté le ), p. 1
- (en) « About the show: the cast », sur Primeval: New World (consulté le )
- (en) « Gorgonopsid », sur Animal Armageddon Wiki
- (en) Tim Haines, The Complete Guide to Prehistoric Life, Canada, Firefly Books, (ISBN 1-55407-125-9, lire en ligne
 ), 176
), 176
Voir aussi
Articles connexes
Références taxonomiques
- Ressources relatives au vivant :
- (cs + en) BioLib
- (en) Paleobiology Database
- Portail de la paléontologie
