Paludisme
Le paludisme ou la malaria, appelé également « fièvre des marais », est une maladie infectieuse due à un parasite du genre Plasmodium, propagée par la piqûre de certaines espèces de moustiques anophèles.
« Malaria » redirige ici. Pour le film, voir Malaria (film, 1943).
| Causes | Plasmodium falciparum, Plasmodium vivax, Plasmodium malariae, Plasmodium ovale et Plasmodium knowlesi |
|---|---|
| Transmission | Transmission par les moustiques (d) et transfusion sanguine |
| Incubation min | 7 j |
| Incubation max | 30 j |
| Symptômes | Fièvre intermittente, fièvre périodique (d), hépatomégalie, anémie, splénomégalie, ictère, coma et frissonnement (en) |
| Traitement | Antipaludéen (en), antipyrétique, remplacement de fluide intraveineux (d) et traitement symptomatique |
|---|---|
| Médicament | Chloroquine, (RS)-primaquine, hydroxychloroquine, méfloquine, pyriméthamine, primaquine phosphate (d), sulfadiazine, Cinchonidine, Artesunate/amodiaquine (en), artémisinine, quinidine, quinine, doxycycline, clindamycine et atovaquone |
| Spécialité | Infectiologie, médecine tropicale et parasitologie |
| CISP-2 | A73 |
|---|---|
| CIM-10 | B50 |
| CIM-9 | 084 |
| OMIM | 248310 |
| DiseasesDB | 7728 |
| MedlinePlus | 000621 |
| eMedicine |
221134 emerg/305ped/1357 |
| MeSH | D008288 |
| MeSH | C03.752.250.552 |
| Patient UK | Malaria-pro |
![]() Mise en garde médicale
Mise en garde médicale

Avec 229 millions de personnes malades et 409 000 décès en 2019[1], le paludisme demeure la parasitose la plus importante et concerne majoritairement les enfants de moins de cinq ans et les femmes enceintes. 95 % des cas ont été enregistrés dans vingt-neuf pays, notamment en Afrique subsaharienne (27 % au Nigeria, 12 % en R.D. Congo, 5 % en Ouganda, 4 % au Mozambique)[1] (cf. section détaillée : « Épidémiologie »).
Le parasite du paludisme est principalement transmis, la nuit, lors de la piqûre par une femelle moustique du genre Anopheles, elle-même contaminée après avoir piqué un individu atteint du paludisme. Le parasite infecte les cellules hépatiques de la victime puis circule dans le sang, en colonisant les érythrocytes (hématies ou globules rouges) et en les détruisant.
De nombreuses espèces d'animaux homéothermes sont parasitées par des Plasmodiidae, qui leur sont inféodés. Sur les 123 espèces connues du genre Plasmodium, seules quatre sont spécifiquement humaines : Plasmodium falciparum responsable d'une grande majorité des décès, et trois autres qui provoquent des formes de paludisme plus bénignes et généralement non mortelles, Plasmodium vivax, Plasmodium ovale et Plasmodium malariae. L'espèce Plasmodium knowlesi, courante en Asie du Sud-Est mais que l'on croyait jusqu'à une date récente spécifique à différents singes, est désormais reconnue comme affectant aussi les humains, mais de façon généralement bénigne (cf. « Causes »).
La cause de la maladie a été découverte le à l'hôpital militaire de Constantine (Algérie) par un médecin de l'armée française, Alphonse Laveran, qui reçut le prix Nobel de physiologie ou médecine en 1907. C'est en 1897 que le médecin anglais Ronald Ross (prix Nobel en 1902) prouva que les moustiques anophèles étaient les vecteurs de la malaria (jusqu'à cette date, le « mauvais air » émanant des marécages était tenu responsable de la propagation de la maladie).
Le , l'OMS « recommande l’utilisation généralisée du vaccin antipaludique RTS,S/AS01 (RTS,S) chez les enfants en Afrique subsaharienne et dans d'autres régions où la transmission du paludisme à P. falciparum est modérée ou forte[2] ».
Étymologie
Le terme paludisme provient du latin palus, « marais »[3].
Le mot malaria dérive de l'italien mal'aria, « mauvais air »[4]. Ce terme est très utilisé dans le monde, en particulier par les anglophones et les italophones[5].
Histoire
Depuis les origines de l'humanité
On trouve des parasites proches de celui de la malaria chez les chimpanzés, le genre le plus proche de l'humain[6]. Les chimpanzés abritent un parasite du paludisme, le Plasmodium reichenowi, proche parent du Plasmodium falciparum ; les gorilles abritent quant à eux le Plasmodium falciparum qui pourrait être à l'origine du parasite humain (le séquençage de l'ADN du Plasmodium falciparum dans des fèces de gorille infecté montre par analyse phylogénétique que ce parasite primatophile serait l'ancêtre de la souche qu'on retrouve chez l'humain)[7].


Le paludisme affecte les êtres humains depuis le Pléistocène[8], il y a plus de 50 000 ans et il aurait été un agent pathogène depuis le début de l'histoire de notre espèce[9]. Cela représente plusieurs milliers de générations d'humains[8], et le paludisme est considéré comme l'une des maladies les plus mortelles de l'histoire de l'humanité[10].

Une spéculation[11] controversée[12] estime que la moitié de la totalité des humains ayant existé sont morts du paludisme : en seraient morts 54 milliards d'humains sur un total de 108 milliards ayant existé ou existant encore.
Les parasites humains et leurs vecteurs (moustiques) ont coévolué avec les groupes humains se dispersant en Afrique et en Eurasie. La transmission du paludisme a dépendu des espèces de moustiques anthropophiles (piquant préférentiellement l'humain) dont l'extension a toujours été limitée par les conditions environnementales (latitude, altitude…)[8].
Une des conséquences de l'ancienneté de cette association co-évolutive est l'existence biologique, dans les populations modernes, d'un polymorphisme génétique sanguin[8]. La diversité des conditions de peuplement a conduit à une sélection naturelle des gènes de la drépanocytose, des thalassémies, du déficit en glucose-6-phosphate déshydrogénase, de l'elliptocytose héréditaire (appelée dans certains cas ovalocytose). Ces maladies, qui touchent les globules rouges du sang, donnent un avantage sélectif contre le paludisme (cf. section détaillée : « Les facteurs génétiques »).
Il y a environ 10 000 ans, la propagation du paludisme fut favorisée par le changement climatique, le début de l'agriculture (révolution néolithique) donc la sédentarisation avec poussée démographique.
Antiquité et moyen-âge
Des fièvres périodiques, évoquant le paludisme, sont signalées dès l'Antiquité dans des textes chinois, indiens, assyriens et grecs. Les descriptions plus détaillées sont celles d'Hippocrate et d'auteurs de l'Empire Romain. La théorie médiévale d'une maladie associée aux miasmes provenant de marais reste en vigueur jusqu'au XIXe siècle[13].
En , une équipe de scientifiques égyptiens et américains a prouvé, par l'analyse de l'ADN, que Toutânkhamon était atteint de paludisme au moment de sa mort (vers )[14],[15]. En Inde, dès l'antiquité, les Veda (« Textes de la connaissance ») font état des fièvres paludiques ; les médecins Charaka et Sushruta (probablement Ve siècle av. J.-C.) en font une description et lui associent, déjà, la piqûre de moustique. Les symptômes de fièvre intermittente ont été décrits par Hippocrate ; il lie ces fièvres à certaines conditions climatiques et environnementales, et les divise en trois types : febris tertiana (tous les trois jours), quartana (tous les quatre jours), et quotidiana ou continua (maintenant appelée tropica). Vers apparaît, dans certaines régions de Chine, l'utilisation, en tisane, du qing hao su (青蒿素) appelé plus tard artémisinine en Occident et extrait d'une plante médicinale utilisée comme antipyrétique appelée qing hao (青蒿) (Artemisia annua ou « Armoise annuelle »). D'usage encore plus ancien, les racines du chángshān (常山) (Dichroa febrifuga) ont aussi d'indubitables effets médicinaux. On trouve ainsi des références à des périodes de fièvre paludique en Chine[13] et à des symptômes de cette maladie dans le Huangdi Neijing (« Le Canon de Médecine ») datant des environs du Ier siècle avant notre ère[16],[17].
Le paludisme était commun dans des endroits du monde d'où il a maintenant disparu, comme la grande majorité de l'Europe (la maladie d'origine africaine s'étant notamment diffusée dans l'Empire romain[18]) et de l'Amérique du Nord.
Âge classique
Dans certains endroits d'Angleterre, la mortalité due à la malaria était comparable à celle de l'Afrique subsaharienne d'aujourd'hui. Même si William Shakespeare est né au début d'une période plus froide appelée le « petit âge glaciaire », il connaissait suffisamment les ravages de cette maladie pour les citer dans huit de ses pièces. Plasmodium vivax a sévi jusqu'en 1958 dans les polders de Belgique et des Pays-Bas.
Au début du XVIe siècle, ce sont les colons européens et leurs esclaves qui ont probablement amené le paludisme sur le continent américain (on sait que Christophe Colomb était atteint de cette maladie avant son arrivée dans les terres nouvelles). Les jésuites missionnaires espagnols virent que les Indiens riverains du lac de Loxa au Pérou utilisaient de la poudre d'écorce de Cinchona pour soigner les fièvres. Cependant, on ne trouve aucune référence au paludisme dans les ouvrages médicaux des Maya ou des Aztèques. L'utilisation de l'écorce de « l'arbre à fièvre » a été introduite dans la médecine européenne par les missionnaires jésuites dont Barbabe de Cobo qui l'expérimente en 1632 et l'exporte également ; si bien que la précieuse poudre s'appela également « poudre des jésuites »[19]. En 2012, une étude des marqueurs génétiques de milliers d'échantillons de Plasmodium falciparum confirme l'origine africaine du parasite en Amérique du Sud (les Européens ayant été eux-mêmes affectés par cette maladie par l'intermédiaire de l'Afrique) : il a emprunté entre le milieu du XVIe siècle et le milieu du XIXe siècle les deux routes principales de la traite négrière, la première menant au nord du continent sud-américain (Colombie) par les Espagnols, la seconde aboutissant plus au sud (Brésil) par les Portugais[20].
XVIIIe et XIXe siècles : premières études scientifiques
En 1717, la pigmentation post mortem au graphite de la rate et du cerveau est publiée par Giovanni Maria Lancisi, le médecin du pape Clément XI, dans un ouvrage, édité en 1717, sur le paludisme De noxiis paludum effluviis eorumque remediis. Il y présente des preuves que la maladie est transmise par les mouches. Lancisi introduit le mot mal'aria, « mauvais air ».
En 1820, Pierre Joseph Pelletier et Joseph Bienaimé Caventou séparent les alcaloïdes cinchonine et quinine de la poudre de l'écorce de « l'arbre à fièvre », permettant la création de doses standardisées des composants actifs[21].
Vers 1832, François Clément Maillot perfectionne le traitement curatif et prophylactique de la quinine. Ce n'est qu'en 1881 toutefois que son apport est officiellement reconnu à l'occasion du congrès sur le paludisme tenu à Alger.
En 1848, Johann Friedrich Meckel (surnommé Meckel le jeune) note un grand nombre de granules noir-bruns dans le sang et la rate d'un patient qui venait de mourir dans un hôpital psychiatrique. Meckel était probablement en train de voir des parasites de malaria sans le comprendre, car il ne mentionne pas le paludisme dans son rapport, en pensant que le pigment était de la mélanine.
En 1878, le Dr Patrick Manson émet le premier l'hypothèse que le paludisme est transmis par un moustique du genre Culex qui absorbe le parasite et pond dans l'eau que l'humain ingurgite[22].
En 1879, l'Allemand Edwin Klebs et l'Italien Ettore Marchiafava annoncent avoir trouvé l'agent responsable de la malaria Bacillus malariae, hypothèse que les découvertes de Laveran feront oublier[23].

En 1880, Charles Louis Alphonse Laveran établit, en Algérie, la relation entre les observations faites par Meckel le jeune et le parasite qu'il observe pour la première fois dans les globules rouges de 44 personnes souffrant du paludisme. En voyant l'exflagellation se produire, il devient convaincu que les flagelles mobiles sont des micro-organismes parasites (minuscules êtres vivants unicellulaires qui se multiplient végétativement par mitose). Or bien des médecins de l'époque pensaient encore que les protozoaires n'étaient en fait que des globules rouges altérés. Laveran doit se battre pour faire admettre sa théorie, car il restait à trouver comment ces organismes s'introduisaient dans le corps humain. N'ayant pas obtenu un poste lui permettant de poursuivre ses recherches, Laveran prend sa retraite et poursuit ses recherches sur les protozoaires à l'Institut Pasteur en tant que bénévole. C'est en 1898 qu'il publie son Traité du paludisme. Il voit aussi l'effet de la quinine, qui détruit ces parasites. Il suggère que le paludisme est causé par ce protozoaire. C'est la première fois qu'un protozoaire est identifié comme étant la cause d'une maladie[24]. Cette découverte lui vaut l'attribution du prix Nobel de médecine en 1907. Les études scientifiques sur le paludisme viennent de faire leur première avancée significative.
En 1880, Ettore Marchiafava et Angelo Celli, à la demande d'Alphonse Laveran, étudient au microscope le cycle de reproduction des protozoaires dans le sang humain, et observent qu'ils se divisent à peu près simultanément à intervalles réguliers et que la division coïncide avec les attaques de fièvre. En 1885, ils appellent ce protozoaire Plasmodium[25].
En 1881, Carlos Finlay, un médecin cubain qui traite les patients atteints de la fièvre jaune à La Havane, affirme que ce sont les moustiques qui transmettent cette maladie aux humains.
En 1886 et 1892, Camillo Golgi publie ses découvertes sur la fréquence et la périodicité des fièvres dues à la malaria, et montre qu'il existe plusieurs types de paludisme causés par des organismes protozoaires différents.
En 1891, Paul Ehrlich et Paul Guttman remarquent les propriétés antipaludéennes du bleu de méthylène. Cette découverte fait suite à celle de Celli et Guarnieri, qui se basait elle-même sur les précédents travaux d'Ehrlich montrant l'affinité de cette substance pour certaines cellules. Ehrlich veut promouvoir le développement de médicaments en exploitant les différences biochimiques. C'était la première fois qu'une substance de synthèse était active contre le paludisme (dès 1849, August von Hofmann avait cependant déjà souligné l'intérêt de la synthèse de la quinine à partir de goudron de houille).
En 1895, l'expédition française de Madagascar fut un « désastre sanitaire » : sur 21 600 personnes débarquées, 5 731 sont mortes du paludisme et 25 sont mortes au combat[26]. À noter que ce genre de « désastre » s'est reproduit plus tard, comme pendant la guerre du Viêt Nam pour les soldats nord-vietnamiens (voir l'article sur l'artémisinine).
En 1898, Amico Bignami réussit à transmettre expérimentalement le paludisme grâce à des moustiques. Il n’hésite pas à se faire piquer lui-même et à contracter la maladie.

En 1898, c'est le Britannique Ronald Ross, travaillant en Inde et correspondant régulièrement avec Laveran et Manson, mais qui a du mal à imaginer pourquoi l'insecte ne transmet pas directement le parasite par piqûre, qui prouve finalement que le paludisme est transmis par cette piqûre. Pour confirmer sa théorie, il dissèque, pendant deux ans, des oiseaux paludéens qu'il fait piquer par des centaines de variétés de moustiques. Ce n'est qu'après ces deux ans, au bord du découragement, qu'il remarque une espèce de moustique qui ne se développe que dans les eaux de surface et ne se voit que la nuit : l'anophèle. Il continue alors ses recherches ; il récolte et élève les larves et retrouve des protozoaires de Laveran vers le septième jour dans l'estomac de l'anophèle. La preuve est établie : c'est bien cet insecte qui transmet le parasite vivant à ses dépens. Il constate qu'une période d'incubation de 10 à 14 jours est nécessaire entre la piqûre et l'apparition des parasites dans le sang. Il venait de prouver que certaines espèces de moustiques transmettent le paludisme aux oiseaux, en isolant les parasites des glandes salivaires des moustiques qui se nourrissent des oiseaux affectés[27]. Ceci lui vaut le prix Nobel de médecine en 1902. Après avoir démissionné des services médicaux indiens, Ross travaille pour l'école de médecine tropicale de Liverpool alors récemment créée, et dirige les efforts d'éradication du paludisme en Égypte, au Panama, en Grèce et sur l'île Maurice[28]. Jusque vers les années 1930, les chercheurs parlent d'Anopheles maculipennis en général sans faire de distinction claire ou précisément circonstanciée entre les différentes variétés[29].
En 1899, le zoologiste italien Giovanni Battista Grassi, se basant sur les travaux de Ross (sur les oiseaux), fit de même pour le vecteur chez les humains et prouva que le cycle vital du Plasmodium a besoin du moustique comme étape nécessaire. Grassi, Giuseppe Bastianelli et Amico Bignami décrivent le cycle de développement de Plasmodium falciparum, Plasmodium vivax et Plasmodium malariae chez Anopheles claviger.
L'année suivante, les découvertes de Finlay et Ross sont confirmées par une équipe médicale dirigée par Walter Reed ; et les recommandations sont mises en place par William C. Gorgas lors de la construction du canal de Panama. Les mesures de santé publique ainsi adoptées ont sauvé les vies de milliers d'ouvriers (alors que plusieurs milliers d'autres y étaient morts auparavant) et ont aidé à développer les futures méthodes de lutte contre la maladie.
XXe siècle : à la recherche de traitements
Tandis que les connaissances sur la maladie s'accroissent notamment du fait de la pratique de la malariathérapie — un traitement aujourd'hui désuet — la mise au point de médicaments antipaludiques, et l'utilisation d'insecticides pour lutter contre le vecteur des parasites marquent cette période. Ces découvertes déterminent l'OMS à lancer le programme mondial d'éradication de la malaria (Global Malaria Eradication Program) en 1955. Alors que ce programme n'a pas encore atteint son objectif, et tandis qu'une forme latente de parasitose est découverte, la recherche s'oriente vers la mise au point d'un vaccin.
Découvertes

Au début du XXe siècle, avant les antibiotiques, les patients atteints de syphilis sont volontairement « traités » en les infectant avec le paludisme, pour leur donner de la fièvre. Le traitement thérapeutique par le paludisme ou malariathérapie est également l'occasion d'accroître considérablement les connaissances sur la malaria ; il ouvre la voie aux recherches en chimiothérapie et reste pratiqué jusque vers 1950.
En 1922, John William Watson Stephens (en) , identifie le 4e parasite connu du paludisme chez l'humain, P. ovale.
Dès les années 1930, les chercheurs avaient remarqué la moindre sensibilité des populations noires à la malaria. En 1949, Émile Brumpt s'étonnait de ne constater aucun cas de malaria au Libéria et au Gabon, à Lagos ou à Stanleyville alors que s'y trouvaient des vecteurs de P. vivax[30].
En 1949, J.B.S. Haldane suggère que les thalassémiques hétérozygotes seraient plus résistants au paludisme. En novembre, Linus Pauling, Harvey Itano, S. J. Singer et Ibert Wells publient dans le journal Science la première preuve d'une maladie humaine causée par une protéine anormale[31]. En utilisant l'électrophorèse, ils démontrent que les individus atteints de drépanocytose ont une hémoglobine modifiée, et que les hétérozygotes, qui ont à la fois des formes normales et anormales d'hémoglobine, sont plus résistants aux infections de paludisme. C'est aussi ainsi que l'on démontre que les lois de Mendel déterminent les propriétés physiques des protéines, et non pas seulement leur absence ou présence : c'est le début de la génétique moléculaire.
Antipaludiques (antimalariques)

En dépit de qualités exceptionnelles, la quinine, produit d'importation de pays éloignés, disponible en quantité limitée, présentait le désavantage d'occasionner parfois des effets secondaires ; en outre son administration se devait d'être quotidienne : autant d'incitations à adopter et à rechercher des substituts, ce qu'avait tenté de faire en vain William Henry Perkin dès 1856. La Première Guerre mondiale, coupant l'Allemagne de l'Inde et de Java - principaux fournisseurs mondiaux de quinine - incita les Allemands à rechercher des substituts à partir de l'observation d'Ehrlich sur l'action du bleu de méthylène.
Sont ainsi découverts successivement, la plasmoquine (1926), la quinacrine/Sontochin (1930), la rhodoquine (1931) et le certuna (1935). Pour ce faire, la recherche allemande s'appuya sur un modèle animal mis au point en 1926 par Roehl.
En 1926, des chercheurs allemands découvrent les propriétés antipaludiques du pamaquin/plasmoquine/paraquine. La structure de ce premier médicament antipaludique dérivé des aminoquinoloéines n'est toutefois divulguée qu'en 1928. Les chercheurs britanniques, français et russes ont déjà remarqué l'action antipaludique des molécules de la série des amino-8 quinoléines. Ils se mettent à la recherche d'autres composés actifs[32]. En 1930, Ernest Fourneau et son équipe mettent au point à l'Institut Pasteur la rhodoquine[33],[34],[35], efficace à des doses très inférieures à celles de la plasmoquine[36].
En Algérie, les frères Edmond et Étienne Sergent durant toute la première moitié du XXe siècle mettent en place à la demande d'Emile Roux une doctrine posant les bases de la lutte anti-paludique en Afrique du Nord. Ces travaux permettent un recul progressif du paludisme en Algérie et de nombreuses vies sont sauvées.
Dans l'Entre-deux-guerres, il y a deux modèles animaux soutenant la recherche d'antipaludiques de synthèse : l'un basé sur le paludisme simien peu pratique à grande échelle, l'autre plus usité, le paludisme aviaire, recourant surtout au canari impaludé par différents types de plasmodium[37].
Dans les mêmes années 1930, aux laboratoires Elberfield de IG Farben en Allemagne, Hans Andersag et ses collègues synthétisent et testent environ 12 000 composants différents et arrivent à produire la résochine[38], un substitut de la quinine. Elle est liée à la quinine car elle possède un noyau de quinoline. Cette résochine (RÉSOrcinate d'une 4-aminoCHINoline : 7-chloro-4-[[4-(diéthylamino)-1-méthylbutyl]amino]quinoléine) et un composant similaire, la sontonchine (3-méthylresochine) sont synthétisés en 1934 en coopération avec des entreprises américaines, grâce à plus de 2 000 accords entre IG Farben et des compagnies étrangères, comme Standard Oil of New Jersey, DuPont, Alcoa, Dow Chemical, Agfa, Winthrop Chemical Company et d'autres compagnies américaines[39]. Ce médicament est plus tard appelé chloroquine. C'est un inhibiteur de la biocristallisation des pigments et l'un des meilleurs antimicrobiens jamais créés[40]. La quinine comme la chloroquine affecte les parasites de la malaria au début de leur cycle de vie, quand les parasites forment des pigments d'hématine, dérivant de la dégradation de l'hémoglobine.
Le proguanil est découvert en 1944 par Curd, Davey et Rose, chercheurs britanniques d'Imperial Chemical Industries. La pyriméthamine, enfin, est mise au point entre 1950 et 1952 par le laboratoire Burroughs-Wellcome. Associée à la sulfadoxine dans les années 1970, elle compose le Fansidar.
Dans les années 1950 et 1960, les antipaludiques de synthèse, dont le coût de fabrication est très faible, tendent à remplacer la quinine d'extraction, plus chère[41].
Pendant la guerre du Viêt Nam, en réponse à une demande expresse des « Việt Cộng », une étude systématique de plus de 200 plantes médicinales chinoises est entreprise sous la direction de la pharmacologue Tu Youyou et de son groupe de recherche à Pékin en 1972. Le qing hao su (青蒿素), appelé artémisinine en Occident, est extrait à faible température dans un milieu neutre (pH 7) de plantes de qing hao (青蒿) séchées, d'après les instructions de Ge Hong. Celui-ci était le premier, au IVe siècle, à recommander l'utilisation de qing hao pour le traitement de « fièvres intermittentes » dans son Manuel de prescriptions pour urgences médicales. Il recommande de faire tremper les feuilles et les branches de l'armoise pendant une nuit, d'extraire le jus amer et de le boire directement. Actuellement, on utilise des dérivés en combinaisons: l’artéméther en combinaison avec la luméfantrine, l'artésunate-amodiaquine, la dihydroartémésinine-pipéraquine.
Les premières cultures in vitro du parasite à leur phase sanguine sont réalisées en 1976 par Trager et Jensen, ce qui facilite considérablement le développement de nouveaux médicaments[42].
Le DDT
Les propriétés insecticides du DDT (dichloro diphényl trichloro-éthane) sont établies, en 1939 par Paul Hermann Müller travaillant à Geigy Pharmaceutical à Bâle en Suisse grâce au pyrethrum fait de pyrèthre de Dalmatie (plante de la famille des chrysanthèmes) écrasé. L'épandage de DDT est une méthode standard de protection contre les insectes. Cependant, en raison de l'impact environnemental du DDT et de la résistance développée par les moustiques, le DDT est de moins en moins utilisé, surtout dans les zones où le paludisme n'est pas endémique (cf. section détaillée : « Les moyens de combattre le moustique ou de s'en protéger »).
En 1948, Paul Müller reçoit le prix Nobel de médecine.
Malaria simienne et humaine
Dans les années 1920, des chercheurs américains injectent du sang de singes de différentes espèces à des humains pour déterminer l'éventualité d'une transmission du paludisme du singe à l'humain[43].
En 1932-33, Sinton et Mulligan mettent en évidence la présence de Plasmodium gonderi chez des Cercopithecidae[44]. Jusque dans les années 1960 on n'avait qu'exceptionnellement constaté en Inde l'infection naturelle des singes pourtant déjà utilisés en nombre à des fins de recherche[45].
Pourtant on savait déjà depuis 1932 que P. knowlesi pouvait être transmis à l'humain par le biais de sang simien infecté. La question de la transmissibilité à l'humain du paludisme simien, considérée notamment dans le cadre d'un programme d'éradication, reprit de l’intérêt en 1960 quand fut mise en évidence, fortuitement, la possibilité d'une transmission (via un moustique) de la malaria d'un singe vers un humain[46]. En 1969, la souche Chesson de Plasmodium vivax fut adaptée pour la première fois à un primate non humain[47].
Depuis 2004, P. knowlesi connu pour être responsable du paludisme simien, a été reconnu responsable d’infections humaines qu'il est recommandé de traiter comme P. falciparum.
Parasitose latente
Bien que les différentes étapes sanguines et le vecteur du paludisme (l'anophèle) aient été identifiés dès le XIXe siècle, ce n'est qu'en 1980 que la forme latente (cycles exo-érythrocytaires secondaires qui vont entretenir dans le foie la parasitose pendant 3 à 5 ans ou plus pour P. vivax, 2 ou 3 pour P. ovale et pendant la vie entière pour P. malariae) du parasite dans le foie a été observée[48]. La découverte de cette forme latente du parasite explique enfin pourquoi des individus apparaissent guéris du paludisme mais rechutent plusieurs années après que le parasite a disparu de leur sang (cf. section détaillée : « Phase hépatique »).
Pharmacologie

- En 2004, l'équipe du Dr Jonathan Vennerstrom de l'université du Nebraska d'Omaha réussit à synthétiser de l'acide artémisinique pouvant être converti en artémisinine plus efficace (in vitro) que celle produite naturellement. Cette molécule (Arterolane, OZ-277 ou RBx11160) a été utilisée en combinaison avec la piperaquine dans le médicament Synriam.
- En mars 2006, deux équipes internationales[49] montrent l'efficacité de diverses plantes dont le Quassia.
- À la même date, des chercheurs de l'université de Lille I développent une molécule, la ferroquine, en greffant à un endroit précis de la molécule de chloroquine un ferrocène. La ferroquine serait jusqu'à 30 fois plus efficace que la chloroquine. La monothérapie à base de ferroquine ainsi que son association à l’arthénusate ont été testées sur 326 sujets, pour la plupart de jeunes enfants dans des zones impaludées d’Afrique centrale[50]. Trois doses de l’association ont été testées, menant à des guérisons dans 97 à 99 % des cas. La monothérapie a eu un taux de succès de 79 % ce qui est du même ordre d’efficacité que d’autres monothérapies préexistantes.
- En septembre 2006, une équipe française[51] isole un principe antipaludique (la simalikalactone D) de la tisane de Quassia amara utilisée en Guyane contre le paludisme[52].
- En 2008, des biologistes du Georgia Institute of Technology d'Atlanta révèlent que certains composés fongicides naturels de l'algue rouge Callophycus Serratus inhibent l'action du Plasmodium ; bien que le lien entre activité antifongique, antibactérienne[53],[54] et antipaludique ne soit alors pas encore compris[55].
- En 2009 (publication ), des chercheurs de Georgia Institute of Technology d'Atlanta identifient des composés anti-infectieux dits « bromophycolides » très efficaces in vitro contre des mycoses et contre le plasmodium falciparum[56].
- En , GlaxoSmithKline annonce rendre gratuitement accessible à la communauté scientifique une liste de plus de 13 500 molécules — ainsi que leurs structures chimiques — potentiellement actives contre P. falciparum afin de stimuler le développement de nouveaux traitements contre la maladie[57].
- En 2010, des chercheurs de l'école de santé publique Johns Hopkins Bloomberg, Université Johns Hopkins, de Baltimore ont découvert qu'une bactérie appartenant au genre Enterobacter et vivant dans la flore intestinale d’Anopheles gambiae tue Plasmodium falciparum au moyen de radicaux libres. Environ 25 % des anophèles capturés près du Johns Hopkins Malaria Research Institute à Macha (sud de la Zambie) contenaient cette souche bactérienne. L'étude a démontré que la bactérie inhibe la croissance de P. falciparum en culture in vitro d'origine humaine jusqu'à 99 % tout comme elle le fait dans le système digestif des anophèles[58],[59].
- En 2010 et 2011, deux nouvelles classes d'antipaludiques ont été découvertes et sont en cours d'essais cliniques : les spiroindolones et les imidazolepipérazines[60].
- En septembre 2012 est réussie la synthèse de l'artémisine[61], permettant à la production des traitements de ne plus être limitée par celle de l'armoise.
Le prix Nobel de médecine 2015 a été attribué à l'Irlandais William Campbell, au Japonais Satoshi Ōmura et à la Chinoise Tu Youyou pour leurs travaux concernant le traitement des maladies parasitaires dont le paludisme.
Vaccins
La conception de vaccins efficaces est rendue très difficile par le fait que la protéine permettant au parasite de s'ancrer aux parois des vaisseaux sanguins de son hôte est codée par un gène var présent à 50-60 exemplaires différents (employés successivement), et que des parties de ces gènes changent de place dans les chromosomes au fil des divisions (une tous les deux jours), créant ainsi de nouveaux variants desdits gènes[62].
Le premier vaccin antimalarique, le SPf66[63], basé sur un peptide synthétique, a été mis au point en janvier 1986 par Manuel Elkin Patarroyo. Son efficacité était toutefois assez faible voire nulle vis-à-vis de P. falciparum.
Actuellement trois types de recherches de deuxième génération sont basées sur les antigènes issus des différents stades du cycle évolutif parasitaire :
- vaccins anti-stade exo-érythrocytaire : ils visent à empêcher le sporozoïte de pénétrer ou de se développer dans les cellules hépatiques ;
- vaccins anti-stade sanguin asexué (antimérozoïte) : ils empêchent les mérozoïtes de pénétrer ou de se développer dans les hématies ;
- vaccins bloquant la transmission : ils induisent des anticorps empêchant la maturation des stades sexués du parasite chez l'anophèle.
Depuis 1992, GlaxoSmithKline Biologicals développe à Rixensart en Belgique un vaccin antimérozoïte dit RTS,S[64]. En décembre 2005, le professeur Pedro L. Alonso de l'université de Barcelone juge les premiers résultats encourageants (efficacité dès la 1re injection dans 30 % des cas, diminution de 50 % des crises graves[65]. Du à 2013, il a subi la phase III des essais cliniques[66],[67] qui a montré une supériorité de RTS, S/AS01 sur les autres adjuvants. Il est préparé à partir de peptides parasitaires de synthèse et de protéines recombinantes ou d'ADN (découvert dans les mitochondries et les apicoplastes de Plasmodium). Sachant que le parasite, pour pénétrer les hématies, prend la forme d'une protéine et est capable de muter une soixantaine de fois pour tromper le système immunitaire, cette piste utilise deux protéines recombinantes qu'elle fusionne :
- une partie de la protéine circumsporozoïtaire (CSP = Circum Sporozoïte Protein) de P. falciparum (RTS) ;
- l'antigène de surface du virus de l'hépatite B (S) ;
- un adjuvant (AS01 ou AS02 resp.) qui est composé de 250 µl d'émulsion d'huile dans l'eau, de 50 µg de saponine QS21 et de 50 µg de (MPL) lipide monophosphoryque immunostimulant A.
RTS, S/AS01 a reçu un avis favorable de l'EMA en juillet 2015. Il est commercialisé sous le nom de Mosquirix et protège aussi contre l'Hépatite B. Un pilote de l'OMS est prévu début 2018 avec le Ghana, le Kenya et le Malawi. La protection qu'il confère diminue avec le temps, chutant à 30 % en trois à quatre ans.
En août 2021, après trois ans d'essais cliniques au Burkina Faso et au Mali sur environ 6 000 enfants de 5 à 17 mois, une étude conclut que combiner une dose de rappel du vaccin « RTS, S » de GSK (juste avant la saison des pluies) à des antipaludiques (sulfadoxine-pyriméthamine ou amodiaquine), dope considérablement l'efficacité de ce vaccin[68]. Selon Brian Greenwood[69], cette synergie vaccin-médicament évite 90 % environ des hospitalisations et décès[70].
D'autres solutions vaccinales font l'objet de recherche :
- depuis 2002, la Faculté de biologie et de médecine (FBM) de l'Université de Lausanne en Suisse étudie un vaccin antimérozoïte appelé PfCS102/AS02A[71] basé sur une peptide de synthèse circumsporozoïtaire (PfCS = Peptide Circum Sporozoïte Protein) de P. falciparum (PfCS102) renforcée par un adjuvant. Au départ, cet adjuvant fut le Montanide ISA 720 remplacé depuis par l'AS02A de GSK Bio car donnant une meilleure réponse du système immunitaire. Les résultats obtenus sont comparables au RTS, S/AS02A. Il est, depuis 2005, dans le stade de la phase II des essais cliniques ;
- en novembre 2005, l'Institut Pasteur annonçait le début de la phase I des essais cliniques sur l'être humain d'un prototype de vaccin antimérozoïte basé sur les antigènes et appelé MSP3[72]. Pour le concevoir, les chercheurs ont étudié les mécanismes des personnes naturellement immunisées ;
- en 2006, le département de la Défense des États-Unis (DoD) demande à l'Institut de Médecine (IOM) de l'Académie nationale des sciences (NAS) de reprendre le programme de recherche qu'il avait entamé en 1986 visant à mettre au point pour les militaires un vaccin contre P. falciparum[73] ;
- de novembre 2006 à décembre 2007, la faculté de médecine de l’université du Maryland et l'université de Bamako testaient ensemble en phase I des essais cliniques un vaccin FMP2.1/AS02A. Sa substance active est une protéine issue de P. falciparum (FMP2.1) qui est renforcée par l'adjuvant AS02A. Un test effectué à Bandiagara au Mali sur 100 enfants âgés de 1 à 6 ans a démontré que l'accoutumance pharmacodynamique à la substance active était sans danger et que la réponse immunitaire un an après la vaccination restait élevée[74],[75]. Sur cette base, la même équipe est passée à phase II des essais cliniques de mai 2007 à juillet 2009 sur 400 enfants[76] ;
- en janvier 2010, L'University of Central Florida d'Orlando a annoncé un candidat-vaccin oral ou injectable à la fois efficace contre le paludisme et le choléra[77],[78]. Il cible l'immunité systémique et mucosale, via une construction antigénique fusionnant les épitopes de la sous-unité B (CTB) de la toxine cholérique avec des antigènes de la membrane apicale (AMA1) et d'une protéine de surface (MSP1) des mérozoïtes de P. falciparum. Les chloroplastes du tabac et d'une laitue transplastomiques[79] ont été testés comme réacteurs pour produire ces protéines. Selon l'étude, ces dernières, extraites et injectées à des souris, se sont montrées capables de les protéger durant 300 jours contre la pénétration du parasite dans les globules rouges, et contre la toxine cholérique. La réponse immunitaire serait de type Tr1/Th2. Ce procédé a été breveté et pourrait permettre - s'il se montre aussi efficace chez l'humain - de produire un vaccin peu cher et ne nécessitant pas de stockage réfrigéré en cas d'usage oral ;
- en 2015, le vaccin « RTS,S » de GlaxoSmithKline donne des résultats prometteurs mais déçoit lors de la phase III des tests, avec une réduction de seulement 40 % des infections et de moins de 30 % pour la forme grave (tout en nécessitant quatre injections)[80] ;
- en 2021, le vaccin R21/Matrix-M conçu à l'université d'Oxford et testé en 2019 atteint une efficacité record de 77 % sur un an. La dernière phase de tests avant homologation implique 4 800 enfants de quatre pays différents[80].
Génétique
Les généticiens visent plutôt à combattre le parasite, non chez l'humain, mais chez son vecteur, le moustique.
En 2000, l'équipe du professeur Andrea Crisanti[81] de l'Imperial College London parvient à créer le premier moustique génétiquement modifié. En 2003, elle reconnait que si le gène marqueur persiste pendant une trentaine de générations lors de la fécondation entre moustiques modifiés, celui-ci ne subsiste que sur 4 à 16 générations lors d'une fécondation avec un moustique non modifié[82].
Depuis avril 2001, un consortium international vise le séquençage complet du génome d’Anopheles gambiae. Il est patronné par le Tropical Disease Research (TDR). Ce séquençage a été confié au Genoscope d'Évry et au Celera Genomics d'Alameda[83]. Le but est d'identifier les gènes impliqués dans l’immunité du moustique vis-à-vis des parasites des Plasmodium ou dans ses récepteurs olfactifs et gustatifs avec, à terme, la conception de molécules attractives ou répulsives pour le moustique ainsi que cibler les protéases impliquées dans sa réponse immunitaire[84],[85].
Le , le professeur d'entomologie Michael Riehle annonce avoir réussi à créer avec son équipe à l'université d'Arizona, un Anopheles Stephensi femelle génétiquement modifié capable de détruire les parasites dans son corps et donc incapable de transmettre la maladie. Les chercheurs étudient maintenant le moyen de remplacer, dans la nature, les populations d'anophèles « normales » par celles issues du laboratoire[86], en espérant que ces moustiques ne deviennent pas invasifs en transmettant d'autres maladies ou que le parasite ne contourne pas cette résistance.
Épidémiologie
Répartition dans le monde

- Prévalence élevée de la chloriquino-résistance ou multi-résistance
- Chloriquino-résistance présente
- Pas de Plasmodium falciparum ou de chloriquino-résistance
- Pas de paludisme
Dans les années 1990, le paludisme était annuellement la cause de 400 à 900 millions de cas de fièvres, et entre 700 000 et 2,7 millions de morts[89], soit en moyenne un mort toutes les 30 secondes[90]. En 2012, entre 473 000 et 789 000 personnes sont mortes du paludisme[91]. La grande majorité des victimes sont des enfants de moins de 5 ans[92],[91], les femmes enceintes étant aussi particulièrement vulnérables car le placenta constitue une cible où les parasites (Plasmodium falciparum) peuvent s'accumuler. Malgré les efforts entrepris pour réduire la transmission de la maladie et améliorer son traitement, il y a eu peu d'évolution depuis le début des années 1990[93]. La mortalité semble décroître depuis la fin des années 2000 et est estimée à 1,2 million de personnes en 2010[94].
La co-infection avec le VIH n'accroît pas la mortalité, et pose moins de problème que la co-infection paludisme / tuberculose, les deux maladies s'attaquant habituellement à des tranches d'âge différentes : le paludisme est plus fréquent chez les jeunes tandis que la tuberculose atteint davantage les personnes âgées[95]. Cependant, le paludisme et le VIH contribuent à leur propagation mutuelle : le paludisme accroît la charge virale et l'infection du VIH augmente la probabilité d'une infection de paludisme[96].
Le paludisme est endémique dans les zones intertropicales dans les Amériques, dans de nombreux endroits d'Asie, et dans la plupart de l'Afrique. C'est toutefois dans l'Afrique sub-saharienne que l'on trouve 85 à 90 % des morts du paludisme[97]. La distribution géographique de la maladie au sein de grandes régions est complexe, et l'on trouve ainsi des zones paludiques et non paludiques proches l'une de l'autre[98]. Dans les régions sèches, les périodes de paludisme peuvent être prédites sans trop d'erreurs en utilisant les cartes de précipitation[99]. À l'opposé de la dengue, le paludisme est davantage présent dans les campagnes que dans les villes[100]. Par exemple, les villes du Viêt Nam, du Laos et du Cambodge sont pratiquement exemptes de paludisme, mais celui-ci reste présent dans les campagnes[101]. En 2016, d'après l'Organisation mondiale de la santé, aucun cas de paludisme n'a été recensé au Sri Lanka durant trois années consécutives ; c'est donc le deuxième pays du Sud-Est asiatique, après les Maldives, à avoir éradiqué le paludisme[102]. La Chine est devenue le le quarantième territoire ayant éradiqué cette maladie[103]. En Afrique en revanche, le paludisme est présent aussi bien dans les zones rurales qu'urbaines, même si le risque est diminué dans les grandes villes[104]. Les niveaux endémiques mondiaux de la maladie n'ont pas été cartographiés depuis les années 1960. Cependant, le Wellcome Trust britannique finance le Malaria Atlas Project[105] afin de rectifier ceci et d'évaluer le poids de cette maladie à l'avenir.
Finalement, le paludisme est la maladie parasitaire la plus répandue dans le monde. Elle est au 1er rang des priorités de l'OMS tant par ses ravages directs que par ses conséquences socio-économiques dont : une improductivité aboutissant à la sous-alimentation et au sous-développement[106].
Europe
Jusqu'au XIXe siècle, des épidémies de paludisme pouvaient se produire jusque dans le Nord de l'Europe. La régression du paludisme en Europe est principalement due à l'assèchement des marais et au drainage des zones humides[107]. La disparition du paludisme en France a étonné les chercheurs à tel point qu'on a pu parler à ce propos de disparition spontanée, voire de disparition mystérieuse. Il semblerait que cette disparition ait eu de multiples causes. Dans des régions comme la Sologne par exemple, diverses innovations agronomiques portant notamment sur les pratiques culturales ont pu à cet égard jouer un rôle appréciable en cumulant chacune leur effet. La maladie a commencé à régresser, comme ailleurs en Europe, avant l'utilisation de la quinine, qui fut d'ailleurs employée au début de façon inappropriée, trop tardivement ou en doses trop faibles[29]. L'adoption de la quinine a servi toutefois à accélérer la disparition de la maladie dans les régions où elle était en régression[107].
En Grèce
En 2016, le centre grec de contrôle et de prévention des maladies a interdit le don du sang dans 12 communes du pays pour cause de paludisme, après que l'infection eut été considérée comme disparue durant quarante ans[108].
En France
En France métropolitaine, la malaria n'a disparu que relativement récemment. La maladie était encore commune au XIXe siècle[107]. Elle était encore présente en 1931 dans le marais poitevin, la Brenne, la plaine d'Alsace, les Flandres, les Landes, en Sologne, en Puisaye[109], dans le golfe du Morbihan, en Camargue… Durant tout le Moyen Âge et jusqu’aux XVe – XVIe siècles, le paludisme affectait surtout les campagnes ; ce même lorsque bon nombre de cités étaient établies le long des fleuves pour les commodités de transport, et malgré les crues périodiques de ces fleuves dans bien des endroits. La Renaissance vit une recrudescence des fièvres, les guerres de Religion forçant les citadins à s’enfermer dans des murailles entourées de fossés aux eaux croupies. De même à Paris à la fin du XIXe siècle, lors des grands travaux de Haussmann, qui ont occasionné des creusements importants et de longue durée. Les flaques, mares et autres points d'eau croupie perduraient longtemps, engendrant une pullulation d'anophèles au milieu d'une grande concentration d'humains. De plus, un grand nombre d'ouvriers venaient de régions infectées et étaient porteurs du plasmodium.
En 1802, l'épidémie de Pithiviers a motivé par sa gravité l'envoi d’une commission de la Faculté de médecine. Elle était due à une très grosse crue, d'ampleur inhabituelle, qui avait couvert d'eau les prairies avoisinantes pendant plusieurs semaines[109].
Cette maladie a été éradiquée de Corse en 1973. Inconnu du temps de la présence romaine, le paludisme y fut introduit lors des raids vandales. La Corse connaît sa dernière épidémie de cas non importés à Plasmodium vivax de 1970 à 1973. Fait notable, en 2006 est survenu un cas autochtone de Plasmodium vivax sur l'île. Depuis, la quasi-totalité des cas observés en France sont des paludismes d'importation. Des troupes venant des colonies furent à l'origine des dernières épidémies mentionnées[109].
Disparition du paludisme autochtone
Les facteurs critiques affectant la propagation ou l'éradication de la maladie ont été les changements de comportements humains (méthodes d'agriculture avant tout, déplacements de population, etc.), le niveau de vie (la pauvreté était et reste la principale cause de mortalité) et la densité de la population (plus la densité humaine est grande et plus la densité de moustiques sera grande).
L’usage du quinquina et de la quinine devient courant en seconde moitié du XIXe siècle. P. malariae, qui y est plus sensible, a disparu avant P. vivax. Mais les doses employées sont insuffisantes pour empêcher le développement des hématozoaires chez l'humain.
Autre facteur déterminant : les méthodes d'élevage changent. La stabulation permanente augmente, qui permet de récupérer les fumiers. En 1893, autour de Strasbourg, seules trois ou quatre communes ont encore plus de 12 % de leur superficie utilisable réservée aux pâtures. Les surfaces en prairies naturelles (humides) diminuent au profit des terres labourées (assainies) – ce d'abord dans les régions d'agriculture riche. Le nombre de bêtes augmente, ce qui diminue d'autant les attaques des moustiques sur l'humain.
Un troisième facteur entre en jeu : l'aménagement du territoire, qui comporte plusieurs aspects. Une loi est adoptée en 1821 pour le dessèchement des étangs insalubres. Cette loi a été dans l'ensemble peu suivie ; cependant l'idée était lancée, et les étangs les plus proches des maisons furent les plus nombreux à être comblés (car plus faciles d'accès). Or les moustiques adultes ne se déplacent pas à plus de 300 m de leur point d'origine. Cet assèchement a donc certainement été une cause importante de la régression de la maladie.
Autre aspect de l'aménagement du territoire : l'accroissement du nombre de fossés et leur meilleur entretien, qui permet de mieux drainer les terres.
Dans les Landes et en Sologne la reforestation est un facteur également, les arbres drainant l'eau plus efficacement qu'un couvert végétal moindre.
Le type de charrue change : la brabant double, qui permet un labour à plat, donne des sillons moins hauts (donc moins d'eau stagnante dans le creux des sillons en périodes humides) et permet par ailleurs un labour plus profond (donc un meilleur ressuyage des terres lourdes), commence à se répandre à partir de 1850 en Brie, remplaçant la charrue non réversible et ses dérivées qui donnaient des labours en billons. La pratique du chaulage se répand également, qui allège les sols lourds et en facilite donc le ressuyage. Le marnage contribue à la résorption des eaux superficielles.
Toutes ces dispositions agronomiques contribuent fortement à réduire les épidémies de paludisme et autres fièvres[109]. Au moment de la Première Guerre mondiale, il ne restait plus que quelques foyers très localisés.
Le paludisme endémique a complètement disparu en France en 1960[110].
Une quarantaine de personnes en France en vingt ans ont été contaminées dans des aéroports[111] à cause de moustiques qui auraient voyagé dans des avions depuis des zones empaludées.
Sur l'île de La Réunion et la République de Maurice, le paludisme était la première cause de mortalité il y a encore 60 ans. L'éradication de la maladie a été confirmée par l’Organisation mondiale de la santé en 1979[112].
Augmentation du paludisme d'importation
Le paludisme d'importation s'observe principalement chez les voyageurs, migrants et militaires en provenance de pays endémiques. Il fait l'objet d'une surveillance par un réseau d'une centaine d'hôpitaux volontaires bénévoles en lien avec le Centre national de référence (CNR) du paludisme[113].
Ce paludisme est le reflet de la situation mondiale. Par sa situation, la France fait office de « sentinelle » de ce qui se passe en pays endémiques, principalement l'Afrique subsaharienne. Après une amélioration significative autour de la période 1990-2010, la situation mondiale marque le pas. Selon l'OMS, onze pays ont enregistré une augmentation de cas depuis 2015[114].
La France métropolitaine est le pays industrialisé qui recense le plus grand nombre de cas de paludisme d'importation, avec près de 5 000 cas annuels. En 2017, 2721 cas ont été déclarés au CNR du paludisme, soit environ 5 220 cas estimés selon la représentativité du réseau de surveillance, en augmentation de 10,3 % par rapport à 2016[113].
Toujours en 2017, 82,8 % des cas déclarés l'ont été chez des sujets d'origine africaine, et pour 95 % d'Afrique subsaharienne. Sur un total de 59 pays de contamination, 15 pays représentent 92,4 % des cas déclarés. Les trois premiers sont la Côte d'Ivoire (30 %), le Cameroun (20 %), et la Guinée (plus de 5 %). Parmi ces pays d'Afrique, certains sont en baisse ou en hausse, selon le nombre de voyageurs ou de militaires provenant de zones où le paludisme baisse ou augmente[113].
Au total, 13 décès ont été déclarés (létalité de 0,48 % sur l'ensemble des cas, et de 3,4 % pour les formes graves). Le non-respect des recommandations de prévention (absence de protection contre les moustiques et de chimioprophylaxie) est à l'origine de la plupart des cas. Un effort d'information supplémentaire est nécessaire envers les sujets originaires d'Afrique qui rendent visite à leurs proches dans leur pays d'origine[113].
Le migrant, primo-arrivant d'une zone d'endémie, présente rarement un paludisme en raison d'une immunité acquise. Cette immunité disparait en moins de 4 ans en France. Le migrant contracte alors le paludisme lors d'un retour au pays pendant la période des vacances en France, ce qui correspond généralement en Afrique de l'Ouest à la saison des pluies, où la transmission est la plus intense[115].
Régions à risques
Après avoir sévi dans la presque totalité du monde habité, le paludisme touche 90 pays[116] (99 pays selon le rapport 2011 de l'OMS[117]), essentiellement les plus pauvres d'Afrique, d'Asie et d'Amérique latine. Dans les années 1950, le paludisme avait été éradiqué de la majeure partie de l'Europe et d'une grande partie de l'Amérique centrale et du sud par des pulvérisations de DDT et l'assèchement des marais.
La dégradation des forêts peut le favoriser ; « une étude réalisée au Pérou en 2006 révèle que le taux de piqûre par les moustiques porteurs de malaria est 278 fois moins élevé dans les forêts intactes que partout ailleurs[118]. »
En 2006, l'Europe a connu de très nombreux cas de paludisme d'importation principalement en France (5 267 cas), au Royaume-Uni (1 758 cas) et en Allemagne (566 cas)[119]. En France, 558 cas sont des militaires, mais la maladie touche également les touristes : sur cent mille d'entre eux se rendant dans une zone impaludée, trois mille rentrent dans leurs pays infectés par l'une des formes connues de Plasmodium, le reste sont des cas importés par des immigrants.
- L'Afrique est un continent particulièrement touché par le paludisme ; il concerne 95 % des cas importés en France. Le danger est quasi nul en Afrique du Nord mais majeur en Afrique de l'Est, en Afrique subsaharienne et en Afrique équatoriale, aussi bien en zone rurale qu'en zone urbaine.
- En Asie, le paludisme est absent des grandes villes et plutôt rare dans les plaines côtières. Le danger est majeur dans les zones rurales du Cambodge, de l'Indonésie, du Laos, de la Malaisie, des Philippines, de la Thaïlande, de la Birmanie (Myanmar), du Viêt Nam et en Chine dans le Yunnan et à Hainan.
- Dans les Antilles, le paludisme sévit à Haïti et près de la frontière dominicaine.
- En Amérique centrale, il existe quelques micro-zones, mais le risque est relativement faible.
- En Amérique du Sud, le risque est faible dans les grandes villes, mais réel dans les zones rurales en Bolivie, en Colombie, en Équateur, au Pérou et au Venezuela, et majeur dans toute la zone amazonienne.
L'altitude et la température ambiante sont des facteurs importants dans l'impaludation ou non dans une zone.
- Certains anophèles (comme Anopheles gambiae) ne peuvent vivre guère au-delà de 1 000 mètres d'altitude mais d'autres (comme Anopheles funestus) sont parfaitement adaptés pour vivre jusqu'à 2 000 m[120].
- La maturation de Plasmodium à l'intérieur de l'anophèle ne peut s'opérer que dans une fourchette de température ambiante allant de 16 à 35 °C.
Lutte contre le paludisme par l'OMS
Le programme mondial d'éradication de l'OMS a été précédé par les projets impulsés et dirigés successivement par l'International Health Board, puis par la Fondation Rockefeller à partir de 1915 mais surtout à compter des années 1920. Ces deux organismes, émanations de la volonté philanthropique de John D. Rockefeller avaient déjà l’expérience de campagnes d'éradication de l'ankylostomose et de la fièvre jaune.
Rompant avec le consensus préconisant l’administration massive de quinine associée à des mesures de contrôle des populations de moustiques - notamment par des travaux de drainage -, les chercheurs de la Fondation Rockefeller basent dès 1924 leur stratégie sur la seule éradication des moustiques. Ils disposent alors pour ce faire du Vert de Paris, une substance très toxique, toutefois inefficace sur les moustiques adultes.
L’Italie fut le premier théâtre d'opération à partir de la fin des années 1920, suivi par tous les autres lieux d'intervention de la Fondation dans la région méditerranéenne et les Balkans. En dépit de résultats mitigés, cette ligne de conduite fut adoptée en Inde de 1936 à 1942. Là, associées à d'autres, ces mesures aboutirent à des résultats spectaculaires, mais temporaires : en 1941 la situation est semblable à celle prévalant avant le début de ce programme.
La Seconde Guerre mondiale qui suspendit certains programmes leur donna aussi de l'extension : la Foundation Health Commission fut créée en 1942 pour soutenir les efforts des forces armées soucieuses de protéger leurs soldats sur les zones de front. La mise au point du DDT, à laquelle les équipes de la Fondation participèrent, et la dispersion de cet insecticide à partir d'avions dans la zone inondée à l'ouest de Rome permirent le lancement de campagnes d'éradication de la malaria en Italie dès l'année 1946. Le plus fameux de ces programmes eut lieu en Sardaigne de 1946 à 1951[121]. Basé sur l'utilisation massive du DDT, ce programme aux méthodes et aux conséquences environnementales discutables et discutées, aboutit à l'éradication des moustiques et par voie de conséquence de la maladie, qui y était toutefois déjà tendanciellement sur le déclin[122].
En 1952, la Fondation Rockefeller mit fin à son programme de santé publique, et donc antipalustre, mais après que l'OMS ait créé (en 1948) un programme visant l'éradication du parasite en 1955 dans le monde hors Afrique sub-saharienne et Madagascar. Les États-Unis, voulant se prémunir contre l'importation du paludisme via l'Amérique du Sud, en furent un acteur majeur ; des considérations politiques — lutte contre le communisme — motivèrent également leur engagement[123]. Après des succès notables (l'Espagne est le premier pays que l'OMS déclara officiellement exempte de paludisme en 1964), le programme rencontre vite des difficultés ; en 1969 la XXIIe Assemblée mondiale entérine ses échecs mais maintient ses objectifs d'éradication mondiale. En 1972 un regroupement de pays décide à Brazzaville d'abandonner l'objectif d'éradication au profit d'un objectif de contrôle. La 31e Assemblée mondiale de l'OMS se rallie à ce changement en 1978 : il ne s'agit plus alors de viser au niveau mondial à l'élimination et à l'éradication du paludisme mais à son contrôle. En 1992 la Conférence ministérielle d'Amsterdam adopte la stratégie mondiale révisée de lutte contre le paludisme. Revue par d'autres instances internationales, cette stratégie est définie en 2001 par l'OMS [124].
L’OMS abandonne les procédures de certification d'éradication dans les années 1980 et les reprend en 2004.
En 1998 un partenariat RBM (Roll Back Malaria) associe l'OMS, l'Unicef, le PNUD et la Banque mondiale.
En 2007 la fondation Bill et Melinda Gates relance un projet d'éradication mondiale, étudié par une multitude de groupes d'expert, des articles scientifiques et aboutissant à des projets de stratégies de santé publique.
Mais en 2019, la plausibilité d'une éradication mondiale reste débattue. En août, l’OMS fait même savoir que selon ses experts, l’éradication du paludisme n'est pas envisageable dans un avenir proche, et que fixer une date limite pourrait saper les efforts contre la maladie, comme ce fut le cas quand l'OMS s'est fixé ce même objectif 64 ans plus tôt (la non-atteinte de tels objectifs peut fatiguer les donateurs et atténuer la volonté et les engagements politiques, et la date butoir peut insidieusement orienter les efforts là où il est plus facile de « faire du chiffre »). Après 3 ans d'études, un rapport[125] du Groupe consultatif stratégique sur l'éradication du paludisme (SAGme) de l'OMS indique : « Nous ne devons pas préparer le monde à l'échec d'un autre effort d'éradication du paludisme » et recommande de développer de nouveaux outils et approches contre le paludisme, dont en renforçant la couverture sanitaire universelle[126]. La Commission Lancet sur l'éradication du paludisme, qui réunit 26 universitaires du monde entier, souhaite au contraire fixer une date butoir (2050), principalement pour maintenir l'esprit du défi[126].
On estime que les efforts mondiaux pour combattre et éliminer le paludisme ont sauvé 3,3 millions de vies de 2000 à 2013 en réduisant les taux de mortalité dus à cette maladie de 45 % dans le monde et de 49 % en Afrique[127]. La lutte contre le paludisme fait partie d'une des cibles de l'Objectif de développement durable no 3 de l'ONU.
Une étude[128] publiée le 25 décembre 2019 met en avant que certaines populations d’insectes en Afrique ont développé une résistance aux insecticides massivement utilisés sur les moustiquaires. Ils ont démontré que la surexpression d’une protéine nommée SPA2 dans les pattes des moustiques leurs confèrent une résistance aux insecticides contenant des pyréthrinoïdes. Les protéines SPA2 se lient aux pyréthrinoïdes et empêchent la diffusion du composé toxique dans leur organisme. La protéine SPA2 « Sensory appendage protein » fait partie de la famille des protéines chemosensorielles « CSP ». La découverte de l’effet de cette protéine ouvre la voie à la création d’insecticide de 2e génération contenant des inhibiteurs spécifiques à la SPA2. Ceux-ci permettront de continuer la lutte contre la propagation de la maladie.
Impact socio-économique
Le paludisme est communément associé à la pauvreté, mais il représente aussi une cause majeure de la pauvreté et un frein important au développement économique et humain. La maladie a des effets économiques négatifs dans les régions où elle est répandue. Une comparaison du PIB par habitant en 1995, ajustée par parité à pouvoir d'achat, entre les pays touchés par le paludisme et ceux non touchés, montrait des écarts de 1 à 5 (1 526 USD contre 8,268 USD). De plus, dans les pays où le paludisme est endémique, le PIB pays habitant a cru de 0,4 % par an en moyenne de 1965 à 1990, contre 2,4 % pour les autres pays[129]. Cette corrélation ne montre toutefois pas que la causalité, et la prévalence du paludisme dans ces pays, est aussi en partie due aux capacités économiques réduites pour combattre la maladie.
Le coût économique du paludisme est estimé à 12 milliards USD par an pour l'Afrique seule[130]. Un cas exemplaire est celui de la Zambie. Si le budget que le pays consacrait pour lutter contre cette maladie en 1985 était de 25 000 USD, depuis 2008, grâce à l'aide internationale et au PATH (Program for Appropriate Technology in Health), il est de 33 millions répartis sur une période de neuf ans avec comme premier objectif la fourniture de moustiquaires à toute la population[131].
Au niveau individuel, l'impact économique inclut les frais de soins et d'hospitalisation, les jours de travail perdus, les jours de présence à l'école perdus, la baisse de productivité due aux dommages cérébraux créés par la maladie ; pour les États, à ces impacts s'ajoutent des baisses d'investissement et du tourisme[92]. Dans certains pays particulièrement touchés par le paludisme, la maladie peut être responsable de 40 % des dépenses publiques de santé, 30 à 50 % des patients admis à l'hôpital, et jusqu'à 50 % des consultations[132].
Causes
Le paludisme est causé par des parasites du genre Plasmodium, eux-mêmes transmis par les moustiques du genre Anopheles.
Plasmodium, le parasite responsable du paludisme

Le paludisme est causé par un parasite protozoaire du genre Plasmodium (Phylum apicomplexa). Chez les humains, le paludisme est, essentiellement, causé par P. falciparum (prépondérant en régions tropicales), P. malariae, P. ovale (espèce la plus rare, hormis l'Afrique de l'Ouest) et P. vivax (espèce la moins exigeante en température).
P. falciparum est la cause la plus commune des infections et responsable d'environ 80 % de tous les cas de paludisme ainsi que 90 % des décès[133]. Les Plasmodium infectent également les oiseaux, les reptiles, les singes, les chimpanzés et les rongeurs (animaux à sang chaud)[134]. On a rapporté des cas d'infections humaines avec des espèces simiesques du paludisme, dont P. knowlesi, P. inui (en), P. cynomolgi[135], P. simiovale, P. brazilianum, P. schwetzi et P. simium. Cependant, à l'exception de P. knowlesi, ces infections restent limitées et sans importance au regard de la santé publique. Le paludisme aviaire peut tuer les poulets et les dindes, mais cette maladie ne cause pas de dommages économiques notables à l'agriculture[136]. Cependant, depuis qu'il a été introduit par les humains, le paludisme a décimé les espèces endémiques d'oiseaux d'Hawaii, qui avaient évolué, en son absence, sans défense contre celui-ci[137].
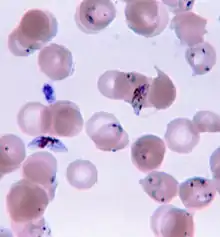
Le Plasmodium se présente sous la forme d'un protozoaire très petit (1 à 2 µm selon les formes). La coloration au May-Grünwald-Giemsa montre qu'il est constitué d'un cytoplasme bleu pâle entourant une vacuole nutritive claire et contenant un noyau rouge et du pigment brun-doré ou noir (hémozoïne).
Le cycle évolutif du Plasmodium est assez complexe et nécessite deux hôtes, un hôte intermédiaire : l'humain et un hôte définitif : la femelle hématophage d'un moustique du genre Anopheles (du grec anôphelês signifiant : inutile). D'un point de vue strictement biologique, le véritable hôte définitif est le moustique (la reproduction sexuée parasitant l'anophèle). L'humain ne serait qu'un hôte intermédiaire dans son cycle réplicatif. Néanmoins, pour des raisons anthropocentriques, on considère que le vecteur n'est pas l'humain mais le moustique et par conséquent que cette zoonose est du type zooanthroponose.
Anophèle, vecteur du paludisme

Interactions durables entre Anophèle et plasmodium
Seules les femelles d'anophèles sont hématophages. Les mâles dont les seules activités sont la reproduction de l'espèce et voler de-ci de-là pour se nourrir de sève de plantes et de nectar ne transmettent pas la maladie.
Les femelles anophèles se nourrissent de préférence la nuit, et commencent à chercher leur repas au crépuscule, en continuant la nuit jusqu'à ce qu'elles l'aient trouvé.
En respirant et en transpirant, les humains et animaux émettent du CO2, et leur corps dégage constamment de la chaleur et de l'humidité (transpiration) ainsi qu'un cocktail de substances potentiellement attractives (comme l'acide lactique) présentes dans l'haleine, la sueur ou le sébum[138]. Les moustiques femelles (ainsi que d'autres insectes piqueurs) peuvent détecter certaines de ces émanations corporelles depuis de longues distances (ex. : ±20 m pour le CO2) et sont immédiatement attirés par ces sources. Les moustiques pourraient être plus souvent attirés après ingestion d'alcool[139] ou par les couleurs foncées et plus spécialement le noir (qui engrange aussi la chaleur). Ils se déplacent (maximum 2 km) en utilisant leurs capteurs (chémorécepteurs).
Il y a longtemps que l’on pense que certaines personnes « attirent » plus les moustiques que d'autres, et des chercheurs ont en outre en 2011 confirmé que les anophèles mâles et femelles ne répondent pas aux mêmes stimuli chimiques et odorants[140].
D'un point de vue écologique et évolutionniste[141],[142] ou écoépidémiologique[143], pour mieux se diffuser, ce parasite aurait intérêt à attirer les anophèles femelles vers les humains (ou des animaux) malades du paludisme. Il est maintenant admis que de nombreux parasites peuvent dans une certaine mesure manipuler le comportement de leur hôte[144], et notamment chez des espèces préoccupantes pour la santé publique humaine[145]. Plusieurs études récentes ont montré que, lors des processus de coévolution parasite-hôte, des parasites ont acquis la capacité de modifier l’odeur de leur hôte à leur profit, en attirant des vecteurs[146]. Il a été confirmé en 2004[147] et 2005[148] que les malades de la malaria attirent plus les moustiques que les non-malades (un enfant malade du paludisme attire deux fois plus les anophèles piqueurs qu’un enfant non malade)[148]. Ceci a aussi été démontré en 2013 chez des animaux (oiseaux)[149], mais on ignorait par quel processus.
En 2014, une étude montre que des souris de laboratoire infectées par un plasmodium (Plasmodium chabaudii dans ce cas) ont une odeur corporelle qui change très significativement (tant que la souris reste infectieuse), et qui attire plus les anophèles que celle de souris non infectées[146].
En 2015, une autre étude apporte une probable explication à ce phénomène : en laboratoire, dans les cellules qu’ils infectent, les parasites (Plasmodium falciparum) se montrent capables de synthétiser une odeur terpénique attractive pour les anophèles femelles, grâce à leur apicoplaste (organite héritée - par endosymbiose - d'un organisme végétal, algue[150] ou organisme intermédiaire entre l’algue et la bactérie (cyanobactérie). Cet organite proche des chloroplastes a perdu sa capacité photosynthétique, mais reste capable de métaboliser des terpènes.
C’est ce qu’a montré Audrey R. Odom[151], de l'École de médecine de l'Université de Washington à Saint-Louis[152], avec ses collègues (notamment de l’Université de Yale), dans une étude publiée par la revue MBIO. Une partie de cette équipe avait déjà travaillé sur les apicomplexes[153] et montré la capacité des apicoplastes à biosynthétiser des isoprénoïdes[154]. Une étude précédente n'avait pas détecté de production de terpènes, mais elle était basée sur une faible quantité de plasmodiums[155]. L’équipe de Saint-Louis a eu l’idée de cultiver cette fois une quantité plus importante de plasmodiums, comparable à celle qui est présente dans un organisme infecté. La culture a été faite dans des lots de globules rouges humains infectés, dont les émissions gazeuses ont ensuite été comparées à celles de lots identiques mais non infectés, ainsi qu'au gaz trouvé dans les mêmes sachets de plastique mais vides (témoins). Selon les résultats de cette étude publiés en 2015[156], seuls les sachets recelant des globules infectés contenaient des terpènes[156]. Les auteurs ont montré que pour faire cela (comme certaines plantes), P. falciparum mobilise une voie biochimique dite « plastidial isoprenoid biosynthesis pathway » pour synthétiser deux terpènes (limonène et pinanédiol, qui ont respectivement une odeur citronée et une évoquant le pin) et deux autres molécules (dont le rôle éventuel n’a pas été identifié). Chaque échantillon gazeux provenant d'une culture de cellules sanguines contenant des globules porteurs du parasite contenait au moins l'un de ces deux terpènes[156]. On savait déjà (démontré en 2012) que ces deux terpènes (produits par les fleurs qui produisent le nectar le plus attractif pour les anophèles mâles) attirent les mâles d’anophèles (même à très faible dose)[157].
Des tests complémentaires ont confirmé que les anophèles femelles qui transmettent le paludisme (Anopheles gambiae) sont bien capables de détecter ces terpènes et qu’ils y réagissent, grâce au fait qu’ils contiennent la « machinerie cellulaire nécessaire pour détecter ces composés et y répondre », selon Odom (même si d’autres molécules sont aussi connues pour les attirer[156] ; le CO2 a ainsi été présenté comme un facteur majeur d'attraction[158], mais on a montré (2014) que des souches d’Anopheles gambiae privées du récepteur au CO2, à la chaleur et à l'acide lactique restent parfaitement capables de localiser un hôte humain pour se nourrir de son sang[159], ce qui montre que d’autres molécules sont « pistées » par le moustique et le guident dans son choix d’hôte où effectuer son repas de sang.
Ceci suggère que les humains (ou les animaux) infectés par le paludisme risquent plus d'être piqués par un moustique, et même d’être piqués plus d'une fois, en contribuant à la diffusion de l’épidémie, mais à la suite de cette démonstration in vitro, il reste encore à démontrer in vivo chez l’humain ou l’animal que ces terpènes sont effectivement relargués par la peau ou l’haleine et que, sous cette forme ou sous une forme modifiée, ils attirent effectivement les anophèles, ce que le laboratoire[160] de St Louis souhaite faire rapidement[156].
Ces informations ouvrent des pistes de nouveaux tests diagnostiques non invasifs pour le paludisme, basés par exemple sur l’analyse de l’odeur de la peau, de l’haleine (à la manière d’un alcootest) ou de la sueur. Des pistes nouvelles de lutte contre la diffusion du parasite se dessinent aussi : en manipulant l'odeur perçue par le moustique, il serait peut-être possible de limiter l’attrait des anophèles pour les malades du paludisme, ou au contraire de produire des leurres moléculaires permettant de piéger les femelles d’anophèles avant qu’elles ne piquent[156].
| Nom de la zoonose | Cause | Transmission | Vecteur |
|---|---|---|---|
| Chikungunya | Virus | Le jour La nuit |
femelle Aedes femelle Anopheles funestus |
| Dengue | Virus | Le jour | femelle Aedes |
| Encéphalite japonaise | Virus | La nuit | femelle Culex |
| Fièvre jaune | Virus | Le jour | femelle Aedes |
| Filariose lymphatique | Parasite | La nuit | femelle Anopheles |
| O'nyong-nyong | Virus | La nuit | femelle Anopheles |
| Paludisme | Parasite | La nuit | femelle Anopheles |
Cycle parasitaire
Chez l'anophèle
Le vecteur du parasite ainsi que son hôte primaire est la femelle d'un moustique du genre Anophèle. Les jeunes moustiques ingèrent le parasite pour la première fois lorsqu'ils se nourrissent du sang (nécessaire à cette femelle pour sa production d'œufs) d'un sujet humain infecté. Une fois ingérés, les gamétocytes de Plasmodium se différencient en gamètes mâles et femelles puis s'unissent pour former un zygote mobile, appelé ookinète, qui pénètre la paroi stomacale du moustique pour devenir un oocyste sphérique, dont le noyau va se diviser à de multiples reprises pour former des sporozoïtes. La durée de cette maturation est étroitement dépendante de la température extérieure. Par exemple pour P. falciparum : pas de maturation en dessous de 18 °C ou au-dessus de 35 °C, elle est maximale vers 24 °C. Quand l'oocyste rompt, il relâche les sporozoïtes qui migrent dans le corps du moustique jusqu'aux glandes salivaires d'où ils peuvent, lors d'un nouveau repas de sang, infecter un nouvel hôte humain, en traversant la peau avec la salive[161],[162].
Phase hépatique
Mince fuseau de 12 µm / 1 µm, le sporozoïte infectieux injecté à l'humain, lors de cette piqûre par une femelle d'anophèle infectée, circule rapidement (moins d'une demi-heure) dans le sang jusqu'au foie dans lequel il est séquestré en grande partie grâce aux motifs adhésifs de la protéine majoritaire de son enveloppe, la protéine circumsporozoïte ou CSP = Circumsporozoite protein, pour ensuite infecter les hépatocytes. Cette crise pré-érythrocytaire hépatique qui va durer de 7 à 15 jours pour P. falciparum, de 15 jours à 9 mois pour P. vivax, de 15 jours à X mois pour P. ovale et 3 semaines pour P. malariae permettra au parasite de poursuivre son cycle. Les sporozoïtes qui n'atteindront pas le foie seront soit éliminés par les phagocytes, soit incapables de poursuivre leur évolution s'ils atteignent d'autres organes.
Une première transformation arrondit cette forme « cryptozoïte » (du grec κρυπτός (kruptos) signifiant « caché ») en un élément uninucléé (avec un seul noyau) appelé trophozoïte qui est l'occasion pour le parasite de se multiplier directement (il en est toujours ainsi pour P. falciparum), par schizogonie, pendant une semaine à quinze jours aboutissant à un énorme schizonte (nom donné au protozoaire lorsqu'il devient actif après la phase d'incubation) de 40 à 80 μm. Ce corps bleu (parce que constitué d'un cytoplasme bleu pâle lorsqu'il est coloré au May-Grünwald-Giemsa) bourgeonne, tout en perdant de sa mobilité, de manière à émettre des vésicules, contenant les jeunes mérozoïtes qui seront transférés dans le sang, initiant ainsi le stade érythrocytaire, c'est-à-dire l'infection des globules rouges.
Cependant, certains mérozoïtes de P. ovale ou P. vivax peuvent rester cachés dans le foie plusieurs années, voire la vie entière pour P. malariae, avant de se réactiver en vagues successives. Il s'agit de cycles exo-érythrocytaires secondaires qui vont entretenir dans le foie la parasitose pendant deux ou trois ans pour P. Ovale, 3 à 5 ans ou plus pour P. Vivax et pendant la vie entière pour P. Malariae. Cette phase du parasite est appelée « phase dormante ». Ces parasites latents intra-hépatiques sont appelés « hypnozoïtes » (du grec Ὕπνος qui est Hypnos l'antique dieu grec du sommeil).
Phase de transfert
Les vésicules sont libérées dans les sinusoïdes hépatiques (vaisseaux capillaires du foie faisant la jonction entre celui-ci et le réseau sanguin) pour rejoindre ensuite la circulation sanguine et y répandre un flot de jeunes mérozoïtes « pré-érythrocytaires » prêts à infecter les globules rouges. Chaque cellule de foie infectée contient environ 100 000 mérozoïtes (chaque schizonte est capable de produire 20 000 mérozoïtes). C'est une véritable technique de « Cheval de Troie » qui est ici utilisée pour passer des cellules hépatiques au sang. L'imagerie in vivo a montré en 2005-2006 chez des rongeurs que les mérozoïtes étaient capables de fabriquer des cellules mortes leur permettant de quitter le foie pour la circulation sanguine en échappant ainsi au système immunitaire). Ils semblent à la fois guider ce « véhicule » et s'y cacher en masquant les signaux biochimiques qui alertent normalement les macrophages. Il y a peut-être là une piste nouvelle pour des médicaments actifs ou un vaccin anti-stade exo-érythrocytaire avant le stade de l'invasion des globules rouges.
Phase sanguine
Au début de la longue phase sanguine[163] : les mérozoïtes s'accolent aux globules rouges, les envahissent, s'y développent en trophozoïtes puis s'y divisent (schizontes).
En 2011, une équipe internationale a découvert que parmi les récepteurs de surface du globule rouge permettant l'entrée du parasite, l'un d'eux est indispensable à cette pénétration (confirmé avec toutes les souches testées en ce qui concerne P. falciparum) ; ce récepteur devient de ce fait une cible pour de futures recherches d'un vaccin[164].
En se diffusant, les mérozoïtes font éclater les globules rouges (c'est l'hémolyse).
L'éclatement des schizontes mûrs ou « rosaces » termine le premier cycle schizogonique érythrocytaire en libérant dans le sang, une nouvelle génération de plasmodiums, les mérozoïtes « érythrocytaires » capables de réinfecter d'autres globules rouges.
Une succession régulière de cycles semblables va suivre, qui seront progressivement remplacés (les défenses immunitaires s'organisant) par des cycles érythrocytaires gamogoniques préparant les formes sexuées. Les trophozoïtes arrêtent de se diviser et modifient leur rapport nucléo-plasmatique. Ces formes de trophozoïtes avec un noyau volumineux et un cytoplasme densifié sont des gamétocytes mâles et femelles, qui vont demeurer en attente dans le sang.
Les parasites lors de cette phase n'ont aucune chance de survie dans l'être humain : ils restent vivants une vingtaine de jours puis disparaissent. Ils ne pourront poursuivre leur évolution que chez le moustique. À ce moment si un anophèle femelle pique une personne malade, il absorbe des gamétocytes contenus dans le sang, et un nouveau cycle, sexué cette fois, débute dans le moustique. Les sporozoïtes produits par cette reproduction passent dans la salive du moustique, qui peut infecter un nouvel hôte, et ainsi de suite…
Physiopathologie
Manifestations cliniques
Les hématozoaires inoculés par le moustique se localisent et se multiplient d'abord dans le foie. Cette phase définit une période d'incubation minimale, sans aucun symptôme.
Les manifestations cliniques du paludisme apparaissent au début de la phase sanguine, lorsque la parasitémie dépasse un seuil, variable selon les individus[165]. Cette multiplication asexuée des plasmodiums à l'intérieur des hématies fait du paludisme, au sens propre, une maladie parasitaire des globules rouges.
La lyse des hématies parasitées (éclatement des schizontes mûrs ou rosaces) libère de nouveaux parasites (mérozoïtes) qui contaminent à leur tour d'autres hématies. Cette destruction entraine aussi une libération des déchets du métabolisme plasmodial (pigments et débris cellulaires du globule rouge, ou hémozoïne), ces substances pyrogènes perturbent le fonctionnement de l'hypothalamus (production de cytokine comme le TNFα) et causent de fortes fièvres[166].
Les premiers cycles sont d'abord asynchrones (paludisme de primo-invasion, avec fièvre continue ou anarchique), puis ils se synchronisent selon un rythme périodique, en fonction de l'espèce de Plasmodium. Le temps qui s'écoule entre la pénétration d'un parasite dans un globule rouge et l'éclatement de celui-ci est assez constant et atteint chez l'être humain 48 heures pour P. vivax, P. ovale et P. falciparum (fièvres tierces), 72 heures pour P. malariae (fièvre quarte) ; et pour P. knowlesi, la dernière espèce confirmée chez l'Homme, 24 heures seulement[167].
En cas de parasitisme intense, la destruction des globules rouges est telle qu'il apparait une anémie hémolytique et un ictère. L'organisme réagit par une hyperplasie (production accrue) des macrophages, ce qui explique l'augmentation de taille du foie (hépatomégalie) et de la rate (splénomégalie)[165].
P. falciparum se distingue des autres espèces de Plasmodium en ayant la capacité d'effectuer sa phase sanguine au niveau des capillaires viscéraux, notamment du tissu cérébral. Il peut se former alors des « rosettes » (amas d'hématies saines et parasitées), formations qui adhèrent aux parois des capillaires. Cette situation peut s'accompagner d'une hypoxie secondaire , de perturbations métaboliques et hydro-électrolytique, de lésion vasculaires (parois des petites vaisseaux) et tissulaires[165].
Non traité, le paludisme par P. falciparum présente un risque vital immédiat (risque de syndrome de défaillance multiviscérale, par exemple)[165]. Les différents paludismes sont susceptibles d'évoluer vers des formes chroniques (formes historiques), avec détérioration progressive de l'état général pouvant aboutir à la cachexie[168].
Immunité
Après plusieurs années d'infections répétées, l'hôte du Plasmodium peut acquérir une immunité, appelée prémunition (symptômes atténués d'une maladie qui protège contre une infection ultérieure de type sévère). On constate une grande variabilité des réponses à l'infection palustre entre des individus vivant dans les mêmes zones d'endémie. Dans des régions où la transmission est forte, une grande proportion des enfants sont souvent porteur de parasites de P. falciparum sans déclarer aucun symptôme ; c'est l'immunité clinique. Avec l'âge et les contacts successifs être humain/parasite s'installe peu à peu cette prémunition, qui fait appel à des mécanismes de résistance à l'infection parmi lesquels les protéines « interférons » métabolisées et excrétées, entre autres, par le foie jouent un rôle majeur dans l'immunité anti-parasite. On parlera, alors, de tolérance à l'infection ou d'immunité anti-parasite. Une hypothèse est que le Plasmodium a besoin de fer pour se développer ; le déficit en fer dû à une première infection apporterait une protection relative et éviterait une « superinfection »[169].
On dit souvent que cette immunité n'est pas stérilisante car il n'a jamais été démontré de façon formelle de disparition totale des parasites de P. falciparum en l'absence de traitement. On dit aussi que cette immunité est labile car la prémunition disparait en l'absence de contacts fréquents entre l'être humain et le parasite (elle disparait après 12 à 24 mois si le sujet quitte la zone d'endémie) ainsi que chez la femme enceinte.
Par ailleurs, l'immunité dirigée contre P. falciparum est fortement spécifique de la ou des souches[170] parasitaires présentes.
Ces particularités de la réponse immunitaire contre le paludisme sont à l'origine des difficultés pour élaborer un vaccin.
Facteurs génétiques
Des facteurs génétiques peuvent protéger contre le paludisme (voir : avantage hétérozygote). La majeure partie de ceux qui ont été décrits sont associés aux globules rouges. En voici quelques exemples :

- la drépanocytose (du grec drepanos, « faucille » au regard de la forme allongée qu'ont un certain nombre d'hématies -ou globules rouges) aussi appelée hémoglobinose S, sicklémie, ou anémie falciforme : une modification dans la chaîne ß de l'hémoglobine entraîne une déformation des globules rouges, ce qui produit des hétérozygotes qui protègent mieux contre le paludisme. Les hématies sont déformées et l'hémoglobine cristallise, ce qui empêche le parasite d'entrer dans l'hématie. Ce changement entraîne cependant une mauvaise oxygénation des organes (les hématies allongées ne peuvent passer dans les fins capillaires ni la barrière que constitue le filtre de la rate où elles sont détruites) et, donc, de sévères complications, allant jusqu'au décès pour les sujets homozygotes (HbS/HbS). La prévalence de la drépanocytose (HbA/HbS) est élevée dans les populations africaines soumises à une forte pression du paludisme en raison de la résistance qu'elle procure contre les accès graves de la maladie ;
- la thalassémie ou anémie héréditaire : le sujet est porteur du gène SS entraînant une modification des taux de synthèse des chaînes de globines avec pour conséquence une mauvaise circulation du sang et une fatigue constante ;
- le déficit génétique en G6PD (Glucose-6-phosphate déshydrogénase) appelé aussi favisme, qui est une enzyme antioxydante protégeant normalement contre les effets du stress oxydatif dans les globules rouges, donne une protection accrue contre le paludisme grave ;
- le HLA-B53 est associée à un faible risque de paludisme grave. Cette molécule CMH (complexe majeur d'histocompatibilité) de classe I présente dans le foie est un antigène des lymphocytes T (car situées dans le thymus) contre le stade sporozoïte. Cet antigène, encodé par IL4 (Interleukin-4), produit par les cellules T (thymus), favorise la prolifération et la différenciation de la production d'anticorps-cellules B. Une étude des Peuls du Burkina Faso, qui ont moins de deux attaques de paludisme avec des niveaux plus élevés d'anticorps antipaludiques que les groupes ethniques voisins, a constaté que l'allèle IL4-524 T était associé à des niveaux élevés d'anticorps contre le paludisme, ce qui soulève la possibilité que ce pourrait être un facteur d'augmentation de la résistance au paludisme ;
- dans la lutte naturelle contre P. vivax en Afrique, le processus de sélection a fait disparaître du patrimoine génétique un récepteur membranaire des érythrocytes, la glycoprotéine DARC (Duffy Antigen Receptor for Chemokines), c'est la cible d'entrée de P. vivax. Ainsi les sujets négatifs du groupe sanguin Duffy, en abrégé FY (-) ne peuvent être contaminés par P. vivax[171]. Ceci explique l'absence de P. vivax dans la population ouest-africaine exclusivement ou très majoritairement du groupe sanguin « Duffy-négatif ». Cependant, cette immunité naturelle pourrait être remise en question, P. vivax ayant réussi à s'adapter à Madagascar chez des sujets Duffy-négatifs, à la suite du brassage génétique entre populations africaine et asiatique[172]. Ce qui montrerait l'existence de cibles secondaires du parasite qui restent à déterminer[173].
D'autres facteurs génétiques existent, dont certains sont impliqués dans le contrôle de la réponse immunitaire[174].
Clinique
Le paludisme se manifeste par des accès de fièvre ou « accès palustres ». Classiquement, il est habituel de décrire l'accès de primo-invasion survenant pour la première fois chez un patient « naïf » (n'ayant plus d'immunité contre le paludisme, ou n'ayant pas rencontré le parasite auparavant), et les accès palustres récurrents survenant chez les sujets déjà infectés par le Plasmodium.
En pratique moderne, on distingue les accès simples et les formes graves. Les accès simples sont susceptibles de se transformer en forme grave (surtout ceux à P. falciparum), non diagnostiqués ou non traités, ils peuvent aussi évoluer en formes chroniques. Aussi, la suspicion d'un accès palustre est considérée comme une urgence diagnostique et thérapeutique[175].
Accès palustre simple
L'incubation est de 7 jours minimum jusqu'à 3 mois, selon les types de Plasmodium.
Paludisme de primo-invasion
La primo-invasion par des Plasmodium autres que falciparum peut être non ou peu symptomatique, passant inaperçue. Sinon, le premier accès palustre est commun à toutes les formes de Plasmodium. Il survient chez le patient non immun : adulte ayant perdu son immunité en résidant dans une zone non-endémique, ou voyageur arrivant en zone endémique, ou enfant né et atteint pour la première fois en zone endémique.
La fièvre est le signe majeur dans 90 % des cas, elle est progressivement croissante jusqu'à plus de 40 °C. Elle s'accompagne d'un syndrome pseudo-grippal (céphalées, douleurs musculaires ou articulaires) et de troubles digestifs (nausées, vomissements, diarrhées, etc.). Chez l'enfant, les signes digestifs peuvent être dominants (tableau de gastro-entérite fébrile, etc.).
Cette fièvre est continue ou anarchique (pas de périodicité), car les cycles érythrocytaires ne sont pas encore synchronisés (cycles asynchrones)[176].
Accès récurrents
La « crise de paludisme » est caractérisée par des accès fébriles intermittents. Classiquement, chaque accès comporte 3 phases[176] :
- Phase de froid : frissons et tremblements intenses par sensation de froid extrême, alors que la température s'élève, durant environ une heure ;
- Phase de chaleur : fièvre en plateau à 40-41 °C, durant 3 à 4 heures ;
- Phase de sueurs abondantes : avec chute brutale de la fièvre en 2 à 4 heures.
Ces accès se répètent régulièrement, en fonction des cycles érythrocytaires. Classiquement, on distingue la fièvre tierce (c'est-à-dire survenant tous les deux jours) due à Plasmodium vivax et Plasmodium ovale (fièvre tierce bénigne) et Plasmodium falciparum (fièvre tierce maligne) de la fièvre quarte (c'est-à-dire survenant tous les 3 jours) due à Plasmodium malariae (le terme « malaria » désignait spécifiquement la fièvre quarte).
En absence ou insuffisance de traitement, ces accès palustres peuvent se répéter pendant des mois voire des années, avec P. ovale, P. vivax et surtout avec P. malariae, sauf s'ils sont correctement traités et en l'absence de réinfestation (cas du paludisme d'importation, en général).
Avec P. falciparum, l'évolution est plus courte, mais avec des risques élevés de formes létales.
| |||||||||||||||||||||||||||||||||||
| * Les temps d'incubation peuvent être prolongés de plusieurs semaines à plusieurs mois, en cas d'insuffisance de prophylaxie antipalustre |
P. ovale et P. vivax sont très proches et ont été longtemps confondus[178].
Il existe des infections mixtes par deux espèces de Plasmodium dans environ 3 à 4 % des cas. Par exemple une co-infection par P. ovale et P. vivax réalise une superposition de cycles de deux populations de parasites, se manifestant par des accès palustres journaliers ou malaria tertiana quotidiana[177]. Elle était aussi appelée fièvre double tierce[179].
D'où l'existence de nombreuses variantes à dénominations historiques telles que : fièvre demi-tierce (accès quotidiens alternativement faibles et intenses), fièvre double quarte (accès deux jours consécutifs séparés par un jour sans). Les fièvres pseudo-palustres sont des fièvres intermittentes dues à d'autres causes que le paludisme[180].
Accès palustres graves
Le paludisme grave est dû très majoritairement à P. falciparum et survient généralement 6 à 14 jours après l'infection[181]. Il peut apparaître d'emblée, ou après un traitement inadapté ou tardif[165].
Au XXIe siècle, il se définit par des critères cliniques et biologiques, internationaux (OMS)[182] ou nationaux, régulièrement révisés. En France 2017, les principaux critères d'un paludisme grave d'importation de l'adulte, sont[165] :
- défaillance neurologique (de l'obnubilation au coma) ;
- ictère clinique ou à bilirubinémie élevée ;
- hyperparasitémie supérieure à 4 % ;
- insuffisance rénale (créatininémie ou urémie élevée).
D'autres critères, moins fréquents mais indicateurs de gravité, sont les défaillances respiratoire et cardiocirculatoire et les états biologiques d'acidose et d'hyperlactatémie[165].
Non traité, le paludisme sévère peut progresser rapidement et entrainer le coma et la mort en quelques jours voire quelques heures[182], surtout chez les jeunes enfants et les femmes enceintes qui sont particulièrement vulnérables. D'où l'intérêt d'un diagnostic d'urgence sans retard de traitement. Dans les cas les plus graves, le taux de mortalité peut dépasser 20 %, même avec un traitement correct sans trop de retard[183].
Des formes graves à P. vivax peuvent se voir, notamment en Asie du Sud-Est, les principales complications sont alors respiratoires. Le paludisme à P. knowlesi se présente le plus souvent comme un accès simple, mais il peut évoluer sous une forme grave (mais sans atteinte cérébrale)[165].
Un infarctus de la rate, ou une rupture de rate peut se voir avec toute espèce de Plasmodium, plus souvent P. falciparum et P. vivax[165].
Neuropaludisme
Il s'agit d'un accès palustre grave dominé par des manifestations neurologiques, le neuropaludisme étant lié à l'atteinte des capillaires du cerveau. C'est la cerebral malaria des anglo-saxons, et historiquement chez les francophones l'accès pernicieux[179].
Vers la fin du XXe siècle, les experts de l'OMS ont élargi la notion d'accès palustre grave, à d'autres manifestations autre que neurologiques, pour des raisons pragmatiques (même gravité du pronostic, même urgence du même traitement)[179]. Aussi au XXIe siècle, les termes d'accès ou de forme grave (français), ou de severe malaria (anglais) sont plus souvent utilisés que neuropaludisme ou cerebral malaria, plus restrictifs.
L'accès pernicieux survient progressivement ou brutalement. Il associe fièvre et troubles de la conscience. Des convulsions sont localisées ou généralisées à l'ensemble du corps, surtout chez l'enfant[179], et dans seulement 50 % des cas chez les autres adultes. Cela est dû à un mauvais fonctionnement du foie et à une consommation exagérée de sucre par le parasite. Les femmes enceintes sont particulièrement prédisposées à l'hypoglycémie et à la surproduction d'acide lactique entrainant une augmentation de l'acidité du sang.
Les autres signes neurologiques sont variables dans le temps et la localisation. Ils peuvent s'accompagner d'une anémie, d'une insuffisance hépatique, et d'une insuffisance rénale fonctionnelle et transitoire, ou d'une insuffisance rénale aiguë plus grave[179].
Un œdème pulmonaire est une complication rare mais grave, de très mauvais pronostic[179]. Il est mal expliqué, avec un taux de mortalité dépassant 80 %.
Fièvre bilieuse hémoglobinurique
Il s'agit d'une complication historique, surtout observée entre 1910 et 1940, et devenue rarissime vers la fin du XXe siècle[179]. Il s'agissait d'un syndrome survenant chez des européens expatriés en zone endémique tropicale, ayant des antécédents d'accès à Plasmodium falciparum, et prenant irrégulièrement de la quinine[165].
Elle est d'origine immuno-allergique liée au médicament, avec hémolyse intravasculaire massive ( éclatement des globules rouges à l'intérieur des vaisseaux)[165].
Le début est brutal, survenant dans les heures qui suivent la prise du médicament, avec fièvre et lombalgies, ictère et chute tensionnelle. L'anémie hémolytique entraîne une hémoglobinurie (présence d'hémoglobine dans les urines, leur donnant une couleur foncée, blackwater fever pour les Anglais, ou urines rouge porto pour les Français)[179]. L'évolution peut se faire vers une insuffisance rénale aiguë par destruction des tubules rénaux (nécrose tubulaire aiguë).
La parasitémie est faible ou nulle, ce qui distingue ce syndrome d'un accès pernicieux[179].
Cette fièvre bilieuse hémoglobinurique a pratiquement disparu avec le remplacement de la quinine par des antipaludéens de synthèse tels que les amino-4-quinoléines (comme la chloroquine)[179]. Cependant des cas ont été rapportés avec des médicaments chimiquement proches de la quinine, comme l'halofantrine ou la méfloquine. Ces trois médicaments sont formellement contre-indiqués chez les sujets sensibles[165].
Diagnostic
Pays développés
Toute fièvre justifie la recherche d'antécédents de voyage ; et au retour d'une zone d'endémie palustre, toute fièvre ou histoire de fièvre est un paludisme jusqu'à la preuve du contraire, en raison du risque d'évolution rapide vers une forme grave. En France, cela concerne principalement les voyageurs migrants au retour d'Afrique subsaharienne, même en cas de chimioprophylaxie (souvent mal prise) ou d'un traitement sur place[175].
Les pièges classiques retardant le diagnostic de paludisme sont la gastro-entérite fébrile, surtout chez l'enfant ; un syndrome grippal en hiver ; l'absence de fièvre (traitement symptomatique inadapté) ; un tableau d'infection urinaire ; un tableau de dengue[175].
La suspicion de paludisme implique, en urgence, un diagnostic biologique de confirmation[184].
Pays en développement

Dans de nombreux endroits, même un simple diagnostic en laboratoire n'est pas possible et l'interrogatoire d'un patient fébrile est utilisé comme indication pour poursuivre un traitement antipaludique ou non. Mais cette méthode n'est pas la plus efficace : au Malawi, l'utilisation de frottis sanguins colorés par Giemsa a montré que les traitements antipaludiques inutiles ont diminué quand les indicateurs cliniques (température rectale, pâleur du lit des ongles, splénomégalie) ont été utilisés plutôt que l'histoire rapportée d'une fièvre (la sensibilité s'est accrue de 21 à 41 %)[185].
Le paludisme concernant les enfants est trop souvent mal diagnostiqué (mauvaise anamnèse, mauvaise utilisation des tests de diagnostic rapide) par les soignants de première ligne (membres de la communauté ayant reçu une formation de base leur permettant de prodiguer les soins élémentaires en l'absence de personnel médical qualifié) ; de même il est mal évalué, ce qui se traduit par un traitement inadapté ou insuffisant, empêchant ainsi un traitement efficace[186].
Diagnostic biologique
Le diagnostic du paludisme repose sur la mise en évidence du parasite dans le sang. Il s'agit d'un diagnostic d'urgence qui doit être fait dans les deux heures qui suivent le prélèvement sanguin.
Examen sanguin au microscope (frottis-goutte épaisse)


La méthode de diagnostic la moins chère (entre 0,40 et 0,70$US par lame), la plus fiable et la plus répandue est l'examen au microscope optique d'un frottis sanguin et d'une goutte épaisse de sang.
Le frottis permet d'identifier les caractéristiques uniques de chacune des quatre espèces du parasite d'Homo sapiens car l'aspect du parasite est mieux conservé avec ce prélèvement. La goutte de sang épaisse permet de parcourir un volume sanguin plus large pour faire le diagnostic et de ne pas passer à côté de Plasmodium. Ces examens sont à réaliser par un biologiste qualifié et averti.
Les renseignements attendus sont :
- le diagnostic positif de paludisme (présence de Plasmodium) ;
- le diagnostic d'espèce (présence de P. falciparum ou d'une autre espèce), pour la gravité potentielle ;
- la parasitémie (pourcentage d'hématies parasitées, ou nombre de parasites par μL de sang), utile pour la surveillance du traitement.
La valeur prédictive négative des deux méthodes associées (frottis et goutte épaisse) n'est pas de 100 %. Un examen négatif doit être renouvelé dans les 12 à 24 heures, si la suspicion clinique persiste[165].
Tests de diagnostic rapide
Lorsqu'un microscope n'est pas disponible, il est possible d'utiliser des tests de détection rapide d'antigènes, qui n'ont besoin que d'une goutte de sang, et qui ne nécessitent pas d'expertise particulière[187].
Ces tests immunochromatographiques (également appelés tests de diagnostic rapide du paludisme ou TDR)[188] peuvent se présenter sous la forme d'une bandelette réactive ou d'un « dipstick ». Les premiers tests rapides utilisaient le glutamate déshydrogénase (GluDH) de P. falciparum comme antigène cible (pGluDH)[189] mais ils ont été remplacés par ceux utilisant le lactate déshydrogénase (LDH) de P. falciparum (pfLDH), et le HRP2 (pour Histidin Rich Protein 2)[190].
La sensibilité des tests utilisés (200 produits disponibles sur le marché[190]) est supérieure à 95 % lorsque la parasitémie est supérieure à 100 par μL de sang, et de 70 % pour les parasitémies plus faibles, et encore moins pour P. ovale. Leur spécificité est de 90 à 95 %[165].
Dans les pays développés, ces tests rapides sont associés au frottis-goutte épaisse[165].
Biologie moléculaire
Cette méthode repose sur la détection des acides nucléiques des parasites par réaction en chaîne par polymérase (PCR), une technique plus sensible et plus spécifique que la microscopie. Elle permet la détection de parasitémies très faibles, et l'identification précise des espèces de plasmodium (dont la distinction P. Knowlesi et P. malariae).
Dans les pays les plus avancés, la PCR tend à devenir la méthode de référence pour le diagnostic de recours (situation de difficultés diagnostiques). Des méthodes d'analyse plus rapides, comme la PCR en temps réel, avec obtention de résultats en moins d'une heure, sont disponibles dans des laboratoires de référence, et pourraient être compatibles avec un diagnostic d'urgence ou de routine[165],[175].
Bilan de gravité
Le bilan biologique standard permet d'évaluer un niveau de gravité, et d'aider au diagnostic différentiel : en particulier l'hémogramme, la protéine C-réactive, ionogramme, signes biologiques d'hémolyse, de souffrance hépatique ou rénale. La prise de sang peut-être utilisée pour le dépistage d'autres infections, notamment virales, selon le contexte et en fonction des recommandations.
Une co-infection avec le paludisme est toujours possible, mais la recherche du paludisme est prioritaire, étant donné sa plus grande fréquence et sa gravité immédiate potentielle[165],[175].
Formes chroniques
Les complications aiguës et graves ne concernent en général que Plasmodium falciparum, mais celui-ci n'évolue pas en formes chroniques.
Les formes subaigues et chroniques de paludisme s'observent lors d'infections à d'autres plasmodium : P. vivax, P. ovale et surtout P.malariae. La maladie peut réapparaitre plusieurs mois ou années après l'exposition, en raison de la présence latente de parasites dans le foie. Ainsi, on ne peut pas dire qu'un sujet est guéri du paludisme simplement en observant la disparition des parasites du flux sanguin. La période d'incubation la plus longue rapportée pour P. vivax est de 30 ans[182]. Environ un cas de paludisme P. vivax sur cinq dans les zones tempérées implique l'hibernation par les hypnozoites (les rechutes commencent l'année après la piqûre du moustique)[191].
Paludisme viscéral évolutif
Autrefois appelée cachexie palustre, ce paludisme s'observe chez des enfants de 2 à 5 ans en zone d'endémie, chez des sujets expatriés en zone d'endémie sous traitement insuffisant, et chez les migrants ne vivant plus en zone d'endémie.
Il associe une altération progressive de l'état général, avec une fièvre intermittente modérée (parfois absente), une anémie chronique avec cytopénie, une splénomégalie modérée (parfois importante). La parasitémie est très faible, voire indétectable[165].
Splénomégalie palustre hyper-immune
Autrefois confondue dans un ensemble dit « splénomégalies tropicales »[192], ce paludisme chronique correspond à une réponse immunologique anormale. Plutôt rare, il se rencontre chez quelques individus qui vivent dans une zone où la malaria est endémique.
Il se distingue du paludisme viscéral évolutif par une splénomégalie importante et une hépatomégalie, l'élévation d'un certain type d'immunoglobulines dans le sang (IgM, anticorps anti-palustres) et du nombre de lymphocytes à l'intérieur des sinusoïdes hépatiques. La parasitémie est le plus souvent indétectable[165].
La biopsie du foie et l'examen au microscope optique permettent de porter le diagnostic. L'évolution très lente peut être défavorable par rupture de rate, surinfection, ou apparition d'un syndrome lymphoprolifératif malin[192].
Néphrite quartane
Il s'agit d'une complication rénale grave par infection chronique à Plasmodium malariae (responsable de la fièvre quarte, d'où son nom). Elle survient le plus souvent chez l'enfant en zone endémique, après plusieurs années d'évolution.
Le tableau est celui d'un syndrome néphrotique, par dépôt de complexes immunitaires (associations anticorps-antigène) au niveau des glomérules rénaux.
La biopsie rénale permet d'identifier la lésion. Cet examen met en évidence des dépôts de complément (éléments intervenant dans le système immunitaire) et d'immunoglobulines (variété de protéines jouant le rôle d'anticorps). Le laboratoire détecte chez l'enfant des antigènes de Plasmodium malariae.
L'évolution peut se faire plus ou moins rapidement vers une insuffisance rénale chronique, malgré le traitement (antipaludéens et corticoïdes)[193].
Formes selon le terrain
Femmes enceintes
La grossesse avec infection du placenta par le Plasmodium est plus à risque de complications. En zone endémique, la grossesse entraîne une diminution de l'immunité antipalustre, tandis que les lésions placentaires provoquent une baisse de la circulation foeto-maternelle[194].
Chez la mère, les accès palustres sont plus fréquents et plus graves (risque d'avortement ou d'accouchement prématuré), et chez l'enfant : mortalité périnatale, anémie, petit poids de naissance.
En 2018, près de 11 millions de femmes enceintes ont été exposées au risque de paludisme (en zones d'endémie modérée à forte) en Afrique subsaharienne, avec 872 000 nouveau-nés de faible poids de naissance. L'Afrique de l'Ouest est la région où l'on trouve la plus forte prévalence des faibles poids de naissance, liés au paludisme durant la grossesse[195].
La fréquence et la gravité des infections en zone endémique dépendent du niveau de transmission palustre. Dans les zones de faible endémie instable comme l'Inde, ou la région Asie du Sud-Est Pacifique, le risque de formes graves chez la femme enceinte est trois fois supérieur à celui des femmes non-enceintes. Dans ces régions, plus de 23 % de la mortalité maternelle est due au paludisme[196].
Dans les régions de forte endémie stable comme l'Afrique subsaharienne, la plupart des formes sévères surviennent lors de la première grossesse ou du premier accouchement (femme primipare) alors que les femmes ayant déjà eu au moins une grossesse présentent moins de troubles, même avec une charge parasitaire élevée. Ce phénomène s'expliquerait par l'acquisition d'une immunité placentaire spécifique par accumulation sélective de P. falciparum dans le placenta[196].
Le passage transplacentaire du Plasmodium de la mère au fœtus est relativement fréquent, mais il se manifeste rarement comme une « maladie », à savoir le paludisme congénital qui survient entre les premiers jours et le premier mois après la naissance. Son incidence exacte est discutée : il serait très rare en zone d'hyperendémie (moins de 3 pour mille naissances de mères infectées) mais plus commun ailleurs[193],[197].
En zone endémique
Les enfants de moins de 5 ans représentent le groupe le plus affecté par le paludisme. En 2018, l'OMS estime à 24 millions le nombre d'enfants infectés par P. falciparum en Afrique subsaharienne, dont 1,8 million souffrant d'anémie sévère, et à 272 000 le nombre de décès, soit 67 % de la mortalité mondiale du paludisme[195].
Cliniquement, les accès simples de paludisme chez l'enfant se présentent sous la forme de troubles digestifs et respiratoires, dont la gravité dépend du type de Plasmodium et de l'état génétique, nutritionnel et immunitaire de l'enfant[198],[199].
Les formes graves, liées à P. falciparum avec parasitémie à plus de 4 %, peuvent combiner un neuropaludisme, une détresse respiratoire, une anémie sévère, une hypoglycémie, et des surinfections bactériennes ; et moins souvent une insuffisance rénale par rapport à l'adulte[198],[199].
Le neuropaludisme de l'enfant se manifeste le plus souvent par des convulsions, une posture anormale en extension (opisthotonos), pouvant se compliquer d'une hypertension intracranienne évoluant vers un coma avec rétinopathie particulière au paludisme, ce qui permet de distinguer le coma palustre des autres comas[198].
La plupart des enfants sortent du coma en 48 heures sans séquelles, mais 20 % en meurent, et 10 % gardent des séquelles neurologiques ou des retards cognitifs[198].
Pays développés
Il s'agit d'un paludisme d'importation. En France, pays européen le plus concerné, les enfants représentent 15 % du total des cas notifiés, soit près de mille enfants par an, dont 10 % sont des nourrissons. Plus de 80 % de ces cas infantiles sont dus à P. falciparum[200].
Les nourrissons atteints sont le plus souvent des migrants de deuxième génération, retournés en vacances au pays d'origine de leurs parents, essentiellement en Afrique subsaharienne. L'accès palustre chez le nourrisson est plus grave que celui de l'enfant. Dans les années 2000-2009, l'absence de mortalité chez l'enfant en France indique probablement une prise en charge adaptée dans la grande majorité des cas[200].
En 2014, les États-Unis ont eu 1513 cas notifiés de paludisme d'importation, dont 55 cas de paludisme d'importation chez les enfants de moins de 5 ans (1 cas de paludisme congénital) et 241 cas chez les moins de 18 ans. 85 % des cas infantiles revenaient d'un voyage en Afrique[201].
Paludisme transfusionnel
Les Plasmodiums, résistants à une température de 4 °C pendant plusieurs jours, sont susceptibles d'être transmis par transfusion sanguine de sang conservé et a fortiori de sang frais[202].
Cliniquement, le paludisme transfusionnel ressemble à un paludisme de primo-invasion, mais d'incubation plus longue pour toutes les espèces de Plasmodium, P. falciparum et P. malariae sont le plus souvent mis en cause (respectivement 45 et 30 % en pays non endémiques)[203].
Monde
En zone d'endémie, le paludisme transfusionnel est fréquent mais bénin en raison de la semi-immunité des receveurs à qui, en outre, il est parfois proposé un traitement antipalustre[204].
La plus forte prévalence de paludisme chez les donneurs de sang s'observe en Afrique. En utilisant les techniques moléculaires : elle serait de l'ordre de 36 % en Afrique, alors qu'elle est de 4 % en Asie, de 2 % aux Amériques, et de 1 % en Europe[205].
Les critères d'hémovigilance du paludisme sont proposés par l'OMS, et adaptés par chaque pays selon des recommandations nationales. Quelques pays, comme les États-Unis, se basent sur un questionnaire pour trier les donneurs de sang potentiellement infectés. D'autres comme la France, le Royaume-Uni ou l'Australie, utilisent en sus des tests sérologiques sur la base de ce questionnaire[205].
Dans les années 1970, en pays non endémiques, deux « épidémies transfusionnelles » notables de paludisme sont survenues dans des pays non endémiques, aux États-Unis par des donneurs vétérans du Viêt Nam, et en 1971 en Espagne : 54 cas de paludisme transfusionnel par P. vivax, liés à une seule banque du sang de Barcelone[203].
France
En France métropolitaine (centres de transfusion de Marseille et de Nice), dans les années 1960-1970, on constatait une recrudescence d'une telle transmission, liée à une insuffisance de tri de sélection des donneurs de sang[206]. Au début du XXIe siècle, ce risque est jugé faible, prévenu par l'exclusion des donneurs après un séjour récent en pays endémique (délai de moins de 6 mois, selon les critères européens[203]) et par des tests biologiques (sérologie palustre)[207].
Plus précisément en France 2019, les candidats au don considérés à risque sont : 1) les personnes présentant un antécédent de paludisme, 2) les personnes présentant une fièvre non diagnostiquée évocatrice d’un accès palustre dans les 4 mois suivant un retour de zone d’endémie, 3) les personnes ayant effectué un séjour en région à risque, et 4) les personnes natives ou ayant résidé plus de 6 mois consécutifs dans une région à risque. Les donneurs à risque sont ajournés provisoirement pour le don de sang ; la période d’éviction est de 4 mois ou de 3 ans selon les circonstances[208].
Les produits sanguins le plus à risque sont les concentrés de globules rouges, alors que le plasma, qui ne contient pas d’hématies, est considéré à risque minime. Les donneurs asymptomatiques dits immuno-silencieux (absence d’anticorps chez certains porteurs chroniques de parasites) représentent un risque résiduel. En France 2019, la probabilité d'un paludisme posttransfusionnel est de 0,2 à 0,5 cas par million de transfusions, contre 1 à la fin des années 1990. Entre 2000 et 2019, 4 cas de paludisme post-transfusionnel ont été rapportés en France, tous liés à des dons de sang issus d’une personne originaire d’une zone d’endémie. Dans trois de ces cas, l’espèce en cause a été P. falciparum et les receveurs contaminés sont décédés[208].
Paludisme d'inoculation
Il peut s'agir d'un paludisme par accident d'exposition au sang, lors de piqûre chez personnel soignant, ou d'échange de seringues souillées entre toxicomanes[209].
L'inoculation peut être volontaire ou « contrôlée ». Historiquement, l'inoculation de P. vivax ou de P. malariae a été utilisée comme moyen thérapeutique contre la neurosyphilis dans la premier tiers du XXe siècle[210].
À la fin du XXe siècle, l'inoculation de P. falciparum est utilisée aux États-Unis chez des volontaires, lors d'essais de vaccination ou d'études de souches résistantes aux antipaludéens[202].
En 2018, l'inoculation de Plasmodium dite Controlled Human Malaria Infection chez des sujets volontaires est un moyen de recherche expérimentales de nouveaux médicaments ou vaccins contre le paludisme[210].
Traitements
Dans les zones endémiques, les traitements sont souvent peu satisfaisants et le taux de mortalité global pour tous les cas de paludisme peut atteindre un sur dix[211]. L'utilisation massive de thérapies dépassées[212], de faux médicaments et la mauvaise anamnèse des symptômes sont responsables du mauvais bilan clinique.
Anciens traitements
L'endoparasite peut être combattu par différentes molécules soit en traitements curatifs soit en prophylaxie. Ces différentes thérapies sont plus ou moins efficaces suivant les régions et les taux de résistances acquis car, tout comme le DDT (insecticide le plus utilisé dans les années 1960), les médicaments efficaces il y a trente ans, comme la chloroquine, ne le sont plus aujourd'hui.
Pourtant, ces formulations obsolètes sont encore massivement utilisées dans les pays touchés[213]. Faisant partie du tiers monde, ils n'ont pas les moyens de migrer leur protocole de soins vers un outil plus onéreux comme l'utilisation des ACT (Artemisinin-based combination therapy). Pendant longtemps, les traitements ont fait appel à la chloroquine, la quinine et la SP (sulfadoxine-pyriméthamine) et dans une moindre mesure la méfloquine, l'amodiaquine et la doxycycline.
Ces molécules furent des armes très efficaces pour lutter contre les parasites du paludisme mais leur prescription sans contrôle a favorisé l'émergence de souches résistantes. Selon l'Organisation mondiale de la santé (OMS), un traitement est efficace si le taux d'échec est inférieur à 5 % ; s'il dépasse 25 %, il faut changer de protocole.
La chloroquine a longtemps été administrée en priorité. En se nourrissant de l'hémoglobine, le parasite la divise en acides aminés, ce qui libère les molécules d'hème contenues dans l'hémoglobine, toxiques pour le parasite lui-même, qu'il transforme et stocke dans sa vacuole digestive sous forme de cristaux inertes. La chloroquine pénètre dans la cellule infectée et stoppe la transformation protectrice de l'hème en cristaux inertes, faisant s'accumuler ce fer toxique. Le parasite est ainsi tué par ses propres déchets.
C'était un médicament qui présentait de nombreux avantages, notamment son faible coût et l'absence d'effets secondaires. Aujourd'hui, les soins à base de chloroquine échouent à plus de 25 % dans les pays d'Afrique subsaharienne touchés par le paludisme. Or, ils sont toujours employés.
Cette résistance est due à l'allèle mutant PfCRT (Plasmodium falciparum Chloroquine Resistance Transporter) K76T[214]. Cette mutation draine la chloroquine hors de la cellule infectée mais entraînerait toutefois une moins bonne adaptation du parasite à son milieu[215]. Le Malawi est le premier pays africain à avoir abandonné la chloroquine, et ce dès 1993, conduisant à une réapparition des souches sensibles qui redeviennent alors hautement majoritaires[216].
Là où la chloroquine n'a plus d'effet, on utilise un médicament appelé « médicament de deuxième intention » : la SP (comme le Fansidar (sulfadoxine/pyrimethamine (en)) produit par Roche). Cette molécule contourne la résistance à la chloroquine. Cinq ans seulement ont suffi pour que des souches résistantes apparaissent. On adapte alors le traitement en recourant à un « médicament de 3e intention » : la quinine, administrée per os dans les cas bénins ou par perfusion dans les cas aigus. Mais, ces traitements sont aussi confrontés à de nouvelles résistances de la part du parasite.
ACT
L’Artemisinin-based combination therapy, en français Thérapie combinée à base d'artémisinine et en sigle ACT, est une thérapie et une prévention tertiaire dans les cas de paludisme simple. Elle est composée par l'association de deux molécules : une molécule semi-synthétique dérivée de l'artémisinine et une molécule synthétique ayant pour rôle d'augmenter l'effet de la première molécule mais aussi de retarder l'apparition de résistances et, ainsi, de mieux soigner le paludisme.
Depuis la réussite, en 2001, de la phase III des essais cliniques de la première ACT jamais élaborée, elle est devenue le seul traitement médical recommandé par l'Organisation mondiale de la santé pour lutter contre cette maladie
Produit en assez faibles quantités, les médicaments ACT sont plus chers que la chloroquine. Un traitement par la chloroquine ou par la SP coûte actuellement entre 0,2 et 0,5 USD par[Quoi ?], alors qu'un traitement ACT oscille entre 1,2 et 2,4 USD/[Quoi ?], soit cinq à six fois plus. Pour de nombreux patients, cette différence est le prix de leur survie. Un prix que bien peu de personnes en Afrique peuvent payer. Seule une fabrication à plus grande échelle ou une aide financière plus importante des pays riches pourrait faire significativement baisser les coûts de production.
Voies de recherche
Des nouvelles voies sont explorées, dont :
- Une voie impliquant des peptides et des nouveaux composés chimiques[217].
Les spiroindolones forment une nouvelle classe d'antipaludéens en cours de test[218].
La cipargamine appartient à cette classe avec un effet curatif par voie orale prometteur[219]. - un traitement associant un ou plusieurs nouveaux mécanismes d'action, qui pourraient être découverts en testant une collection de composés synthétiques ayant des caractéristiques tridimensionnelles proches de celles des antipaludéens naturels et encore sous-testés.
De tels composés comprennent par exemple des azétidines bicycliques qui semblent (par voie orale) actives à faible dose contre tous les stades de la vie du parasite, dans plusieurs modèles testés in vivo, et qui présentent un potentiel de guérison et/ou prévention de la maladie, et de populations protègent à risque[220].
Faux médicaments
De faux médicaments supposément anti-paludiques circulent en Thaïlande, au Viêt Nam, au Cambodge[221] et en Chine[222] ; ils forment une cause importante de la mortalité, qui serait pourtant évitable[223]. En août 2007, la société pharmaceutique chinoise Holley-Cotec a été obligée de retirer vingt mille doses de son médicament à base d'artémisinine Duo-Cotecxin[224] au Kenya parce que des contrefaçons, en provenance d'Asie, contenant très peu d'ingrédients actifs et incapables d'une quelconque thérapie, circulaient sur le marché à un prix cinq fois moindre. Il n'existe pas de moyen simple pour les médecins comme pour les patients de distinguer un vrai médicament d'un faux, sans l'aide d'un laboratoire. Les compagnies pharmaceutiques tentent de combattre les faux médicaments en utilisant de nouvelles technologies sécurisant le produit de la source à sa distribution.
Prévention
Les méthodes utilisées pour empêcher la maladie de se répandre, ou pour protéger les habitants des zones endémiques, incluent la prophylaxie par la prise de médicaments, l'éradication des moustiques et la prévention des piqûres de moustiques. Pour que le paludisme puisse exister de façon continue à un endroit, il faut une combinaison de facteurs : forte densité de population, fort taux de transmission des humains aux moustiques et réciproquement. Si un de ces facteurs diminue, le parasite finit par disparaître, comme en Amérique du Nord et en Europe. Inversement, le parasite peut être réintroduit dans une région et y survivre si ces facteurs y sont réunis.
Il n'existe pas encore de vaccin très efficace contre le paludisme mais la recherche progresse[225]. La technologie à ARN messager utilisée contre le SARS-CoV-2 ouvrant notamment de nouvelles perspectives[226],[227],[228],[229],[230],[231],[232].
Des chercheurs affirment que la prévention du paludisme serait financièrement plus efficace que son traitement à long terme ; mais son coût reste trop important pour les plus pauvres (selon l'économiste Jeffrey Sachs, trois milliards de dollars américains par an seraient nécessaires). Pour atteindre les objectifs du millénaire pour le développement, l'argent actuellement alloué à la lutte contre le Sida devrait être réaffecté à la prévention du paludisme, ce qui bénéficierait davantage à l'économie africaine[233].
Certains pays (Brésil, Érythrée, Inde ou Viêt Nam) ont réduit leur taux de cas de paludisme. L'analyse de ces cas montre que de nombreux facteurs ont dû pour cela être réunis : financements, action coordonnée de l'État et des ONG et action concrète des travailleurs sociaux[234].
Moyens de combattre le moustique ou de s'en protéger
On peut combattre le vecteur du paludisme (l'anophèle femelle) par plusieurs moyens de prévention, qui peuvent s'avérer efficaces s'ils sont bien mis en œuvre.
Le véritable problème de cette prévention est le coût très élevé des traitements pour les populations touchées. En effet, elle peut être efficace chez les voyageurs, mais les pays en voie de développement, qui sont les principales victimes de cette maladie, peinent à organiser des actions très efficaces. On peut donner pour preuve l'exemple de l'île de La Réunion où le paludisme sévissait comme dans les autres îles de la région (Madagascar et île Maurice) notamment. La Réunion étant un territoire français d'outre-mer, le problème du coût trop élevé n'existait pas et la malaria a pu être éradiquée de cette île sans difficulté.
Deux modes de prévention sont appliqués dans les pays concernés. Ils visent d'une part à protéger les populations contre les piqûres de moustiques et, d'autre part, à éliminer ces derniers par la mise en place de moyens divers. Le but principal de cette prophylaxie est de limiter la population de moustiques vecteurs de la maladie et ainsi de tenter d'éradiquer ce fléau.
Dans les années 1960, la principale méthode utilisée pour éradiquer les anophèles femelles était l'utilisation massive d'insecticides. Le plus utilisé était le DDT (Dichloro-Diphényl-Trichloréthane). Cette méthode porta ses fruits dans de nombreuses régions où le paludisme fut totalement éradiqué. L'utilisation intensive du DDT a cependant favorisé la sélection de moustiques résistants. Cette résistance a été nommée KDR (Knock Down Resistance : « résistance à l'effet de choc »). En outre, il peut engendrer intoxications et maladies dans la population comme ce fut le cas en Inde où il fut utilisé de manière abusive en agriculture. Le DDT a été interdit aux États-Unis en 1972, puis dans d'autres pays. Il est classé comme polluant organique persistant depuis 2001, suite à la convention de Stockholm. Néanmoins il a toujours été autorisé pour des raisons sanitaires et cela a été rappelé par l'OMS en 2005 [235]. Les quatre critères d'un polluant organique persistant sont :
- toxicité : on reproche au DDT d'être potentiellement cancérigène et d'être susceptible de modifier le fonctionnement nerveux et hormonal humain (effets sur le métabolisme d’œstrogène chez les femmes, effets anti-androgènes) ;
- persistant : sa demi-vie est de quinze ans, c'est-à-dire que si l'on pulvérise 10 kg dans un champ, quinze ans après, il en restera 5 kg, après trente ans 2,5 kg et ainsi de suite ;
- dispersif : on en a retrouvé dans les neiges de l'Arctique ;
- bio cumulatif : les animaux qui en absorbent n'en meurent pas, mais ne parviennent pas à l'éliminer. Ils le stockent dans leurs graisses et on en retrouve de grandes concentrations chez les animaux du sommet de la chaîne alimentaire. Par contre, sa toxicité est sujette à débat bien qu'une ingestion de 35 g puisse être létale pour une personne de 70 kg (comme pour l'ibuprofène par exemple et comparé à 225 g pour le sel ou 120 g pour le café).
Pour remplacer le DDT, des moyens alternatifs sont possibles afin de combattre le vecteur du paludisme[236] :
- assèchement des marais (sans bouleverser le système écologique), drainage des eaux stagnantes où se développent les larves des anophèles (un vieux pneu abandonné et rempli d'eau par les pluies est suffisant au moustique pour y pondre ses œufs) ;
- lutte anti-larvaire par épandage de pétrole ou d'huile végétale et utilisation d'insecticides solubles répandus à la surface des eaux stagnantes, pour tenter de limiter les naissances d'anophèles ou empêcher les larves de venir respirer à la surface. Mesures fort peu recommandables car totalement anti-écologiques ;
- ensemencement des eaux avec des prédateurs des anophèles ou de leurs larves comme certains mollusques ou poissons (tilapias, guppys, gambusies, aphanius)[237] ;
- réintroduction, et protection, des variétés de chiroptères insectivores là où elles ont disparu (une chauve-souris peut avaler près de la moitié de son poids en insectes en une nuit)[238] ;
- ciblés à partir du séquençage du génome du moustique[239]. Ce génome offre, entre autres, un catalogue de l'accroissement des gènes de détoxification et des gènes mutants qui codent les protéines visées par les insecticides ainsi que les variations des nucléotides individuels, appelés polymorphismes nucléotidiques qui se trouvent dans le génome :
- emploi d'insectifuges et d'insecticides ciblés uniquement contre l'anophèle,
- dispersion de mâles anophèles stériles dans la nature,
- interventions génétiques sur les espèces vectrices ou, dans un avenir indéterminé, avec des vaccins bloquant la transmission en induisant des anticorps empêchant la maturation des stades sexués du parasite chez l'anophèle.
- Antiparasitaire oral. L'ivermectine augmente la mortalité des moustiques lorsqu'ils piquent, pendant au moins 28 jours[240].
Ces mesures ne sont efficaces que sur un territoire limité. Il est très difficile de les appliquer à l'échelle d'un continent tel que l'Afrique.
Chacun, à titre individuel, peut éviter les piqûres d'anophèles par des mesures mécaniques, physiques et chimiques ; rappelons avant tout que l'anophèle a une activité nocturne, commençant à piquer à la tombée de la nuit, et se reposant la journée dans les habitations :
- installation de moustiquaires (mailles inférieures à 1,5 mm) imprégnés de perméthrine ou de dérivés de pyréthrinoïde. De plus en plus ces moustiquaires sont fournis à prix très démocratiques (maximum 1,70 USD) voire gratuitement aux populations des zones d'endémie. Ces moustiquaires sont efficaces pendant 3 à 5 ans selon le modèle et les conditions d'utilisation ;
- installation de grillage moustiquaire aux fenêtres ;
- utilisation d'insecticides à petite échelle : pulvérisation d'insecticides intradomiciliaires (pyréthrinoïdes, DDT, etc.) dans les habitations (chambres à coucher) ;
- installation d'air conditionné dans les habitations pour faire baisser la température et brasser l'air (le moustique a horreur des déplacements d'air qui le perturbent dans ses déplacements et dans sa faculté sensorielle à trouver sa cible) ;
- après le coucher du soleil : port de vêtements amples, longs et de couleur claire et abstinence d'alcool (les anophèles sont aussi bien attirés par les couleurs foncées, plus spécialement le noir, que par les vapeurs d'alcool) ;
- application de crème répulsive sur la peau ou les vêtements dès le coucher du soleil. De tous les répulsifs de synthèse, ceux qui contiennent du DEET (N, N-diethyl-m-toluamide) sont les plus efficients. Le DEET ne tue pas les insectes mais ses vapeurs les découragent de se poser ou de grimper sur la personne.
Généralement, les produits concentrés entre 25 et 30 % de DEET sont les plus efficaces sur la plus longue période (± 8 h contre les insectes rampants et de 3 à 5 h contre les anophèles). Ils sont également considérés comme inoffensifs pour des personnes adultes ou des enfants de plus de deux ans si la concentration ne dépasse pas 10 % pour ces derniers. À proscrire chez la femme enceinte et le nourrisson de moins de trois mois. Les produits concentrés à plus de 30 % ne sont plus homologués.
Les produits commercialisés sont à appliquer à même la peau ou sur les vêtements ou les moustiquaires. Attention cependant à ce qu'ils altèrent les matières plastiques, certains tissus synthétiques comme le nylon, le caoutchouc, le cuir et les surfaces peintes ou vernies. Prendre également attention aux yeux et à l'inhalation directe avec les produits en atomiseur ainsi qu'à l'ingestion. Les applicateurs munis d'une bille seront donc préférés.
La résorption transcutanée est de 50 % en six heures et l'élimination sera urinaire. La partie non éliminée (30 %) sera stockée dans la peau et les graisses.
En 2022, des chercheurs de l'Université de Stockholm imaginent un "faux sang" à base de jus de betterave, qui pourrait détourner les moustiques et aider à la prévention du paludisme[4].
Répulsifs
Les études[réf. nécessaire] ont montré que les produits répulsifs à base d'eucalyptus qui contiennent de l'huile naturelle d'eucalyptol sont une alternative efficace et non toxique au DEET. En outre, les plantes telles que la citronnelle ont prouvé[réf. nécessaire] leur efficacité contre les moustiques. Une étude ethnobotanique[241] conduite dans la région du Kilimandjaro (Tanzanie) montre que les répulsifs les plus largement utilisés, par les populations locales, sont des lamiacées du genre ocimée l' Ocimum kilimandscharicum et lOcimum suave. L'étude portant sur l'utilisation d'huiles essentielles extraites de ces ocimées montre que la protection vis-à-vis des piqûres de certains anophèles vecteurs du paludisme augmente dans 83 à 91 % des cas et inhibe, chez l'insecte, son envie de succion dans 71,2 à 92,5 % des cas.
D’autres solutions naturelles sont également recommandées. Ainsi selon une étude conduite par le Ministère santé publique Cameroun, le fait de se frictionner la peau avec des espèces de plantes herbacées bisannuelles de la famille des Amaryllidaceae, telles que les oignons et l’ail permettrait de faire diminuer le taux de piqûres de 71 à 79 %. Ce type de traitement préventif est fortement recommandé pour les personnes suivant un régime végétarien qui pourraient présenter des carences en fer et en protéines, source de succion chez l’insecte.[réf. nécessaire]
L'icaridin aussi connu sous le nom de KBR 3023 est un nouveau répulsif de la famille chimique des pipéridines et de force comparable au DEET, mais il est moins irritant et ne dissout pas les plastiques. Il a été développé par la société chimique allemande Bayer AG et commercialisé sous le nom de SALTIDIN[242]. La forme en gel avec 20 % de produit actif est actuellement la meilleure. Attention, malgré tout, tous les effets secondaires possibles vis-à-vis des enfants ne sont pas encore tous connus.
Un essai de divers répulsifs, lancés sur le marché, par une organisation indépendante du consommateur a constaté que les produits répulsifs synthétiques, y compris DEET, étaient plus efficaces que des produits répulsifs avec les substances actives naturelles.
- utilisation de perméthrine ((3-phenoxyphenyl)methyl) ou de dérivés de pyréthrinoïde. Ce sont des révulsifs mais peuvent aussi être classés parmi les insecticides. S'ils repoussent et irritent le moustique, ils créent, sur celui-ci, une action de choc (Knock Down) qui le tue ou le neutralise directement.
Ne pas utiliser directement sur la peau mais imprégner les vêtements ou les moustiquaires en prenant garde de ne pas irriter les muqueuses nasales ni d'en ingérer lors de la manipulation. La durée d'efficacité est d'environ 6 mois (moins sur les vêtements qui subissent frottements, pluie, etc.). La réimprégnation se fait après lavage au savon.
Précaution : Ne pas porter des vêtements imprégnés de perméthrine sur la peau déjà traitée au DEET.
Femmes enceintes
Prophylaxie
Afin de prévenir toute contamination chez les touristes se rendant dans des pays où sévit le paludisme, les chercheurs ont mis en place une technique prophylactique. Cette technique consiste à utiliser un arsenal thérapeutique de médicaments préventifs (se limitant à la chloroquine, au proguanil, à l'association pyriméthamine-dapsone, à l'association proguanil-atovaquone, à l'association chloroquine-proguanil chlorhydrate, à la méfloquine et la doxycycline) afin d'éviter l'infection en cas de pénétration du parasite dans l'organisme.
La prise régulière d'un traitement préventif, en particulier pour les enfants et les femmes enceintes, qui ont un risque accru d'accès de paludisme grave est conseillée pour les courts séjours en zone de transmission intense de paludisme. Mais en raison de l'accroissement de la pharmacorésistance parasitaire (résistance des parasites aux produits constituant l'arsenal thérapeutique) et des effets secondaires propres aux différents produits, il est de plus en plus difficile d'établir des directives chimioprophylactiques.
Les médicaments antipaludéens ne garantissent pas une protection absolue contre l'infection et il est aussi important de se protéger des piqûres de moustiques (moustiquaires, produits antimoustiques) car même si un traitement adapté a été correctement suivi, il est possible de faire une crise de paludisme, parfois d'apparition tardive à cause de la forme hypnozoïte que peut prendre le Plasmodium.
En Belgique, des cas de décès dus à la malaria surviennent, chaque année, chez les voyageurs de retour au pays[243].
Schémas prophylactiques antipaludiques
Au 9 mars 2006, la prévention du paludisme s'organise en trois niveaux, classés selon le niveau de chimio-résistance. Chaque pays à risque se trouvant ainsi classé dans un groupe. Bien avant de partir en voyage, il convient de demander l'avis de son médecin car ces traitements sont généralement à commencer à l'avance.
- Pays du groupe 0
- Zones sans paludisme : Pas de chimioprophylaxie.
- Afrique : le Lesotho, la Libye, le Maroc, La Réunion, l'île Sainte-Hélène, les Seychelles et la Tunisie ;
- Amérique : toutes les villes, Antigua-et-Barbuda, les Antilles néerlandaises, les Bahamas, la Barbade, les Bermudes, le Canada, le Chili, Cuba, la Dominique, les États-Unis, la Grenade, les îles Caïmans, les îles Malouines, les îles Vierges, la Jamaïque, la Martinique, Porto Rico, Sainte-Lucie, la Trinité-et-Tobago et l'Uruguay ;
- Asie : toutes les villes, Brunei, la Géorgie, Guam, Hong Kong, l'île Christmas, les îles Cook, le Japon, le Kazakhstan, le Kirghizistan, Macao, les Maldives, la Mongolie, le Turkménistan, Singapour et Taïwan ;
- Europe : tous les pays y compris l'Arménie, les Açores, les îles Canaries, Chypre, la Russie, les pays baltes, l'Ukraine, la Biélorussie et la Turquie d'Europe ;
- Proche et Moyen-Orient : toutes les villes, Bahreïn, Israël, la Jordanie, Koweït, le Liban et le Qatar ;
- Océanie : toutes les villes, l'Australie, les Fidji, Hawaii, les îles Mariannes, les îles Marshall, les États fédérés de Micronésie, la Nouvelle-Calédonie, la Nouvelle-Zélande, l'île de Pâques, la Polynésie française, les Samoa, les Tonga et les Tuvalu.
- Cas particulier des zones de transmission faible
- Compte tenu de la faiblesse de la transmission dans ces pays, il est admissible de ne pas prendre de chimioprophylaxie quelle que soit la durée du séjour. Il est cependant indispensable d'être en mesure, dans les mois qui suivent le retour, de consulter en urgence en cas de fièvre.
- Afrique : l'Algérie, le Cap-Vert, l'Égypte, l'Érythrée et Maurice ;
- Asie : l'Azerbaïdjan, la Corée du Nord, la Corée du Sud, et l'Ouzbékistan ;
- Proche et Moyen-Orient : les Émirats arabes unis, Oman, la Syrie et la Turquie.
- Pour tous les autres pays, il est nécessaire de prendre une chimioprophylaxie adaptée à la zone visitée.
- Pays du groupe 1
- Zones sans chloroquinorésistance : chloroquine 100 mg : un comprimé chaque jour (il est possible aussi de prendre 300 mg deux fois par semaine) pour une personne pesant au moins 50 kg (à utiliser avec prudence chez les épileptiques et, chez tout un chacun, car pouvant provoquer des troubles de la vue voire la cécité avec des prises de trop longue durée).
- Pays du groupe 2
- Zones de chloroquinorésistance : chloroquine 100 mg, (un comprimé chaque jour) et proguanil 100 mg, (deux comprimés chaque jour).
- L'association chloroquine-proguanil sera ingérée, au cours d'un repas, en une prise ou par demi doses matin et soir en débutant une semaine avant le départ et jusqu'à un mois après le retour pour une personne pesant au moins 50 kg (pour une personne de moins de 50 kg, se référer au chapitre sur l'enfant voyageur).
- L'association atovaquone-proguanil peut être conseillée en alternative à l'association chloroquine-proguanil (voir le paragraphe « Pays du groupe 3 » pour plus de détails sur l'association atovaquone-proguanil).
- Pays du groupe 3
- Zones de prévalence élevée de chloroquinorésistance ou multirésistance[244]
La doxycycline[245] (principe actif)
- un comprimé de 100 mg par jour, un jour avant le départ (prise doublée le premier jour) et jusqu'à 28 jours après le retour ou après avoir quitté la zone d'endémie de malaria (à prendre en position assise avec une grande quantité de liquide ou pendant le repas). Les doses sont à diviser par deux pour les enfants de plus de huit ans.
- La doxycycline peut être prise pendant plusieurs mois mais peut provoquer une phototoxicité (réaction chimique provoquée par la présence trop grande de substance photoréactive dans la peau et réagissant sous l'action des rayons UV ou visibles) et des mycoses buccales et génitales ; elle est à proscrire aux femmes enceintes (troubles hépatiques) ou allaitantes ainsi que chez les enfants de moins de 8 ans (ralentissement réversible de la croissance osseuse et coloration jaune irréversible des dents avec un risque accru de caries)
- Il s'agit d'un dérivé de la tétracycline (antibiotique à quatre cycles accolés capable de pénétrer les cellules eucaryotes dont font partie le Plasmodium) parfois utilisé contre le paludisme en association avec la quinine pour des traitements d'urgence par voie intraveineuse.
La méfloquine ou Lariam[246] (Roche)
- Composition : 250 mg méfloquine
- Boîte de huit comprimés - 34,26 € (Prix en Belgique en 2012)
- Un comprimé par semaine, quelques semaines avant le départ et jusqu'à quatre semaines après le retour
- Pour obtenir une concentration dans le sang efficace de Lariam dès l'arrivée, il est nécessaire d'initier le traitement deux à trois semaines avant le départ. Les personnes qui n'ont jamais pris ce produit auparavant doivent commencer le traitement deux à trois semaines avant le départ, pour déceler d'éventuels effets secondaires (vertige, insomnie, cauchemar, excitation, angoisse inexplicable, palpitations). Il ne sera pas prescrit si le médecin juge qu'il existe une contre-indication (souhait de grossesse, premier trimestre de grossesse, épilepsie, dépression, ou troubles du rythme pour lesquels un traitement est en cours avec des médicaments tels que des bêta-bloquants, des antagonistes calciques, ou de la digitaline), ou s'il n'a pas été supporté dans le passé. Il faut poursuivre le traitement jusqu'à quatre semaines après le retour. Si le Lariam est bien supporté, il peut être pris pendant des mois voire des années si nécessaire.
- Pour les séjours prolongés (durée supérieure à trois mois), la chimioprophylaxie doit être maintenue aussi longtemps que possible et il est recommandé aux voyageurs de prendre rapidement contact avec un médecin sur place pour évaluer la pertinence et le rapport bénéfice/risque de la chimioprophylaxie.
L'association atovaquone-proguanil comme le Malarone[247] (GlaxoSmithKline) peut être conseillée en alternative à la méfloquine.
- Composition pour adulte : 250 mg atovaquone + 100 mg proguanil chlorhydrate
- Boîte de douze comprimés - 44,14 € (prix en Belgique en 2012)
- Composition pour junior : 62,5 mg atovaquone + 25 mg proguanil chlorhydrate
- Boîte de douze comprimés - 18,48 € (prix en Belgique en 2012)
- Un comprimé par jour, un jour avant le départ et jusqu'à sept jours après le retour.
- Si la première prise ne débute que durant le séjour, il convient de le prendre jusqu'à quatre semaines après le retour.
- Pour un voyage de courte durée, la prise de Malarone, habituellement très bien toléré, est un excellent choix. Elle peut être utilisée pendant plusieurs mois (mais il faudra alors prendre en compte son coût élevé). La durée d'administration continue de l'atovaquone-proguanil dans cette indication devra, cependant, être limitée à trois mois, faute de disposer à ce jour d'un recul suffisant en traitement prolongé.
En tout état de cause, l'avis d'un médecin est plus que souhaitable avant toute médication.
Gestion des stocks de médicaments
Une technologie utilisant le SMS vient d'être testée avec succès en Tanzanie.
Cette opération appelée SMS for Life consiste à éviter les ruptures de stocks en médicaments contre le paludisme, le Sida et la tuberculose dans un endroit donné, même le plus reculé, par l'interaction entre un serveur informatique et des téléphones mobiles[248].
Avenir
Les recherches tant en pharmacologie pour les traitements (cf. section détaillée « Le futur - La pharmacologie ») qu'en vaccination pour la prophylaxie (cf. section détaillée « Vaccins ») vont à un rythme de plus en plus accéléré grâce à des sponsors comme le Malaria Vaccine Initiative ou des ONG comme MSF.
Précautions à prendre
La prise de médicaments antipaludiques, même en respectant un schéma thérapeutique correct, ne suffit pas à protéger à cent pour cent contre le risque de paludisme. Il faut aussi se protéger des moustiques, les empêcher d'entrer en contact avec leurs victimes, afin d'éviter la piqûre de l'insecte :
- éviter les déplacements en zone à risque sans protection, toujours dormir avec une moustiquaire dont les mailles sont inférieures à 1,5 mm, même à la belle étoile ;
- porter des vêtements longs, amples et de couleur blanche, serrés aux poignets et aux chevilles, avec des chaussures fermées, imprégnées de répulsif (attention, le moustique anophèle vole souvent au ras du sol et peut piquer à travers les chaussettes) ;
- appliquer des répulsifs cutanés sur toutes les parties non couvertes du corps (à base de DEET mais à éviter pour les nourrissons de moins de 3 mois et les femmes enceintes ou allaitantes) ;
- utiliser des insecticides, à l'intérieur, mais aussi à l'extérieur ;
- dormir avec l'air climatisé ou sous une moustiquaire (de préférence imprégnée d'insecticide lorsque le corps, la nuit, peut être en contact avec cette moustiquaire) : l'humain agit ainsi comme un appât et outre la barrière mécanique de la moustiquaire empêchant la piqûre, elle provoque la mort du moustique qui est entré au contact de l'insecticide ;
- protéger toutes les ouvertures par des moustiquaires appropriées.
L'utilisation de produits répulsifs ou anti-insectes (tels le DEET ou le DDT) et de moustiquaires réduit les risques d'infection, mais une chimioprophylaxie reste indispensable (Nivaquine, Savarine, Lariam, Malarone). Il est déconseillé de boire de l'alcool en ayant pris ces médicaments.
Conséquences économiques
Selon la Ligue contre le paludisme, une famille touchée ne récolterait que 40 % de sa production agricole, du fait des journées de travail perdues. L'OMS a même calculé que le PIB africain dépasserait de 115 milliards d'euros son niveau actuel, soit 32 % supplémentaires, si l'on avait éliminé le paludisme il y a trente-cinq ans.
Sur le plan de la lutte, l'UNICEF estime que le coût moyen annuel des programmes antipaludiques dans chaque pays d'Afrique se monterait à environ 345 000 euros, soit, pour un pays de cinq millions d'habitants, moins de sept centimes d'euros par habitant.
Les populations localisées dans des zones impaludées vivant dans leur immense majorité dans la pauvreté, les nouveaux médicaments, nettement plus efficaces mais plus coûteux que les anciens, sont bien souvent au-delà de leurs moyens.
Il arrive même parfois qu'un patient ne suive pas entièrement son traitement et, se sentant guéri, qu'il aille vendre ce qui lui reste au marché noir, accélérant ainsi l'apparition de résistances aux traitements (voir chapitre sur la résistance du parasite).
D'après les chiffres, le secteur privé consacrait, en 1990 et par victime, 789 dollars pour combattre l'asthme, 3 274 pour le sida (dont le virus concerne autant les pays en voie de développement que les pays développés) et seulement 65 dollars en ce qui concerne le paludisme. Autrement dit, la somme consacrée à la recherche de vaccins et au développement de médicaments antipaludiques est minime lorsque l'on sait que près de cinquante pour cent de la population mondiale est menacée.
De plus, la grande majorité des pays touchés par la malaria n'ont ni les moyens économiques ni les moyens technologiques de développer dans leur pays une réelle recherche dans le domaine médical. Des pays aux moyens financiers très limités (le plus souvent croulant sous le poids de la dette extérieure), un manque de solide volonté politique, un budget recherche bien inférieur aux attentes et une aide internationale dérisoire comparée aux besoins des populations et au nombre de personnes touchées, rappellent que les conséquences aussi désastreuses de cette maladie du sous-développement ne sont pas entièrement dues à la nature, que l'être humain y est pour beaucoup.
Cependant l'OMS a fondé en 2001 un Fonds mondial pour lutter contre la malaria mais aussi contre le SIDA et la tuberculose.
Depuis 2003, la fondation Bill-et-Melinda-Gates a également versé plusieurs centaines de millions de dollars, entre autres, à la Malaria Vaccine Initiative, pour lutter contre la maladie.
Créé en 2002, le Fonds mondial de lutte contre le SIDA, la tuberculose et le paludisme, ou Fonds mondial, regroupe des financements internationaux en faveur du traitement du paludisme.
Divers

- En France, cette maladie est sur la liste des Maladies infectieuses à déclaration obligatoire.
- Le paludisme a été souvent illustré sur des timbres. Le premier exemple est un timbre de bienfaisance du Mexique émis en 1939 qui montre un être humain victime d'un moustique géant. Mais le plus spectaculaire fut l'émission faite en 1962, simultanément dans une centaine de pays célébrant la campagne de l'OMS intitulée éradication du paludisme. L'OMS a fait de l'éradication du paludisme l'une de ses principales priorités.
- Le roman Le Chromosome de Calcutta d'Amitav Ghosh (éd. Seuil 1998, coll. Cadre vert) fait une large place au récit, dans une atmosphère fantastique, de la découverte de Ronald Ross sur le paludisme.
- Un téléfilm anglo-saxon sorti en 2013 Mary et Martha : Deux mères courage parle de la lutte de deux mères contre le paludisme (ou malaria).
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Malaria » (voir la liste des auteurs).
- (en) Organisation mondiale de la santé, World malaria report 2020, Genève, World Health Organization, , 300 p. (ISBN 978-92-4-001580-7, lire en ligne)
- « L’OMS recommande l'utilisation d'un vaccin antipaludique novateur destiné aux enfants exposés au risque de contracter la maladie », sur OMS, (consulté le ).
- Définitions lexicographiques et étymologiques de « paludisme » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- Définitions lexicographiques et étymologiques de « malaria » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- Gérard Duvallet (dir.), Entomologie médicale et vétérinaire, IRD - Quae, (ISBN 978-2-7099-2376-7), p. 210
- (en) A.A. Escalante, D.E. Freeland, W.E. Collins et A.A. Lal, « The evolution of primate malaria parasites based on the gene encoding cytochrome b from the linear mitochondrial genome », PNAS, vol. 95, no 14, , p. 8124-8129 (lire en ligne)
- (en) Weimin Liu, Yingying Li, Learn GH et al., « Origin of the human malaria parasite Plasmodium falciparum in gorillas », Nature, vol. 467, , p. 420–425 (lire en ligne)
- (en) Frederick L. Dunn, Malaria, Cambridge, Cambridge University Press, , 1176 p. (ISBN 0-521-33286-9), p. 860-862.dans The Cambridge Word History of Human Disease, K.F. Kiple (dir.).
- (en) Joy D, Feng X, Mu J. et al. « Early origin and recent expansion of Plasmodium falciparum » Science, vol. 300, issue 5617, p. 318-21, 2003.
- (en) Andreas Nerlich, Paleopathology and Paleomicrobiology of Malaria, ASM Press, , 212 p. (ISBN 978-1-55581-916-3), p. 155-159dans Paleomicrobiology of Humans, M. Drancourt et D. Raoult (dir.).
- (en)Malaria Killed Half the People Who Have Ever Lived
- (en)Did Malaria Really Kill Half of Everyone Who Ever Lived?
- (en) F. Cox « History of human parasitology » Clin Microbiol Rev. 2001, vol. 15, no 4, p. 595-612.
- « Toutankhamon aurait succombé au paludisme et à une maladie des os », Le Monde.fr, (lire en ligne)
- (en) Z. Hawass, Y.Z. Gad, S. Ismail et al., « Ancestry and pathology in King Tutankhamun's family », JAMA, vol. 303, no 7, , p. 638-647 (DOI 10.1001/jama.2010.121)
- (en) Paul U. Unschuld, Medicine in China : A History of Ideas (Comparative Studies of Health Systems and Medical Care), University of California Press, , 2e éd., 464 p., Revised edition (ISBN 978-0-520-26613-1 et 0-520-26613-7, lire en ligne)
- The History of Malaria, an Ancient Disease. Dans le site de Center for Disease Control and Prevention.
- (en) R. Sallares, A. Bouwman, C. Anderung, « The Spread of Malaria to Southern Europe in Antiquity : New Approaches to Old Problems », Medical History, vol. 48, no 3, , p. 311–28 (lire en ligne)
- (en) « The quest for quinine : those who won the battles and those who won the war ». Par T. Kaufman et E. Rúveda, dans Angew Chem Int Ed Engl, vol. 44, no 6, p. 854-885, 2005.
- (en) E. Yalcindag et al, « Multiple independent introductions of Plasmodium falciparum in South America », PNAS, vol. 109, no 2, , p. 511-516 (DOI 10.1073/pnas.1119058109)
- (en) R. Kyle et M. Shampe « Discoverers of quinine » JAMA 1974, vol. 229, no 4, p. 462.
- Jean-Paul Bado, Médecine coloniale et grandes endémies en Afrique 1900-1960, Karthala Editions,
- (en) « History of U.S. Military Contributions to the Study of Malaria ». Par Christian F. Ockenhouse (dir.).
- (en) Biography of Alphonse Laveran. Dans The Nobel Foundation.
- Page sur Ettore Marchiafava.
- Lénaick Ollivier de l'Institut de médecine tropicale du service de santé des armées (IMTSSA Marseille), cité par Le Figaro du 10 juin 2008, page 16.
- (en) Biography of Ronald Ross, dans The Nobel Foundation.
- (en) Ross and the Discovery that Mosquitoes Transmit Malaria Parasites. Dans le site de Center for Disease Control and Prevention.
- « Fièvres d'hier, paludisme d'aujourd'hui. Vie et mort d'une maladie ». Par Chantal Beauchamp, dans Annales. Économies, Sociétés, Civilisations. 43e année, no 1, 1988, p. 252-253.
- (en) « Plasmodium vivax (Grassi and Feletti, 1890) ».
- (en) L. Pauling, H. Itano, S.J. Singer et I. Wells, « Sickle Cell Anemia, a Molecular Disease », Science, vol. 110, (lire en ligne [PDF])
- Chimiothérapie du paludisme, sous la direction de R. H. Black, Craig J. Canfield, D. F. Clyde, W. Peters et W. H. Wernsdorfer, 2e éd., Organisation mondiale de la santé, Genève, 1984, p. 13
- Ernest Fourneau, Jacques et Thérèse Tréfouël et Germaine Benoit, « Préparations en vue d’essais thérapeutiques. IV. Dérivés quinoléiques et quinoléine arsinique », Ann. Inst. Pasteur, no 44, , p. 719.
- Ernest Fourneau, Jacques et Thérèse Tréfouël, Georges Stefanopoulo, Yvonne de Lestrange et Germaine Benoit, « Contribution à la chimiothérapie du paludisme : Essais sur la malaria des canaris », Ann. Inst. Pasteur, vol. 44, , p. 503-533 (résumé).
- Ernest Fourneau, Jacques et Thérèse Tréfouël, Daniel Bovet et Germaine Benoit, « Contribution à la chimiothérapie du paludisme : Essais sur les calfats (deuxième mémoire) », Ann. Inst. Pasteur, vol. 50, , p. 731-744.
- Marcel Delépine, Notice sur la vie et les travaux de Ernest Fourneau (1872-1949) (extrait du Bull. Soc. chim. Fr.), Paris, Masson et Cie, s.d. (1950 ?), 90 p., p. 61-63.
- (en) « Chemotherapy of avian malaria ». ParE. K. Marshall.
- Choloroquine diphosphate.
- (en) Wall Street and the Rise of Hitler. Par Anthony Sutton, dans The Modern History Project, chap. 2 « The Empire of I.G. Farben ». 1976.
- (en) « Hemozoin Biocrystallization in Plasmodium falciparum and the antimalarial activity of crystallization inhibitors ». Par E. Hempelmann, dans Parasitol Research, vol. 100, no 4, p. 671-676, 2007.
- « Histoire de la quinine dans la lutte contre le paludisme », dans le site du CNRS.
- (en) « Human malaria parasites in continuous culture ». Par Trager et Jensen, dans Science, vol. 193, no 4254, p. 673-675, août 1976.
- Daniel Vangroenweghe, « Sida et sexualité en Afrique », EPO, 2000, no 479, p. 124-125.
- X. Pourrut & V. Robert : « Absence d’infection plasmodiale chez les singes sauvages du Nord-Sénégal ? » in Bull. Soc. Pathol. Exot. 2009, no 102, 1, p. 17-18.
- « Un foyer enzootique de paludisme simien ». Par S. P. Ramakrishnan et B. N. Mohan, Institut du Paludisme de l'Inde.
- (en) G. Robert Coatney « Simian Malaria - Its Importance to World-Wide Eradication of Malaria » JAMA 1963;184(11):876-7.
- (en) Ward RA, Rutledge LC, Hickman RL. (1969) « Cyclical transmission of Chesson vivax malaria to subhuman primates » Nature no 224, p. 1126–1127, cité par The American Journal of Tropical Medicine and Hygiene.
- (en) « Demonstration of hypnozoites in sporozoite-transmitted Plasmodium vivax infection ». Par Krotoski W, Collins W, Bray R, et al., dans Am J Trop Med Hyg, vol. 31, no 6, p. 1291-1293, 1982. Voir aussi « Malaria parasites - discovery of the early liver form », dans Nature. Par Meis J, Verhave J, Jap P, Sinden R, Meuwissen J, vol. 302, no 5907, p. 424-6, 1983.
- Centre d'études et de recherche des médecins d'Afrique associé avec le centre hospitalier universitaire et le Laboratoire de Chimie de la Coordination (CNRS) de Toulouse
- (en) Held J, Supan C, Salazar CL, et al., « Ferroquine and artesunate in African adults and children with Plasmodium falciparum malaria: a phase 2, multicentre, randomised, double-blind, dose-ranging, non-inferiority study. », Lancet Infect Dis., , p. 15(12):1409-19
- université Paul-Sabatier de Toulouse, le CNRS, l'IRD, et le Muséum national d'histoire naturelle
- La tisane de Quassia : un antipaludique efficace. Communiqué de presse du CNRS du 11 septembre 2006.
- (en) Antibacterial neurymenolides from the Fijian red alga Neurymenia fraxinifolia - Résumé. Par E.P. Stout, A.P. Hasemeyer, A.L. Lane, T.M. Davenport, S. Engel, M.E. Hay, C.R. Fairchild, J. Prudhomme, K. Le Roch, W. Aalbersberg, J. Kubanek. Dans Org Lett. (2009) ; 1 jan 2011 (1), pp. 225-228.
- (en) « Structure and antibacterial activity of brominated diterpenes from the red alga Sphaerococcus coronopifolius – Résumé ». Par V. Smyrniotopoulos, C. Vagias, M.M. Rahman, S. Gibbons, V. Roussis, dans Chem Biodivers, 7 janvier 2010 (1), pp. 186-195.
- (en) Article du Microbe Magazine de septembre 2009 sur le potentiel antipaludique de l'algue rouge.
- (en) « Bioactive bromophycolides R-U from the Fijian red alga Callophycus serratus - Résumé» Par A.S. Lin, E.P. Stout, J. Prudhomme, K. Le Roch, C.R. Fairchild, S.G. Franzblau, W. Aalbersberg, M.E. Hay et J. Kubanek. Dans J Nat Prod., 26 février 2010 ; 73 (2), pp. 275-278.
- (en) « Communiqué de presse de GlaxoSmithKline »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) du 20 janvier 2010.
- (en) « Mosquito gut bacteria shown to kill malaria parasite ». Article du 12 mai 2011, dans le site Examiner.com.
- (en) « Natural Microbe-Mediated Refractoriness to Plasmodium Infection in Anopheles gambiae » - Abstract. Dans Sciencemag.org, article du 13 mai 2011.
- « Paludisme : le nouveau médicament qui frappe le parasite dans le foie et dans le sang ». sur le site santelog.com.
- Marc Mennessier, « Paludisme : Sanofi réalise la synthèse de l'artémisinine », Le Figaro.fr, (lire en ligne)
- Véronique Greenwood, « Les stratagèmes du paludisme enfin déjoués », Pour la science, hors-série no 113, , p. 46-54.
- (en) Cochrane Reviews publié le 19 avril 2006 [(en) lire en ligne]
- Fact Sheet: RTS, S Malaria Vaccine Clinical Trials. Dossier de presse du 17 octobre 2007 émis conjointement par The PATH Malaria Vaccine Initiative (PATH/MVI) et GlaxoSmithKline Biologicals (GSK Bio)|.
- (en) Informations données par le professeur Alonso sur le RTS, S dans The Lancet du 10 décembre 2005.
- (en) Malaria Vaccine Initiative - Sites choisis pour les essais cliniques de la phase III du RTS, S/AS02A.
- (en) Selidji T Agnandji, José F Fernandes, Emmanuel B Bache & Michael Ramharter, « Clinical development of RTS,S/AS malaria vaccine: a systematic review of clinical Phase I–III trials », Future Microbiology, (lire en ligne)
- (en) Daniel Chandramohan, Issaka Zongo, Issaka Sagara et Matthew Cairns, « Seasonal Malaria Vaccination with or without Seasonal Malaria Chemoprevention », New England Journal of Medicine, , NEJMoa2026330 (ISSN 0028-4793 et 1533-4406, DOI 10.1056/NEJMoa2026330, lire en ligne, consulté le )
- London School of Hygiene and Tropical Medicine et auteur principal de l’étude publiée en aout 2021 par le New England Journal of Medicine
- « Paludisme : une nouvelle approche diminue de 70 % les cas graves chez les enfants », sur lavoixdunord.fr, (consulté le )
- (en) R. Audran, F. Lurati-Ruiz, B. Genton, H.E. Blythman, O. Ofori-Anyinam, C. Reymond, G. Corradin et F. Spertini, « The Synthetic Plasmodium falciparum Circumsporozoite Peptide PfCS102 as a Malaria Vaccine Candidate: A Randomized Controlled Phase I Trial », PLOS ONE, (DOI 10.1371/journal.pone.0007304)
- Communiqué de presse de l'Institut Pasteur.
- (en) Battling Malaria: Strengthening the U.S. Military Malaria Vaccine Program. Par Institute of Medicine - Rapport du 25 mai 2006.
- (en) Phase I des essais du FMP2.1/AS02A au Mali - 1re édition. Par le U.S. National Institute of Health. 27 juillet 2006.
- « Un nouveau vaccin expérimental ». Article du 4 février 2010 (source AFP). Dans le site guinee24.com.
- (en) U.S. National Institute of Health : Phase I des essais du FMP2.1/AS02A au Mali. 1re édition : 12 avril 2007.
- Vaccine Could Be Lethal Weapon Against Malaria, Cholera. Par University of Central Florida, communiqué du 26 janvier 2010.
- (en) « Chloroplast-derived vaccine antigens confer dual immunity against cholera and malaria by oral or injectable delivery. » - Résumé. Par A. Davoodi-Semiromi, M. Schreiber, S. Nalapalli, D. Verma, N.D. Singh, R.K. Banks, D. Chakrabarti et H. Daniell, dans Plant Biotechnol J., février 2010 ; 8 (2), pp. 223-242. Epub 28 déc. 2009. .
- Une plante transplastomique est un végétal dont les chloroplastes ont été transformés génétiquement afin de multiplier les transgènes par cellule.
- (en) « Malaria vaccine from Oxford covid-19 team is most effective ever made », New Scientist, (lire en ligne, consulté le ).
- Curriculum vitæ du professeur Crisanti [(en) lire en ligne]
- (en) Article dans Science Daily du 21 février 2003.
- Site Web du Genoscope - Article sur le séquençage complet du génome d’Anopheles gambiae [(fr) lire en ligne]
- Académie des Sciences de l'Institut de France - Article du 12 juin 2007 « http://www.academie-sciences.fr/conferences/seances_publiques/pdf/gas_12_06_07_C_Frolet.pdf »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- Article sur Anopheles gambiae dans le site Genoscope.
- (en) « The First Malaria-Proof Mosquito ». Par Daniel Stolte, University of Arizona - Communication du 15 juillet 2010.
- (en) Summary of the World Malaria Report 2015 (lire en ligne), p. 5
- (en) Data table F : Population at risk and estimated malaria cases and deaths, 2010–2018 (lire en ligne)
- (en) J. Breman, « The ears of the hippopotamus: manifestations, determinants, and estimates of the malaria burden », dans Am J Trop Med Hyg, vol. 64, nos 1-2, p. 1-11, 2001 [lire en ligne]
- L'estimation est difficile du fait du manque de fiabilité des statistiques dans les pays concernés ; en 2005, des chercheurs estimaient dans la revue Nature à 515 millions le nombre de malades en 2002 (dans une fourchette allant de 300 à 660 millions), alors que l'estimation de l'OMS en 1999 dans son rapport sur la santé dans le monde était de 273 millions. L'OMS a déclaré avoir révisé ce chiffre dès l'année suivante et travailler depuis avec une fourchette allant de 300 à 500 millions. Cf. la dépêche de John Bonner du 10 mars 2005 (15:18), « Row erupts over WHO's malaria 'miscalculation' », sur le site du New Scientist [(en) lire en ligne]
- « Factsheet on the World Malaria Report 2013 », sur OMS,
- (en) Greenwood BM, Bojang K, Whitty CJ, Targett GA, « Malaria », dans The Lancet, vol. 365, p. 1487-1498, 2005.
- (en) Hay S, Guerra C, Tatem A, Noor A, Snow R, « The global distribution and population at risk of malaria: past, present, and future », dans Lancet Infect Dis, vol. 4, no 6, pp. 327-36, 2004.
- Murray CJL, Rosenfeld LC, Lim SS et al. Global malaria mortality between 1980 and 2010: a systematic analysis, Lancet, 2012;379:413-431
- (en) Korenromp E, Williams B, de Vlas S, Gouws E, Gilks C, Ghys P, Nahlen B, « Malaria attributable to the HIV-1 epidemic, sub-Saharan Africa », dans Emerg Infect Dis, vol. 11, no 9, pp. 1410-1419, 2005 [lire en ligne]
- (en) Abu-Raddad L, Patnaik P, Kublin J, « Dual infection with HIV and malaria fuels the spread of both diseases in sub-Saharan Africa », dans Science, vol. 314, no 5805, pp. 1603-1606, 2006.
- (en) Layne SP, Principles of Infectious Disease Epidemiology, EPI 220, UCLA Department of Epidemiology [lire en ligne]
- Greenwood B, Mutabingwa T, « Malaria in 2002 », dans Nature, vol. 415, nos 670-2, 2002.
- (en) Grover-Kopec E, Kawano M, Klaver R, Blumenthal B, Ceccato P, Connor S, « An online operational rainfall-monitoring resource for epidemic malaria early warning systems in Africa » Malar J. 2005, vol. 4, p. 6. [lire en ligne]
- (en) Van Benthem B, Vanwambeke S, Khantikul N, Burghoorn-Maas C, Panart K, Oskam L, Lambin E, Somboon P, « Spatial patterns of and risk factors for seropositivity for dengue infection » Am J Trop Med Hyg. 2005, vol. 72, no 2, p. 201-8. [lire en ligne]
- (en) Trung H, Van Bortel W, Sochantha T, Keokenchanh K, Quang N, Cong L, Coosemans M, « Malaria transmission and major malaria vectors in different geographical areas of Southeast Asia » Trop Med Int Health 2004, vol. 9, no 2, p. 230-7, 2004.
- Rémi Barroux, « Après des décennies de lutte, le Sri Lanka a vaincu le paludisme », Le Monde.fr, (lire en ligne, consulté le )
- https://www.france24.com/fr/asie-pacifique/20210630-apr%C3%A8s-70-ans-de-lutte-la-chine-a-r%C3%A9ussi-a-%C3%A9radiquer-le-paludisme
- (en) Keiser J, Utzinger J, Caldas de Castro M, Smith T, Tanner M, Singer B, « Urbanization in sub-saharan Africa and implication for malaria control », dans Am J Trop Med Hyg, vol. 71, no 2, p. 118-27, 2004 [lire en ligne]
- (en) Hay SI, Snow RW, « The Malaria Atlas Project: Developing Global Maps of Malaria Risk », dans PLoS Medicine, vol. 3, no 12, p. e473, 2006 [lire en ligne]
- Eric Leroy, Histoire de la médecine: La Malaria Fléau de l'Afrique, Leroy Press Agency (Ed.), (ISBN 978-2810619337)
- Callot J. : « Un problème complexe : la régression du paludisme en France ». In : Annales. Économies, Sociétés, Civilisations, 2e année, no 3, 1947, p. 330-332.
- Adéa Guillot, « En Grèce, le dénuement et l’isolement des migrants du camp de Frakaport », Le Monde.fr, (lire en ligne)
- Pierre-Olivier Fanica, « La disparition du paludisme dans la France rurale et la régression des terres humides : Exemple de la Sologne », Étude et Gestion des Sols, vol. 13, no 1, , p. 53-61 (lire en ligne [PDF])
- Gilles Bouvenot, Bernard Devulder et Loïc Guillevin, Pathologie médicale, tome 2 : Immunopathologie, allergologie, maladies infectieuses, parasitologie, gériatrie, éditions Masson, Abrégé Médecine, 1994, p. 336.
- Podcast du Figaro.
- moustiquesinfos.sante.gouv.fr « Le paludisme à la Réunion et dans le monde » sur le site du ministère français de la Santé.
- (de) Bruno Pradines, « Épidémiologie du paludisme d'importation en France », La Revue du praticien, vol. 69, , p. 150-152
- Olivier Bouchaud et Bruno Pradines, « Situation du paludisme dans le monde », La Revue du Praticien, vol. 69, , p. 145-149
- G. Brücker, « Pathologie des congés et des retours », La Revue du Praticien, vol. 34 « Pathologie des migrants », no 57, , p. 3223-3228
- Simon I. Hay et al. « The global distribution and population at risk of malaria : past, present, and future » The Lancet Infectious Diseases, vol. 4, no 6, juin 2004, p. 327-336 [(en) lire en ligne]
- Rapport 2011 sur le paludisme dans le monde sur le site de l'OMS
- Secrétariat de la Convention sur la diversité biologique, « L’Initiative LifeWeb »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) (plaquette couleur recto-verso)
- Le Figaro du 10 juin 2008, page 16.
- (en) Braginets OP, Minakawa N, Mbogo CM, Yan G. « Population genetic structure of the African malaria mosquito Anopheles funestus in Kenya » The American Journal of Tropical Medecine & Hygiene 2003;69(3)303-8 [lire en ligne]
- (en) Darwin H. Stapleton « Lessons of History? » Public Health Chronicles, mars-avril 2004, vol. 119.
- (en) Marcus Hall : « The Rockefeller Foundation in Sardinia: Pesticide Politics in the Struggle Against Malaria - Environmental Values (1991-2002) », 28 mars 2005.
- Auriane Guilbaud, Le paludisme - La lutte mondiale contre un parasite résistant, L'Harmattan, collection Chaos international, 2008, p. 32.
- Pierre Mouchet et allii, Biodiversité du paludisme dans le monde, John Libbey Eurotext, 2004.
- OMS (2019) Rapport Malaria eradication: benefits, future scenarios and feasibility. Executive summary of the report of the WHO Strategic Advisory Group on Malaria Eradication, 23 aout 2019 ; CC BY-NC-SA 3.0 IGO ; PDF, 172 kB ; 13pp
- Martin Enserink (2019) [https://www.sciencemag.org/news/2019/08/setting-deadline-eradicating-malaria-good-idea-scientists-are-divided (Une échéance pour éradiquer le paludisme est-elle une bonne idée ? Les scientifiques sont divisés)] 27 aout 2019
- « Progrès majeurs dans la lutte contre le paludisme », sur OMS,
- (en) Victoria A. Ingham, Amalia Anthousi, Vassilis Douris et Nicholas J. Harding, « A sensory appendage protein protects malaria vectors from pyrethroids », Nature, vol. 577, no 7790, , p. 376–380 (ISSN 1476-4687, PMID 31875852, PMCID PMC6974402, DOI 10.1038/s41586-019-1864-1, lire en ligne, consulté le )
- (en) J. Sachs et P. Malaney, « The economic and social burden of malaria » Nature 2002, vol. 415, p. 680-5.
- Roll Back Malaria, Le Paludisme en Afrique, bulletin d'information no 3, [lire en ligne]
- Sandi Doughton, article du Seattle Times du 13 juin 2008 - « Reviving low-tech solutions » [(en) lire en ligne]
- Roll Back Malaria, Economic costs of malaria, OMS [lire en ligne]
- (en) K. Mendis, B. Sina, P. Marchesini et R. Carter, « The neglected burden of Plasmodium vivax malaria », Am J Trop Med, vol. 64, nos 1-2S, , p. 97-106 (lire en ligne [PDF])
- (en) A.A. Escalante et F.J. Ayala, « Phylogeny of the malarial genus Plasmodium, derived from rRNA gene sequences », PNAS, vol. 91, no 24, , p. 11373-7 (lire en ligne [PDF])
- (en) PCC Garnham, Malaria parasites and other haemosporidia, Blackwell Scientific Publications, Oxford, 1996.
- Permin A. et Madsen M., Investing in Animal Health Research to Alleviate Poverty, International Livestock Research Institute, 2001, Appendix 2: review on disease occurrence and impact (smallholder poultry) [lire en ligne]
- (en) Atkinson CT, Woods KL, Dusek RJ, Sileo LS, Iko WM, « Wildlife disease and conservation in Hawaii: pathogenicity of avian malaria (Plasmodium relictum) in experimentally infected iiwi (Vestiaria coccinea) » Parasitology 1995;111 Suppl.:S59-69.
- Science & Vie du 6 décembre 2009 : « L'anophèle piégé par une chaussette sale » « http://mondedurable.science-et-vie.com/2009/12/lanophele-piege-par-une-chaussette-sale/ »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- (en) Oshikazu Shirai, Takao Tsuda, Shinya Kitagawa et Ken Naitoh, « Alcohol ingestion stimulates mosquito attraction », Journal of the American Mosquito Control Association, vol. 18, no 2, , p. 91–96 (ISSN 8756-971X, PMID 12083361, lire en ligne, consulté le )
- (en) R.J. Pitts, D.C. Rinker, P.L. Jones, A. Rokas et L.J. Zwiebel LJ, « Transcriptome profiling of chemosensory appendages in the malaria vector Anopheles gambiae reveals tissue- and sex-specific signatures of odor coding », BMC Genomics, vol. 12, , p. 271 (DOI 10.1186/1471-2164-12-271)
- (en) T. Lefèvre, C. Lebarbenchon, M. Gauthier-Clerc, D. Missé, R. Poulin et F. Thomas, « The ecological significance of manipulative parasites », Trends Ecol Evol, vol. 24, no 1, , p. 41–48 (lire en ligne [PDF])
- (en) K.D Lafferty et A.M. Kuris, « Ecological consequences of manipulative parasites », dans Host Manipulation by Parasites, eds Hughes DP, Brodeur J, Thomas F (Oxford Univ Press, New York), (lire en ligne), p. 158–179
- (en) T. Lefèvre et F. Thomas, « Behind the scene, something else is pulling the strings: Emphasizing parasitic manipulation in vector-borne diseases », Infect Genet Evol, vol. 8, no 4, , p. 504–519 (lire en ligne [PDF])
- Poulin R (2010) Parasite manipulation of host behavior: An update and frequently asked questions. Advances in the Study of Behavior, eds Mitani J, et al. (Elsevier, New York) Vol 41, pp 151–186.
- H. Hurd (2003) Manipulation of medically important insect vectors by their parasites. Annu Rev Entomol 48(1):141–161.
- (en) De Moraes CM, Stanczyk NM, Betz HS, Pulido H, Sim DG, Read AF, Mescher MC, « Malaria-induced changes in host odors enhance mosquito attraction », PNAS, vol. 111, , p. 11079–11084 (DOI 10.1073/pnas.1405617111, lire en ligne [PDF])
- Ferguson HM, Read AF (2004) Mosquito appetite for blood is stimulated by Plasmodium chabaudi infections in themselves and their vertebrate hosts. Malar J 3:12.
- (en) R. Lacroix, W.R. Mukabana, L.C. Gouagna et J.C. Koella, « Malaria infection increases attractiveness of humans to mosquitoes », PLoS Biol 3:e298, (DOI 10.1371/journal.pbio.0030298)
- Cornet S, Nicot A, Rivero A, Gandon S (2013) Malaria infection increases bird attractiveness to uninfected mosquitoes. Ecol Lett 16:323–329. doi:10.1111/ele.12041.
- Van Dooren GG, Striepen B (2013) « The algal past and parasite present of the apicoplast ». Annu Rev Microbiol 67:271–289. doi:10.1146/annurev-micro-092412-155741 (résumé).
- , chercheuse en microbiologie moléculaire et spécialiste de la malaria chez les enfants à l'École de médecine de l'Université de Washington à Saint-Louis
- Site Web de l’École de médecine de l'Université de Washington à Saint-Louis
- Imlay L & Odom A.R (2014) Isoprenoid Metabolism in Apicomplexan Parasites. Current Clinical Microbiology Reports. 1.3-4 (2014): 37-50
- Guggisberg, A. M., Amthor, R. E., et Odom, A. R. (2014) Isoprenoid Biosynthesis in Plasmodium falciparum. Eukaryotic Cell. 13.11 (2014): 1348-1359 (résumé)
- Wong RP, Flematti GR & Davis TM (2012) « Investigation of volatile organic biomarkers derived from Plasmodium falciparum in vitro». Malar J 11:314. doi:10.1186/1475-2875-11-314
- Kelly, M., Su, C-Y., Schaber, C., Crowley, J.R., Hsu, F-F., Carlson, J.R., Odom, A.R. (2015) « Malaria parasites produce volatile mosquito attractants ». mBio doi: 10.1128/mBio.00235-15, vol. 6 no. 2 e00235-15
- (en) V.O. Nyasembe, P.E.A. Teal, W.R. Mukabana, J.H Tumlinson et B. Torto, « Behavioural response of the malaria vector Anopheles gambiae to host plant volatiles and synthetic blends », Parasites & Vectors, vol. 5, , p. 234 (lire en ligne [PDF])
- Dekker T, Geier M & Cardé RT (2005) «Carbon dioxide instantly sensitizes female yellow fever mosquitoes to human skin odours ». J Exp Biol 208:2963–2972. doi:10.1242/jeb.01736 (résumé).
- (en) C.J. McMeniman, R.A. Corfas, B.J. Matthews, S.A. Ritchie SA et L.B. Vosshall, « Multimodal integration of carbon dioxide and other sensory cues drives mosquito attraction to humans », Cell, vol. 156, , p. 1060–1071 (DOI 10.1016/j.cell.2013.12.044, lire en ligne [PDF])
- Site Web du laboratoire de l'Hôpital de St Louis
- (en) Talman A, Domarle O, McKenzie F, Ariey F, Robert V, « Gametocytogenesis: the puberty of Plasmodium falciparum », dans Malar J, vol. 3, p. 24.
- Entomologie du paludisme et contrôle des vecteurs (pp. 7-8), OMS 2003 [lire en ligne]
- MEDECINE/SCIENCES 2005 (Trafic protéique dans le globule rouge infecté par Plasmodium)[lire en ligne]
- (en) Cécile Crosnier, Leyla Y. Bustamante, S. Josefin Bartholdson, Amy K. Bei, Michel Theron, Makoto Uchikawa, Souleymane Mboup, Omar Ndir, Dominic P. Kwiatkowski, Manoj T. Duraisingh, Julian C. Rayner and Gavin J. Wright, Basigin is a receptor essential for erythrocyte invasion by Plasmodium falciparum. lire en ligne.
- E. Pilly, Maladies infectieuses et tropicales : tous les items d'infectiologie, Paris, Alinéa Plus, , 720 p. (ISBN 978-2-916641-66-9), p. 512-514
- Université Paris Val de Marne - 2000 - Thèse pour le diplôme d'État de docteur en médecine (Titre 1.2.2.)[lire en ligne]
- (en) Cox-Singh J, Davis TM, Lee KS, Shamsul SS, Matusop A, Ratnam S, Rahman HA, Conway DJ, Singh B, « Plasmodium knowlesi malaria in humans is widely distributed and potentially life threatening », Clin Infect Dis, vol. 46, no 2, , p. 165-71. (PMID 18171245, PMCID PMC2533694, DOI 10.1086/524888, lire en ligne [html])
- Marc Gentilini, Médecine Tropicale, Paris, Flammarion Médecine-Sciences, , 928 p. (ISBN 2-257-14394-9), p. 101.
- (en) Résultats d'une étude chez la souris DOI:10.1038/nm.2368
- NCBI - Taxonomy browser (Navigateur sur les codes génétiques des différences espèces de Plasmodium falciparum) [(en) lire en ligne]
- P. Bartolucci, « Hémoglobinopathies : un avantage contre le paludisme mais au risque de maladies sévères », La Revue du Praticien, vol. 64, , p. 1110-1011
- (en) Denis Pierron, Margit Heiske, Harilanto Razafindrazaka et Veronica Pereda-loth, « Strong selection during the last millennium for African ancestry in the admixed population of Madagascar », Nature Communications, vol. 9, no 1, , p. 932 (ISSN 2041-1723, PMID 29500350, PMCID PMC5834599, DOI 10.1038/s41467-018-03342-5, lire en ligne, consulté le )
- CNRS - Paludisme - Le parasite P. vivax infecte des populations considérées jusqu'à présent comme résistantes - 16 mars 2010 [(fr) lire en ligne]
- (en) Carolina Lopez, Carolina Saravia et al. « Mechanisms of genetically-based resistance to malaria » Gene 2010;467(1-2):1-12.
- Nicolas Vignier, « Prise en charge de l'accès palustre simple, une urgence thérapeutique », La Revue du Praticien, vol. 69, , p. 152-158
- Johann Cailhol, « Paludisme », La Revue du Praticien, vol. 64, , p. 1457-1468
- D'après Fritz H. Kayser (trad. de l'allemand), Manuel de poche de Microbiologie Médicale, Paris, Flammarion Médecine-Sciences, , 764 p. (ISBN 978-2-257-11335-1), p. 597-599.
- Marc Gentilini 1994, op. cit., p. 95.
- Marc Gentilini 1993, op. cit., p. 103-106.
- A. Manuila, Dictionnaire français de Médecine et de Biologie, t. II, Paris, Masson, , p. 207-210
- Critères de paludisme grave retenus par l'OMS [lire en ligne], p. 15.
- Trampuz A, Jereb M, Muzlovic I, Prabhu R, « Clinical review: Severe malaria », dans Crit Care, vol. 7, no 4, p. 315-23, 2003 [lire en ligne]
- Kain K, Harrington M, Tennyson S, Keystone J, « Imported malaria: prospective analysis of problems in diagnosis and management » Clin Infect Dis. 1998, vol. 27, no 1, p. 142-9.
- Stéphane Jauréguiberry, « Accès palustre », La Revue du Praticien - médecine générale, vol. 21, nos 754/755, , p. 23-28.
- Redd S et al., « Clinical algorithm for treatment of Plasmodium falciparum malaria in children », dans Lancet, vol. 347, no 8996, p. 223-7, 1996.
- American Journal of Public Health, « Community Health Worker Performance in the Management of Multiple Childhood Illnesses: Siaya District, Kenya, 1997–2001 » octobre 2001 [(en) lire en ligne]
- (en) Pattanasin S. et al. « Evaluation of a new Plasmodium lactate dehydrogenase assay (OptiMAL-IT) for the detection of malaria » Transact Royal Soc Trop Med. 2003, vol. 97, p. 672-4.
- RollBackMalaria - Consommables et produits non médicaux pour le paludisme - Séminaire du 5 au 9 mars 2006 à Dakar [lire en ligne]
- (en) Ling IT. et al. « Antibodies to the glutamate dehydrogenase of Plasmodium falciparum » Parasitology 1986, vol. 92, p. 313-24.
- « Tests de diagnostic rapide du paludisme », sur medecinetropicale.free.fr,
- (en) Adak T, Sharma V, Orlov V, « Studies on the Plasmodium vivax relapse pattern in Delhi, India », dans Am J Trop Med Hyg, vol. 59, no 1, p. 175-9, 1998
- Marc Gentilini 1994, op. cit., p. 109.
- Marc Gentilini 1994, op. cit., p. 107-109.
- Bénédicte Girard, « Fièvre et grossesse », La Revue du Praticien, vol. 57, , p. 665-669
- « OMS | Le Rapport sur le paludisme dans le monde 2019 en un clin d’oeil », sur WHO (consulté le )
- (en) Athena P. Kourtis, « Pregnancy and Infection », The New England Journal of Medicine, vol. 370, no 23, , p. 2211-2218.
- (en) Zhi-yong Tao, Qiang Fang, Xue Liu et Richard Culleton, « Congenital Malaria in China », PLoS Neglected Tropical Diseases, vol. 8, no 3, (ISSN 1935-2727, PMID 24626148, PMCID 3953009, DOI 10.1371/journal.pntd.0002622, lire en ligne, consulté le )
- (en) Jane Crawley, « Malaria in children », Lancet, vol. 375, , p. 1468-1481.
- (en) Lauren M. Cohee et Miriam K. Laufer, « Malaria in Children », Pediatric clinics of North America, vol. 64, no 4, , p. 851–866 (ISSN 0031-3955, PMID 28734514, PMCID 5733786, DOI 10.1016/j.pcl.2017.03.004, lire en ligne, consulté le )
- Tania Ikowsky, « Paludisme d'importation chez le nourrisson », La Revue du Praticien - médecine générale, vol. 23, no 824, , p. 431-432
- (en) Kimberly E. Mace et Paul M. Arguin, « Malaria Surveillance — United States, 2014 », MMWR Surveillance Summaries, vol. 66, no 12, , p. 1–24 (ISSN 1546-0738, PMID 28542123, PMCID 5829864, DOI 10.15585/mmwr.ss6612a1, lire en ligne, consulté le )
- Marc Gentilini 1994, op. cit., p. 110.
- (en) Federica Verra, Andrea Angheben, Elisa Martello et Giovanni Giorli, « A systematic review of transfusion-transmitted malaria in non-endemic areas », Malaria Journal, vol. 17, (ISSN 1475-2875, PMID 29338786, PMCID 5771189, DOI 10.1186/s12936-018-2181-0, lire en ligne, consulté le )
- F. Denis, Les Bactéries, champignons et parasites transmissibles de la mère à l'enfant, John Libbey Eurotext, 2002, p. 376.
- (en) Ehsan Ahmadpour, Masoud Foroutan-Rad, Hamidreza Majidiani et Sirous Mehrani Moghaddam, « Transfusion-Transmitted Malaria: A Systematic Review and Meta-analysis », Open Forum Infectious Diseases, vol. 6, no 7, (ISSN 2328-8957, PMID 31334300, PMCID 6634438, DOI 10.1093/ofid/ofz283, lire en ligne, consulté le )
- J. Ranque : « Le paludisme post-transfusionnel: État actuel de la question ».
- François Lefrère, « Risques transfusionnels actuels », La Revue du Praticien - médecine générale, vol. 27, no 894, , p. 74-75
- « Paludisme : avis sur la sécurité transfusionnelle et les greffes », sur hcsp.fr, , p. 7-8
- Nicolas Vignier, « Formes particulières de paludisme », La Revue du Praticien, vol. 69, , p. 159-161
- (en) Danielle I. Stanisic, James S. McCarthy et Michael F. Good, « Controlled Human Malaria Infection: Applications, Advances, and Challenges », Infection and Immunity, vol. 86, no 1, (ISSN 0019-9567, PMID 28923897, PMCID 5736798, DOI 10.1128/IAI.00479-17, lire en ligne, consulté le )
- (en) Mockenhaupt F. et al. « Manifestation and outcome of severe malaria in children in northern Ghana » Am J Trop Med Hyg. 2004;71(2):167-72.
- Les médicaments obsolètes retardent la victoire contre le paludisme - Article du Daily Nation du 30/06/2009 [(en) lire en ligne]
- Des cliniques privées utilisent toujours les anciens traitements - Article du Daily Nation du 23/04/2009 [(en) lire en ligne]
- BEH - Chimiosensibilité du paludisme importé en France en 2001 et 2002 (article du 3 février 2004) [(en) lire en ligne]
- (en) Nicholas J. White, « Malaria — Time to Act », New Eng. J. Med., vol. 355, , p. 1956-1957 (lire en ligne)
- (en) M.K. Laufer, P.C. Thesing, N.D. Eddington, R. Masonga, F.K. Dzinjalamala, S.L. Takala, T.E. Taylor et C.V. Plowe, « Return of Chloroquine Antimalarial Efficacy in Malawi », New Engl. J. Med., vol. 355, , p. 1959-1966 (lire en ligne)
- (en) Shweta Sinha, Bikash Medhi et Rakesh Sehgal, « Challenges of drug-resistant malaria », Parasite, vol. 21, , p. 61 (ISSN 1776-1042, DOI 10.1051/parasite/2014059)
- (en) Brian K. S. Yeung, Bin Zou, Matthias Rottmann et al., « Spirotetrahydro Beta-carbolines (Spiroindolones): A New Class of Potent and Orally Efficacious Compounds for the Treatment of Malaria », J. Med. Chem., vol. 53, no 14, , p. 5155-5164 (résumé).
- (en) Nicholas J. White, Sasithon Pukrittayakamee, Aung Pyae Phyo et al., « Spiroindolone KAE609 for Falciparum and Vivax Malaria », N. Engl. J. Med., no 376, , p. 404-410 (résumé).
- Nobutaka Kato (2016) Diversity-oriented synthesis yields novel multistage antimalarial inhibitors ; Nature ; doi:10.1038/nature19804, mis en ligne :07 September 2016, consulté 10 septembre 2016
- Lon CT, Tsuyuoka R, Phanouvong S et al. « Counterfeit and substandard antimalarial drugs in Cambodia », dans Trans R Soc Trop Med Hyg, vol. 100, no 11, p. 1019-24, 2006.
- (en) U. S. Pharmacopeia, Fake antimalarials found in Yunan province, China, 2004 « http://www.uspdqi.org/pubs/other/FakeAntimalarialsinChina.pdf »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- (en) Newton PN, Green MD, Fernández FM, Day NPJ, White NJ, « Counterfeit anti-infective drugs », dans Lancet Infect Dis, vol. 6, no 9, p. 602-13, 2006
- BBC News du 17 août 2007 [lire en ligne]
- « Un candidat vaccin contre le paludisme soulève de nouveaux espoirs », Le Monde.fr, (lire en ligne, consulté le )
- « Paludisme : vers un vaccin à base de l'ARNm ? | Rewmi.com » (consulté le )
- « BioNTech va lancer un vaccin à ARNm contre le paludisme », sur LCI (consulté le )
- « Vaccin contre le Sida : Moderna lance des essais cliniques avec un vaccin à ARN messager », sur ladepeche.fr (consulté le )
- « Médecine. Les promesses de l’ARN messager », sur Courrier international, (consulté le )
- « La technologie de l'ARN messager porteuse d'espoirs pour d'autres maladies », sur rts.ch, (consulté le )
- « Après le Covid, BioNTech mise sur un vaccin contre le paludisme », sur RTBF Info, (consulté le )
- « Un vaccin contre le paludisme dans le viseur de BioNTech », sur Maroc Diplomatique, (consulté le )
- Kevin Hull, Malaria: Fever Wars, documentaire PBS, 2006 « http://www.wgbh.org:81/cgi-bin/nph-algs.cgi/000000A/http/www.wgbh.org/schedules/program-info?program_id=2682027&episode_id=2682029 »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- (en) Barat, « Four malaria success stories: how malaria burden was successfully reduced in Brazil, Eritrea, India, and Vietnam », Am J Trop Med Hyg, vol. 74, no 1, p. 12-16, 2006.
- [lire en ligne]
- Préfecture de la Réunion - Direction des Affaires Sanitaires et Sociales - La lutte contre les moustiques - 2006 [lire en ligne]
- Organisation mondiale de la santé, La planification de programmes de lutte contre le paludisme : guide du stagiaire, éd. provisoire, OMS, Genève, 2003, p. 128 [lire en ligne]
- « Qu'est-ce qu'une chauve-souris ? », sur www.nuitdelachauvesouris.com
- « Le séquençage du génome du moustique, publié dans la revue Science, ouvre la voie à de nouveaux moyens de lutte contre le paludisme » Eurekalert.org, 2 octobre 2002 [lire en ligne]
- (en) Smit MR, Ochomo EO, Aljayyoussi G, et al., « Safety and mosquitocidal efficacy of high-dose ivermectin when co-administered with dihydroartemisinin-piperaquine in Kenyan adults with uncomplicated malaria (IVERMAL): a randomised, double-blind, placebo-controlled trial », The Lancet Infectious Diseases, vol. 18, no 6, , p. 615-626 (DOI 10.1016/s1473-3099(18)30163-4, lire en ligne)
- (en) E.J. Kweka, F. Mosha, A. Lowassa et al., « Ethnobotanical study of some of mosquito repellent plants in north-eastern Tanzania », Malaria Journal, vol. 7, , p. 152 (DOI 10.1186/1475-2875-7-152)
- Saltidin - Informations techniques (en) « http://www.bayrepel.com/?501A1 »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- Institut de Médecine Tropicale Anvers-Conseils de santé pour voyageurs;édition destinée au corps médical 2007-2008 [[
- http://www.itg.be/ITG/Uploads/MedServ/fmedasso.pdf lire en ligne]]
- ITG (Instituut voor Tropische Geneeskunde-Votre santé durant le voyage-Malaria (version août 2008) [lire en ligne]
- Centre Belge d'Information Pharmacothérapeutique-Commentaires, posologie des tétracyclines [lire en ligne]
- Centre Belge d'Information Pharmacothérapeutique-Commentaires, posologie des antipaludéens-Répertoire "nom de la spécialité" débutant par "L" [lire en ligne]
- Centre Belge d'Information Pharmacothérapeutique-Commentaires, posologie des antipaludéens-Répertoire "nom de la spécialité" débutant par "M" [lire en ligne]
- Article du The Standard du 8 mai 2010 - Combattre la malaria par des SMS [(en) lire en ligne]
Voir aussi
Bibliographie
- Jacques Verdrager, L'OMS et le paludisme : mémoires d'un médecin spécialiste de la malaria. – L'Harmattan, coll. « Acteurs de la science », Paris, 2005 (ISBN 2-7475-8246-9)
- « Santé des voyageurs et recommandations sanitaires 2005 », Bulletin épidémiologique hebdomadaire, no 24-25/2005 () [lire en ligne]
- (en) Robert W. Snow et al. « The global distribution of clinical episodes of Plasmodium falciparum malaria », Nature, vol. 434, no 7030 (10 mars 2005), p. 214-217 [(en) présentation en ligne]
- Marie Josserand Debacker, Paludisme : historique, mythes, croyances et idées reçues, thèse d'exercice, Médecine, Paris XII, 2000 [lire en ligne]
- Serge Paul Eholié, Emmanuel Bissagnéné et Pierre-Marie Girard (dir.), Mémento thérapeutique du paludisme en Afrique, Doin, IMEA, Paris, 2008, 139 pages (ISBN 978-2-7040-1253-4)
- Christian Lengeler, Jacqueline Cattani et Don de Savigny (dir.), Un mur contre la malaria : du nouveau dans la prévention des décès dus au paludisme, Centre de recherches pour le développement international, Ottawa ; Organisation mondiale de la santé, Genève, 1997, 220 pages (ISBN 0-88936-831-7)
- Jean Mouchet, Pierre Carnevale, Marc Coosemans et al. Biodiversité du paludisme dans le monde, J. Libbey Eurotext, Montrouge, 2004, 428 pages (ISBN 2-7420-0528-5)
Filmographie
- Paludisme, l'hécatombe silencieuse, documentaire réalisé par Bernard Germain et Jean Vercoutère, produit par Mosaïque Films (Paris) et distribué par ADAV, 2000, 54 minutes (VHS)
- Les Faucheurs de palu, documentaire de 52 minutes réalisé par Patrice Desenne, produit par Effervescence, France 5, Public Sénat, IRD.
- Paludisme : Enquête en forêt gabonaise un film sur l'origine animale du paludisme (16 min), IRD.
Articles connexes
- Against Malaria Foundation
- Malaria Consortium
- Martin Shkreli et le scandale du Daraprim
- Journée mondiale du paludisme
- Paludisme aviaire
- Malaria Control
- Fonds mondial de lutte contre le SIDA, la tuberculose et le paludisme
- DNDi (Drugs for Neglected Diseases Initiative)
- Marais pontins
- Atabrine
- Association internationale de développement
- Dichlorodiphényltrichloroéthane
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressources relatives à la santé :
- Orphanet
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) Héritage mendélien chez l'humain
- (en) Héritage mendélien chez l'humain
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Page de l'OMS
- Malaria Atlas Project
- (en) Site européen BIOMALPAR, dédié au paludisme
- Against Malaria Foundation : association caritative qui fournit aux populations à haut risque face au paludisme des moustiquaires imprégnées d'insecticide longue durée. C'est l'une des 9 organisations caritatives les plus efficaces au monde selon GiveWell.
- Portail des maladies infectieuses
- Portail de l’hématologie
- Portail de la parasitologie