بيريدين
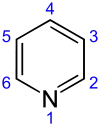
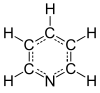
البَيريدِين (أو البايريدين، ويرمز له اختصاراً Py) هو مركّب عضوي صيغته الكيميائية C5H5N وهو من المركّبات العطرية الحلقية غير المتجانسة. تتكوّن بنية البيريدين من حلقة سداسية غير مشبعة حاوية على ذرّة نيتروجين، وتوجد هذه الحلقة في بنية عددٍ من المركّبات المهمّة، متضمّنةً الآزينات وغيرها مثل النياسين والبيريدوكسين والنيكوتين.[4]
| بيريدين | |
|---|---|
 بيريدين |
 بيريدين |
 بيريدين |
 بيريدين |
 بيريدين | |
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Pyridine[1] | |
| تسمية الاتحاد الدولي للكيمياء | |
Azinine | |
| أسماء أخرى | |
Azine | |
| المعرفات | |
| الاختصارات | Py |
| رقم CAS | 110-86-1 |
| بوب كيم | 1049 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C5H5N |
| الكتلة المولية | 79.101 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 0.98 غ/سم3 |
| نقطة الانصهار | - 41.6 °س |
| نقطة الغليان | 115.2 °س |
| الذوبانية في الماء | يمتزج مع الماء |
| المخاطر | |
| ترميز المخاطر |  F F
 Xn Xn |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
يعدّ البيريدين من المركّبات الطليعية التي يبنى عليها في تشكيل مركّبات كيميائية أخرى في عددٍ من المجالات الصناعية التطبيقية مثل الكيمياء الزراعية وصناعة الدواء. يستخدم البيريدين في الصناعة مذيباً وكاشفاً كيميائياً؛ وكذلك في اصطناع الحمض النووي الريبوزي منقوص الأكسجين (DNA) في المختبر.[5]
تاريخياً كان البيريدين يستحصل من قطران الفحم وكناتج ثانوي من عملية تغويز الفحم؛ إلّا أنّ ازدياد الطلب عليه أدّى إلى تطوير تفاعلات اصطناع عضوي من مركّبات بسيطة مثل الأسيتالدهيد والأمونياك. يُنتج سنوياً أكثر من 20 ألف طنّ من المركّب في مختلف أرجاء العالم.
التاريخ
.jpg.webp)
عُرف البيريدين غير النقي من الخيميائيين القدماء غالباً، وذلك بتسخين عظام الحيوانات والمواد العضوية الأخرى؛[6] إلّا أنّ اكتشافه ينسب إلى العالم الكيميائي توماس أندرسون.[7][8] اكتشف أندرسون البيريدين سنة 1849 أثناء فحصه محتويات الزيت المستحصل من تسخين عظام الحيوانات لدرجات حرارة مرتفعة؛[8] فقام بدراسة خواصه، ونظراً لقابلية المركّب للاشتعال أسماه pyridine من السابقة الإغريقية πῦρ (پير) بمعنى: نار؛ واللاحقة idine إيدين، والتي أضيفت للتوافق آنذاك مع تسمية المركّبات الكيميائية الحاوية على ذرة نتروجين، مثل مركّب التوليدين.[9] حُدّدت البنية الكيميائية للبيريدين في عقود تلت بعد اكتشافه، حيث حاول الكيميائيون معرفتها بالوسائل المتاحة لديهم آنذاك؛ فاقترح فيلهلم كورنر سنة 1869،[10] و جيمس ديوار سنة 1871 [11][12] أنّ البنية مشتقّة من البنزين بوجود ذرّة نتروجين محلّ وحدة C–H في الحلقة، كما هو وجه الشبه في حالة الكينولين والنفثالين.[13][14] جرى تأكيد هذا الاقتراح لاحقاً بأسلوب تجريبي عند اختزال المركّب إلى بيبريدين باستخدام الصوديوم في الإيثانول.
قام وليام رامزي في سنة 1876 بتحضير البيريدين مخبرياً من مفاعلة الأسيتيلين مع سيانيد الهيدروجين في فرن حراري؛ وكانت تلك العملية أوّل اصطناع عضوي مخبري لمركّب حلقي غير متجانس.[15][16] إلّا أنّ المحاولات المتتالية للحصول على البيريدين بوسائل أكثر كفاءة أدّت إلى تطوير عددٍ من التفاعلات الانتقائية. وهذا ما توصّل إليه العالم الروسي أليكسي تشيشيبابين سنة 1924 عندما تمكّن من تطوير تفاعل اصطناع للبيريدين اعتماداً على كواشف كيميائية منخفضة الثمن؛[17] ولا يزال هذا الأسلوب مستخدماً لتحضير هذا المركّب.[18]
التسمية الكيميائية
وفق نظام تسمية هانتش-فيدمان والموصى بها من الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) فإنّ التسمية النظامية للبيريدين هي «آزين»؛ إلّا هذه التسمية النظامية نادراً ما تستخدم مثلما هو أغلب الحال مع أغلب المركّبات العضوية البسيطة. ولذلك ووفق مراجعات IUPAC فإنّ استخدام آزين غير محبّذ حالياً وذلك لصالح استخدام تسمية «بيريدين».[19]
يبدأ ترقيم الحلقة انطلاقاً من ذرّة النتروجين، وتُرمّز ذرّات الكربون بالأرقام وفق ذلك أو باستخدام السوابق وفق نمط الاستبدال في الحلقات العطرية: أورثو وميتا وبارا أو في بعض الأحيان باستخدام أحرف الأبجدية اليونانية (α-γ). وفقاً لما سبق فإنّ ذرة الكربون ألفا α (أورثو) وبيتا β (ميتا) وغاما γ (بارا) تشير إلى الذرّات ذات الأرقام 2 و 3 و 4 على الترتيب.
يطلق على مشتقّ البيريدين اسم بيريدينيل، بحيث يشار إلى موقع الاستبدال برقم محدّد، مع العلم أنّ المشتقّ يشار إليه في بعض الأحيان بيريديل وفقاً لتوصيات IUPAC.[20] يسمّى الكاتيون الناتج عن إضافة كاشف محب للإلكترون (إلكتروفيلي) إلى ذرّة النتروجين بيريدينيوم.
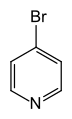 4-برومو البيريدين
4-برومو البيريدين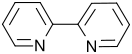 2،′2-ثنائي بيريدين
2،′2-ثنائي بيريدين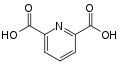 بيريدين-6،2-ثنائي حمض الكربوكسيليك (ثنائي حمض البيكولينيك)
بيريدين-6،2-ثنائي حمض الكربوكسيليك (ثنائي حمض البيكولينيك)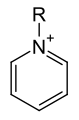 الصيغة العامّة لكاتيون البيريدينيوم
الصيغة العامّة لكاتيون البيريدينيوم
الوفرة الطبيعية

البيريدين مركّب غير واسع الانتشار في الطبيعة، لكنّه يوجد في أوراق وجذور بعض النباتات مثل ستّ الحسن (الاسم العلمي: Atropa belladonna)،[21] وفي الختمية الطبّية (الاسم العلمي: Althaea officinalis).[22]
يشكّل البيريدين، ولكن بكمّيّات نزرة، جزءاً من مكوّنات المركّبات العضوية المتطايرة الناتجة عن بعض عمليات المعالجات الغذائية للأطعمة والأطباق؛ مثل الدجاج المقلي،[23] وسوكياكي،[24] والقهوة المحمّصة،[25] ورقائق البطاطا المقلية،[26] ولحم الخنزير المقدّد المقلي.[27] يوجد آثار من البيريدين كذلك في جبنة بوفور،[28] والشاي الأحمر،[29] وبعض أنواع العسل.[30] أمّا في جسم الإنسان فيوجد ضمن تركيب الإفرازات المهبلية،[31] وفي لعاب من يعانون من التهاب اللثّة.[32] عثر على آثار من البيريدين أيضاً في دخان التبغ،[33][34] والمرجوانا.[15]
الإنتاج والتحضير
تاريخياً كان البيريدين يستحصل من قطران الفحم أو على شكل ناتج ثانوي من عملية تغويز الفحم، إلا أن تلك العمليات كانت مضنية وذات كفاءة متدنّية، إذ أنّ قطران الفحم يحوي البيريدين بنسبة 0.1% فقط؛[35] ممّا كان يتطلّب عمليّات تنقية متعدّدة المراحل، والتي كانت تقللّ من المردود بشكل إضافي. يستحصل على البيريدين حالياً بأساليب صناعية تقنية اعتماداً على تفاعلات كيميائية منسوبة إلى أسماء مكتشفيها،[18] كما هو موضّحٌ أدناه.
اصطناع تشيشيبابين
ينسب تفاعل الاصطناع هذا إلى مكتشفه العالم أليكسي تشيشيبابين الذي نشره أوّل مرّة سنة 1924، ولا يزال مستخدماً في الصناعة.[17] يصنّف هذا التفاعل كيميائياً على أنّه تفاعل تكاثف بين الألدهيدات أو الكيتونات أو أيّ مركّب من مركّبات الكربونيل β،α-غير المشبعة أو أيّ مزيج ممّا سبق مع الأمونياك أو الأمينات.[36] يستخدم هذا النموذج لتحضير البيريدين ومشتقّاته، أمّا لتحضير البيريدين غير المستبدل، فيستخدم لذلك الفورمالدهيد أو الأسيتالدهيد.
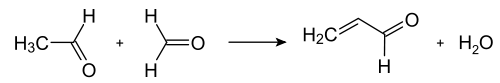
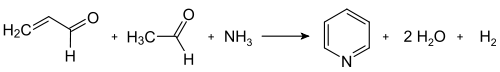
تتمّ آلية التفاعل وفق الخطوات التالية: يتشكّل أوّلاً الأكرولين وفق تكاثف ألدولي بين الفورمالدهيد والأسيتالدهيد. يتكاثف الأكرولين بدوره مع الأسيتالدهيد والأمونيا إلى ثنائي هيدرو البيريدين، ومن ثمّ يحوّل الأخير بعملية أكسدة، غالباً حفزية، إلى البيريدين. تجرى العملية في الطور الغازي عند درجات حرارة تتراوح بين 400–450 °س؛ ويتألّف الناتج من مزيجٍ من البيريدين وعددٍ من المركّبات الثانوية مثل بيكولين و6،2-لوتيدين. على العموم يعتمد تركيب المزيج على نوع الحفّاز المستخدم؛ وعادةً ما تستخدم حفّازات من أملاح الفلزّات الانتقالية مثل فلوريد الكادميوم أو فلوريد المنغنيز الثنائي، بالإضافة إلى مركّبات الكوبالت والثاليوم. يفصل البيريدين كناتج أساسي عن النواتج الثانوية بعمليّات تنقية متعدّدة المراحل.[18] لا يعدّ أسلوب اصطناع تشيشيبابين للبيريدين ملائماً للتطبيقات الصناعية بشكل كبير، بسبب المردود الضعيف (حوالي 20%)، ممّا جعل من التفاعل على شكله غير المعدّل من أساليب التحضير غير الشائعة.[36]
نزع الألكيل من ألكيلات البيريدين
يحضّر المركب أيضاً بإجراء تفاعل نزع ألكيل من ألكيلات البيريدين، وهي مركّبات تنتج ثانوياً من عمليّات صناعية مختلفة. تجرى مثلاً عملية نزع ألكيل تأكسدية إمّا باستخدام أكسجين الهواء على حفّاز من أكسيد الفاناديوم الخماسي V2O5،[37] أو على حفّاز من النيكل في الطور البخاري،[38][39] أو الألكلة المهدرجة باستخدام حفّازات من الفضة أو البلاتين.[40] يمكن أن يصل مردود هذا الأسلوب من التفاعلات إلى 93%، كما هو الحال عند استخدام حفّازات النيكل على سبيل المثال.[18]
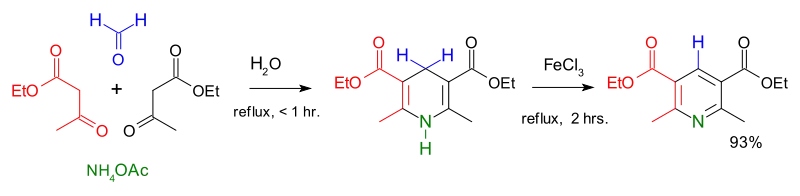
اصطناع هانتش للبيريدين
وصف أوّل اصطناع لمشتقّات البيريدين من الكيميائي آرثر رودولف هانتش سنة 1881،[41] ولذلك ينسب إليه تفاعل اصطناع هانتش للبيريدين، والذي يستخدم فيه مزيج من β-حمض كيتو (غالباً أسيتو الأسيتات) وألدهيد (غالباً فورمالدهيد) والأمونياك أو أحد أملاحه كمانح نتروجيني. يحصل في البداية على ثنائي هيدرو البيريدين، والذي يتأكسد لاحقاً إلى مشتقّات البيريدين الموافقة. أوضح الكيميائي إيميل كنوفيناغل أنّه بالإمكان الحصول على مشتقّات البيريدين غير متناظرة الاستبدال وفق هذه العملية.[42]
تحلّق بونيمان
يمكن تحضير البيريدين من إجراء تفاعل تحلّق ثلاثي الأركان، تتألّف مكوّناته من قسم من جزيء نتريل مع وحدتين من الأسيتيلين؛ ويدعى هذا التفاعل «تحلّق بونيمان»، وهو من حيث المبدأ تحوير لتفاعل اصطناع ريبه، ويمكن تنشيطه إما حرارياً أو ضوئياً. يتطلب التنشيط الحراري استخدام شروط قاسية، في حين أنّ تفاعل الإضافة الحلقية المنشّط ضوئياً يتمّ ضمن شروط معتدلة، حتى في الأوساط المائية، باستخدام حفّاز من معقد 5،1-حلقي الأوكتاديين (cod) مع الكوبالت (CoCp2(cod.[43] يمكن وفق هذه الطريقة تحضير سلسلة من مشتقّات البيريدين، فعلى سبيل المثال عند استخدام أسيتونتريل يحصل على 2-ميثيل البيريدين، والذي يستحصل منه على البيريدين بعملية نزع ألكيل.
أساليب أخرى
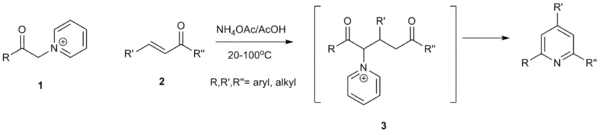
- يعطي تفاعل اصطناع كرونكه وسيلة عامّة لتحضير مشتقّات البيريدين المستبدلة انطلاقاً من البيريدين نفسه. في هذا التفاعل تتمّ مفاعلة البيريدين مع α-برومو إستر ألكيلي ليتشكّل ملح بيريدينيوم، تكون فيه مجموعة الميثيلين ذات صفة حمضية قوية، ممّا يؤدي إلى حدوث تفاعل إضافة شبيه بتفاعل مايكل مع مركّبات الكربونيل α،β-غير المشبعة بوجود أسيتات الأمونيوم، حيث يحدث تفاعل إغلاق للحلقة وتشكّل للبيريدين المستبدل بالإضافة إلى بروميد البيريدينيوم.[44]
- انطلاقاً من البيرول يحدث تفاعل إعادة ترتيب عند المفاعلة مع ثنائي كلورو الكربين للحصول على 3-كلورو البيريدين.[45][46][47]
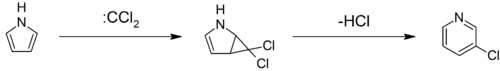
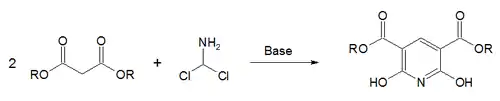
- كما يمكن الحصول على مشتقّات البيريدين انطلاقاً من تفاعل إستر المالونات مع ثنائي كلورو ميثيلامين؛[48] في تفاعل يسمى اصطناع غاترمان-سكيتا.[49]
التخليق الحيوي
يوجد النياسين، وهو من مشتقّات البيريدين (بيريدين-3-حمض الكربوكسيليك)، في عددٍ من الكائنات الحية. فعلى سبيل المثال تنتِج المتفطّرة السلّيّة (الاسم العلمي: Mycobacterium tuberculosis) والإشريكيّة القولونيّة (الاسم العلمي: Escherichia coli) حمض النيكوتينيك من تكاثف 3-فوسفات غليسيرالدهيد مع حمض الأسبارتيك.[50]
الخواص
الخواص الفيزيائية
في الشروط القياسية من الضغط ودرجة الحرارة يوجد البيريدين على شكل سائل عديم اللون يغلي عند الدرجة 115.2 °س ويتجمّد عند −41.6 °س؛ أمّا كثافته فمقدارها 0.9819 غ/سم3 وهي قريبة من كثافة الماء؛ في حين أنّ معامل الانكسار هو 1.5093 عند طول موجة 589 نانومتر ودرجة حرارة 20 °س.[51] تؤدّي إضافة الماء إلى البيريدين بنسبة 40 مول% إلى تخفيض نقطة انصهاره من −41.6 °س إلى −65.0 °س.[52] للبيريدين مغناطيسية معاكسة وتبلغ القابلية المغناطيسية له −48.7 × 10−6 سم3·مول−1؛[53] في حين تبلغ قيمة عزم ثنائي القطب قيمة مقدارها 2.2 ديباي.[54] الحرارة القياسية لتكوين البيريدين هي 100.2 كيلوجول.مول −1 في الطور السائل،[55] في حين أنّها 140.4 كيلوجول.مول −1 في الطور الغازي. عند 25 °س للبيريدين لزوجة مقدارها 0.88 ميلي باسكال.ثانية؛[56] وناقلية حرارية مقدارها 0.166 واط.متر−1·كلفن−1؛[57][58] أمّا حرارة التبخر فهي 35.09 كيلوجول.مول−1 عند نقطة الغليان تحت الضغط العادي،[59] في حين أنّ حرارة الانصهار هي 8.28 كيلوجول.مول−1 عند نقطة الانصهار.[60]
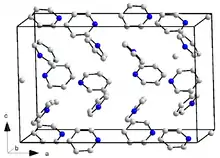
يتبلور البيريدين وفق نظام بلوري معيني قائم وتكون له الزمرة الفراغية Pna21، أمّا أبعاد الشبكة البلورية بالبيكومتر فهي a = 1752 و b = 897 و c = 1135؛ بحيث يكون هناك 16 وحدة صيغة لكلّ وحدة خلية (مقيسة عند 153 كلفن). للمقارنة فإنّ البنزين يتبلور وفق النظام البلوري المعيني القائم أيضاً وله الزمرة الفراغية Pbca وأبعاد الشبكة البلورية بالبيكومتر هي a = 729.2 و b = 947.1 و c = 674.2 (مقيسة عند 78 كلفن)؛ إلّا أنّ عدد الجزيئات لكل خلية هو 4 فقط.[61] يعود هذا الاختلاف جزئياً إلى انخفاض قيمة التناظر في جزيئات البيريدين (C2v) مقارنة مع البنزين (D6h). للبيريدين شكل مائي على هيئة ثلاثي هيدرات (py·3H2O)، وهو يتبلور وفق النظام البلوري المعيني القائم أيضاً، ولكن بالزمرة الفراغية Pbca، بحيث أنّ أبعاد الشبكة البلورية لها القيم التالية بالبيكومتر: a = 1244 و b = 1783 و c = 679؛ مع إمكانية وجود 8 وحدات صيغة لكل وحدة خلية (مقيسة عند 223 كلفن).[52]
تبلغ قيم النقط الحرجة للبيريدين 6.70 ميغاباسكال بالنسبة للضغط، و 620 كلفن بالنسبة لدرجة الحرارة؛ في حين أنّ الحجم الحرج يبلغ 229 سم3·مول−1.[62] يعبّر عن ضغط البخار p للبيريدين في مجال من درجة الحرارة بين 340–426 °س وفق معادلة أنطوان:
حيث T درجة الحرارة، أما A و B و C ثوابت قيمتها 4.16272 و 1371.358 و −58.496 على الترتيب.[63]
يحوي طيف الامتصاص للبيريدين في الهكسان على ثلاث حزم عند أطوال الموجة 195 نانومتر (توافق الانتقال *π → π وامتصاصية مولية ε مقدارها 7500 لتر.مول−1·سم−1) وعند 251 نانومتر (توافق الانتقال *π → π وامتصاصية مولية ε مقدارها 2000 لتر.مول−1·سم−1) وعند 270 نانومتر (توافق الانتقال *n → π وامتصاصية مولية ε مقدارها 450 لتر.مول−1·سم−1).[64] أمّا طيف الرنين المغناطيسي النووي 1H NMR للمركّب فله ثلاث إشارات (قمم) لها نسبة شدّة تكاملية 2:1:2 وهي توافق البرتونات الثلاثة المختلفة كيميائياً في بنية الجزيء؛ إذ أنّ الجزيء يحوي بروتونات ألفا α في المواقع 2 و 6 (ذات انزياح كيميائي 8.5 ppm) و بروتونات بيتا β في المواقع 3 و 5 (ذات انزياح كيميائي 7.1 ppm) و برتونات γ في الموقع 4 (ذات انزياح كيميائي 7.5 ppm). أمّا طيف 13C NMR للبيريدين فيظهِر قمّة ثلاثية الرؤوس عند δ(α-C) = 150 ppm و δ(β-C) = 124 ppm و δ(γ-C) = 136 ppm. جميع قيم الانزياح الكيميائي منسوبة إلى قياسات للمادّة خالية من المذيبات.[65] يمكن استخدام وسائل تحليلية أخرى للكشف عن البيريدين مثل الاستشراب الغازي ومطيافية الكتلة.[15]
الخواص الكيميائية
يصنّف البيريدين كيميائياً من المركّبات الحلقية غير المتجانسة العطرية وله صفة قاعدية ضعيفة. يمتزج البيريدين مع الماء ومع أغلب المذيبات العضوية.[51] يشكّل البيريدين مع حمض الهيدروكلوريك ملح هيدروكلوريد ينصهر بين 145–147 °س.[66] يتصرّف البيريدين في التفاعلات العضوية مثل الأمينات الثالثية، وهو يخضع لتفاعلات كيميائية متعدّدة مثل البرتنة والألكلة والأسيلة والأكسدة الأمينية على ذرّة النتروجين؛ كما أنّه يخضع لتفاعلات الاستبدال المحبّة للنواة (النكليوفيلية) بصفته من المركّبات العطرية.
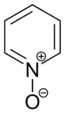
بسبب وجود ذرة النتروجين ذات الصفة الكهرسلبية في حلقة البيريدين فإنّ الجزيء يعاني نسبياً من نقص إلكتروني، ولذلك فهو لا يخضع لتفاعلات الاستبدال العطرية المحبة للإلكترونات (الإلكتروفيلية) بنفس السهولة التي تبرزها حلقة البنزين على سبيل المقارنة؛ وخاصّة إذا لم يتوفّر في مزيج التفاعل ما يسحب البروتونات المتحرّرة من التفاعل (إذ أنّ البيريدينيوم يعاني من نقص إلكتروني أكبر). بالمقابل؛ فإنّه وعلى العكس من البنزين ومشتقّاته فإنّ البيريدين أكثر عرضةً لتفاعلات الاستبدال المحبّة للنواة (النكليوفيلية)، ولتفاعلات فلزنة (إضافة فلز وتكوين مركب عضوي فلزي) على الحلقة باستخدام قواعد عضوية فلزّية قويّة.[67][68] يمكن تصنيف تفاعلية البيريدين حسب الكواشف الكيميائية المستخدمَة إلى ثلاث مجموعات كيميائية: مع الكواشف المحبّة للإلكترون (الإلكتروفيلية) يحدث تفاعل استبدال محب للإلكترون (إلكتروفيلي) بحيث يظهر البيريدين صفاته العطرية؛ أمّا مع الكواشف المحبّة للنواة (النكليوفيلية) فيتفاعل البيريدين في الموقعين 2 و 4 بشكل شبيه للإيمينات؛ أمّا التفاعل مع أحماض لويس فيؤدّي إلى حدوث تفاعل إضافة على ذرّة النتروجين بشكل شبيه بالأمينات الثالثية، مثل قابلية البيريدين للأكسدة الأمينية (تشكيل أكسيد الأمين).[69]
تحمل ذرّة النتروجين في البيريدين زوج غير رابط (زوج حرّ) من الإلكترونات، وبسبب أنّ هذا الزوج ليس جزءاً من عطرية حلقة البيريدين، يتّصف المركّب بصفات قاعدية، وذلك بشكل شبيه بالأمينات الثالثية. تبلغ قيمة ثابت تفكّك pKa الحمض المرافق (كاتيون البيريدينيوم) 5.25؛ حيث يمكن برتنة البيريدين بالتفاعل مع الأحماض لتشكيل كاتيون البيريدينيوم، وهو أيون متعدّد الذرّات، يكون فيه طول الروابط والزاويا بينها مماثلاً بشكل كبير للقيم في البيريدين؛[70] كما أنّ هذا الكاتيون متساو ٍإلكترونياً مع البنزين.
يعدّ البيريدين ربيطة ضعيفة نسبياً في تشكيل المعقّدات التناسقية مع أيونات الفلزّات الانتقالية؛ فعلى سبيل المثال يشكّل معقدات 1:1 مع النيكل الثنائي 2+Ni والنحاس الثنائي 2+Cu بحيث أن قيم ثابت التوازن الكيميائي log K1 تقع بين 1.9 و 2.6 على الترتيب.[71] درست أطياف الأشعّة تحت الحمراء لمعقّدات البيريدين بشكل مفصّل؛[72][73] كما لوحظ نمط التناسق 6η فقط في المعقّدات ذات الإعاقة الفراغية الكبيرة، بحيث تكون ذرة النتروجين محجوبة فيها.[74]
الخواص الجزيئية
للمركب نظام مترافق من ستّة إلكترونات باي (π) غير متموضعة وموجودة فوق الحلقة المستوية، وبذلك يصنّف البيريدين من المركّبات العطرية وفق قاعدة هوكل. على العكس من البنزين تكون الكثافة الإلكترونية غير موزّعة بانتظام فوق الحلقة، وبشكل يعكس التأثير الحثّي السلبي لذرّة النتروجين؛ ولذلك السبب فإنّ للبيريدين عزم ثنائي قطب، كما له طاقة ثباتية رنينية (117 كيلوجول.مول−1) أضعف من البنزين (150 كيلوجول.مول−1).[75] لطول الرابطة C–N في حلقة البيريدين قيمة مقدارها 137 بيكومتر، بالمقارنة مع 139 بيكومتر للرابطة C–C في المركّب نفسه،[74] وهي القيمة نفسها للرابطة كربون-كربون في البنزين.
لجميع الذرّات في جزيء البيريدين تهجين مداري من النمط 2sp، حيث تكون ذرّة النتروجين متضمّنة في النظام π العطري باستخدام مدارات p غير الهجينة، ويكون الزوج غير الرابط في المدار 2sp بحيث يبرز خارجاً عن الحلقة وفي نفس سوية الرابطة سيغما σ. ولذلك لا يشارك الزوج غير الرابط في النظام العطري، كما أنّ ذرّة النتروجين لا تبدي لذلك أيضاً أيّ تأثير ميزوميري إيجابي.
 مقارنة بين البيريدين مع حلقات عطرية غير متجانسة أخرى من حيث طول الرابطة والبنية الجزيئية. |
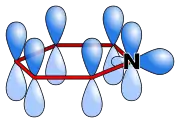 المدارات الإلكترونية في البيريدين |
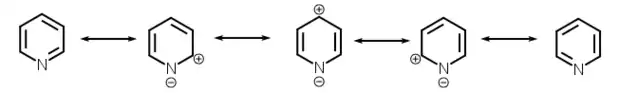 البنى الرنينية للبيريدين |
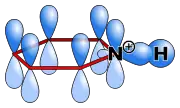 المدارات الإلكترونية في البيريدينيوم |
التفاعلات الكيميائية
يؤدّي انخفاض الكثافة الإلكترونية في حلقة البيريدين إلى تفضيل حدوث تفاعلات إضافة محبّة للنوى (نكليوفيلية) على ذرة النتروجين بالمقارنة مع تفاعلات الاستبدال المحبة للإلكترون (الإلكتروفيلية). يؤدّي تفاعل الإضافة المحبّ للنوى (النكليوفيلي) على ذرّة النتروجين إلى تعطيل الخواص العطرية وإعاقة حدوث الاستبدال المحب للإلكترون (الإلكتروفيلي). من جهة أخرى فإنّ تفاعلات الاستبدال العطرية المحبّة للنواة (النكليوفيلية) تحدث بشكل أسهل في البيريدين منه في البنزين.[54][67]
تفاعلات الاستبدال المحبّة للإلكترون (الإلكتروفيلية)
إنّ العديد من تفاعلات الاستبدال المحبّة للإلكترونات (الإلكتروفيلية) على البيريدين إما أنّها لا تحدث، أو تحدث بشكل جزئي، ولكن على الرغم من ذلك فإنّ الصفة العطرية غير المتجانسة للحلقة يمكن تفعيلها بإجراء إضافة مجموعة وظيفية مانحة للإلكترونات. ولكن على العموم فإنّ تفاعلات الألكلة والأسيلة (تفاعلات فريدل-كرافتس) المميّزة للبنزين لا تكون ناجحةً على البيريدين، وتؤول إلى تفاعل إضافة على ذرّة النتروجين. تحدث تفاعلات الاستبدال عادة على الكربون رقم 3، وهو أكثر ذرّة كربون غنىً بالإلكترونات في الحلقة، ولذلك تتمّ عليه تفاعلات الاستبدال.
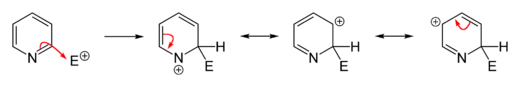
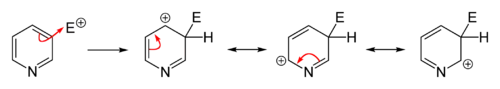

لا تكون تفاعلات الاستبدال في الموقعين 2 و 4 مفضّلة في الببريدين، لأنّها تؤدّي إلى تشكيل معقّدات σ غير المفضّلة طاقيّاً. ولكن على الرغم من ذلك يمكن تعزيز فرص حدوث الاستبدال في هذين الموقعين بإجراء استبدال إلكتروفيلي على N-أكسيد البيريدين أوّلاً، ثم نزع ذرة الأكسجين من على نتروجين الحلقة. إذ أنّ ارتباط الأكسجين بالنتروجين يقلّل من الكثافة الإلكترونية على ذرّة النتروجين، ممّا يعزّز من فرص حدوث استبدال في الموقعين 2 و 4. يمكن إزالة ذرّة الأكسجين بعدّة وسائل، أكثرها شيوعاً باستخدام مركّبات الفوسفور الثلاثي أو الكبريت الثنائي، والتي يسهل أكسدتها؛ فمثلاً يتأكسد ثلاثي فينيل الفوسفين وفق ما سبق إلى أكسيد ثلاثي فينيل الفوسفين.
تستلزم نترتة البيريدين بشكل مباشر وجود شروطٍ قاسية، وبالنهاية تعطي مردوداً ضعيفاً. بدلاً من ذلك يمكن الحصول على 3-نترو البيريدين من مفاعلة البيريدين مع خماسي أكسيد ثنائي النتروجين بوجود الصوديوم.[76][77][78] كما يمكن إجراء عملية النترتة باستخدام كاشف رباعي فلوروبورات النترونيوم (NO2BF4) على 6،2-ثنائي برومو البيريدين، ثمّ بإزالة ذرّات البروم.[79][80] أمّا السلفنة المباشرة للبيريدين فهي أصعب من النترتة المباشرة، ولكن بالرغم من ذلك فإنّه من الممكن الحصول على بيريدين-3-حمض السلفونيك بمردود مقبول من غلي البيريدين في فائض من حمض الكبريتيك عند 230 °س.[81] إنّ التفاعل مع مجموعة SO3 تسهّل من إضافة الكبريت إلى ذرّة النتروجين، وخاصّة في وجود حفّاز من كبريتات الزئبق الثنائي.[67][82]
على العكس من تفاعلي النترتة والسلفنة فإنّ تفاعل الهلجنة المباشرة يتم بشكل جيّد؛ إذ أنّ تفاعل البيريدين مع البروم الجزيئي في حمض الكبريتيك عند الدرجة 130 °س يعطي 3-برومو البيريدين بشكل فوري، ويكون مردود التفاعل في هذه الحالة أكبر من تفاعل الكلورة المباشر باستخدام الكلور الجزيئي في وجود حفّاز من كلوريد الألومنيوم عند الدرجة 100 °س. يمكن الحصول على 2-برومو البيريدين و 2-كلورو البيريدين من التفاعل المباشر مع الهالوجين الموافق بوجود حفّاز من كلوريد البالاديوم الثنائي.[83]
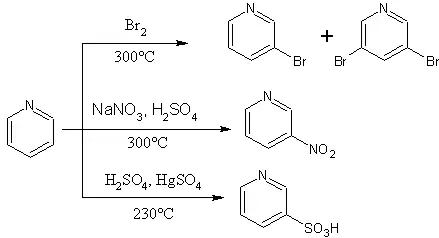
تفاعلات الاستبدال المحبّة للنواة (النكليوفيلية)
يسهل حدوث مثل هذه التفاعلات على حلقة البيريدين على العكس من البنزين، ويعود ذلك إلى انخفاض الكثافة الإلكترونية بسبب وجود ذرّة النتروجين. تتضمّن هذه التفاعلات حدوث استبدال مع حذف أيون هيدريد مع تشكّل مركّبات وسطية لها تشكيل الأراين، وغالباً ما تتمّ على الموقعين 2 و 4.[67][68]
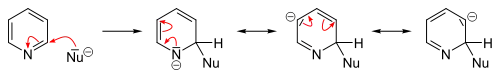
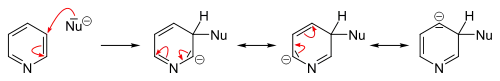

تحدث تفاعلات الاستبدال المحبّة للنوى بشكل أسهل مع مشتقّات البيريدين ذات المجموعات المغادرة مثل البروم أو الكلور أو الفلور أو حمض السلفونيك. تتضمّن الكواشف المحبّة للنواة (النكليوفيلة) كلّاً من الألكوكسيد والثيولات والأمينات والأمونياك.[84] على العموم، فإنّ أيون الهيدريد مجموعة مغادرة ضعيفة، ولا يغادر إلّا في بعض التفاعلات الحلقية غير المتجانسة، وتلك تتضمّن تفاعل تشيشيبابين، والذي يعطي مشتقات البيريدين الأمينية على الموقع 2. ولذلك الغرض يستخدم أميد الصوديوم كاشفاً محبّاً للنواة للحصول على 2-أمينو البيريدين. يتحرّر أيون الهيدريد في هذا التفاعل ويتّحدّ مع بروتون من مجموعة أمين متوفّرة في الوسط ليشكّل جزيء هيدروجين.[68][85]
التفاعلات الجذرية
يخضع البيريدين إلى تفاعلات جذرية، والتي تكون مسؤولة مثلاً عن حدوث ديمرة في وجود حفّاز من الصوديوم الفلزّي أو نيكل راني إلى 4،4'-ثنائي بيريدين،[86] أو 2،2'-ثنائي بيريدين؛[87] وهي مركبات طليعية مهمّة في الصناعة الكيميائية. من التفاعلات الجذرية الأخرى للبيريدين تفاعل مينيشي، والذي يعطي 2-رابعي بوتيل البيريدين من تفاعل البيريدين مع حمض البيفاليك ونترات الفضة والأمونياك في حمض الكبريتيك بمردود 97%.[67]
التفاعلات على ذرة النتروجين
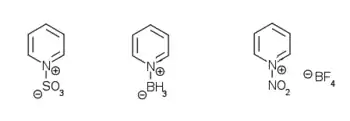
تسهل إضافة أحماض لويس إلى ذرّة النتروجين في البيريدين، حيث تتشكّل مركّبات البيريدينيوم الموافقة. إذ يؤدي التفاعل مثلاُ مع هاليدات الألكيل إلى ألكلة ذرّة النتروجين، وهذا يؤدّي إلى تشكّل شحنةٍ موجبةٍ في الحلقة، والتي تزيد من قابلية البيريدين إلى حدوث تفاعلات الأكسدة والاختزال. يستخدم تفاعل زينكه مثلاً من أجل الحصول على مركّبات البيريدينيوم وفق آلية جذرية.
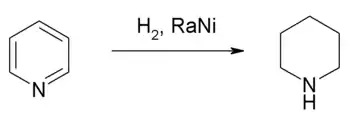
الأكسدة والاختزال
يمكن اختزال البيريدين إلى البيبريدين، وهو الشكل المختزَل المهدرَج من البيريدين، باستخدام غاز الهيدروجين بوجود حفّاز نيكل راني.[88] يعدّ هذا التفاعل ناشراً للحرارة، ويحرّر طاقة مقدارها 193.8 كيلوجول/مول،[89] وهي أقلّ بقليلٍ من الطاقة المنتشرة عن هدرجة البنزين (205.3 كيلوجول/مول).[89]
يستحصل على مشتقّات البيريدين المهدرجة جزئياً تحت شروط معتدلة. على سبيل المثال، يعطي الاختزال باستخدام هيدريد ألومنيوم الليثيوم مزيجاً من 4،1-ثنائي هيدرو البيريدين و 2،1-ثنائي هيدرو البيريدين و 5،2-ثنائي هيدرو البيريدين.[90] يمكن الحصول على 4،1-ثنائي هيدرو البيريدين بشكل انتقائي باستخدام معقّدات عضوية فلزّية من المغنسيوم والزنك.[91] أمّا (4،3Δ)-رباعي هيدرو البيريدين فيحصل عليه من الاختزال الكهركيميائي للبيريدين.[92]
الاستخدامات

يمثّل البيريدين أحد المواد المهمّة في الصناعات الكيميائية حيث يستخدم في العديد منها مثل الصناعات الدوائية، وصناعة المبيدات، وصناعة المطّاط واللواصق؛ كما يستخدم في الاصطناع العضوي كمحلّ (مذيب) وكمادّة متفاعلة.[93] بلغ الإنتاج العالمي من هذه المادّة سنة 1989 حوالي 26 ألف طنّ؛[18] ثم لا لبث أن ازداد بشكل مطّرد منذ أوائل الألفية الثانية، بحيث أنّ سعة الإنتاج السنوي بلغت 30 ألف طن في الصين وحدها.[94]
يستخدم البيريدين في تحضير المبيدات بشكل رئيسي كمادّة أوّليّة طليعيّة لإنتاج مبيدات الأعشاب باراكوات وديكوات.[18] كما أنّ الخطوة الأولى في تحضير المبيد الحشري كلوربيريفوس تنطلق من كلورة البيريدين؛ وكذلك الأمر في تحضير مبيد الفطريات بيريثيون.[15] وفق تفاعل زينكه يدخل البيريدين في تحضير كلوريد سيتيل البيريدينيوم و كلوريد لوريل البيريدينيوم، واللّذان يستخدمان من ضمن المعقّمات في مستحضرات العناية بالفم والأسنان.[54]
يصنّف البيريدين من ضمن المذيبات العضوية القطبية القاعدية ذات التفاعلية الضعيفة، ويستخدم لذلك الغرض في عدد من التفاعلات الكيميائية مثل تكاثف كنوفيناغل.[15] يعدّ البيريدين ملائماً كمذيب بشكل خاص في تفاعلات نزع الهالوجين، حيث يتصرّف كقاعدة في تفاعلات الحذف ويرتبط مع هاليد الهيدروجين الناتج ليشكل ملح بيريدينيوم الموافق؛ وكذلك الأمر في تفاعلات التكاثف.[96]

كقاعدة يستخدم البيريدين أحياناً في معايرة كارل-فيشر، ولكنّه غالباً ما يستخدم الإيميدازول عوضاً عنه، لأنّ الأخير ألطف رائحةً.[97] يستخدم البيريدين من ضمن المذيبات في صناعة الأصبغة والمطّاط؛[98] وكذلك الأمر في صناعة النسيج لتحسين سعة التشبيك في القطن.[54] في استعمال آخر يضاف البيريدين إلى الإيثانول لتغيير مذاقه وجعله غير ملائماً للشرب؛[54] وتقع قيمة عتبة الكشف عن البيريدين في المحاليل بين 1 - 3 ميلي مول/اللتر (بين 79–237 مغ/ل).[99]
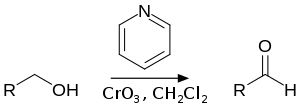
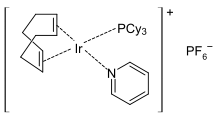
يستخدم البيريدين كمادّة أوّليّة طليعية في تحضير عدد من المركّبات ذات الأهمية في الصناعة؛ فتؤدّي هدرجته مثلاً إلى الحصول على بيبريدين، وهو وحدة بناء اصطناعية مهمة. تتمّ عملية الهدرجة باستخدام حفّازات من النيكل أو الكوبالت أو الروثينيوم عند درجات حرارة مرتفعة.[100] كما يستخدم في تحضير 4-ثنائي ميثيل أمينو البيريدينيوم (DMAP)، والذي يعدّ من المذيبات الفعّالة.
انطلاقاً من البيريدين طوّر إلياس جيمس خوري مع وليام ساغز سنة 1975 مركّب كلوروكرومات البيريدينيوم، والذي يستخدم في أكسدة الكحولات الأوّلية والثانوية إلى الألدهيدات والكيتونات على الترتيب.[101] يحصل على المركّب من إضافة البيريدين إلى محلول من حمض الكروميك وحمض الهيدروكلوريك المركّز:
يعدّ كاشف كورنفورث (ثنائي كرومات البيريدينيوم)،[102] وكاشف كولنز (مزيج معقّد من ثلاثي أكسيد الكروم مع البيريدين في ثنائي كلورو الميثان)، [103][104] من ضمن الكواشف المستحصلة من البيريدين ومركّبات الكروم، والتي تستخدم بشكل أساسي في الأكسدة، إلّا أنّ استخدامها انخفض بشكل كبير بعد حقبة سبعينات وثمانينات القرن العشرين لأنّها سامّة ومسرطنة.[105]
يستخدم البيريدين بشكل واسع من ضمن الربيطات في كيمياء المعقدات التناسقية، وكذلك الأمر مع ثنائي البيريدين (بيبيريدين) وثلاثي بيريدين (تيربيريدين). عندما تكون ربيطة البيريدين جزءاً من المعقّد التناسقي، فإنه يسهل استبدالها بقاعدة لويس قوية. تستخدم هذه الخاصّة في تحفيز عملية البلمرة،[106][107] وفي تفاعلات الهدرجة باستخدام حفاز كرابتري على سبيل المثال.[108]
المخاطر
للبيريدين نقطة وميض تبلغ 17 °س، بالتالي له قابلية للاشتعال مرتفعة؛ وتبلغ درجة الاشتعال 550 °س، كما أن مزيج نسبته 1.7–10 % حجماً مع الهواء هو مزيج انفجاري. يبدأ التفكّك الحراري عند 490 °س، حيث ينتج ثنائي بيريدين (بشكل أساسي 2،2'-ثنائي بيريدين، وبشكل أقل 3،2'-ثنائي بيريدين و 4،2'-ثنائي بيريدين) وكذلك أكاسيد النتروجين وأحادي أكسيد الكربون.[58] ينحلّ البيريدين بسهولة في الماء، وله تأثير سلبي ومضرّ على الحيوانات والنباتات في الأوساط المائية.[109] تبلغ قيمة حد العتبة للبيريدين 15-30 جزء في المليون (ppm) في أغلب البلدان منذ تسعينات القرن العشرين؛[15] والتي انخفضت إلى 5 ppm في العقد الأول من الألفية الثانية.[110]
البيريدين ضارّ ومؤذٍ لجسم الإنسان في حال الاستنشاق والتناول والامتصاص عن طريق الجلد.[111] من آثار التسمّم بالبيريدين حدوث الأعراض التالية: الدوار والصداع والترنّح والغثيان ونقص الشهية؛ كما يمكن أن تتطوّر الأمور إلى ألم معوي، ووذمة الرئة وإغماء.[112] سُجّلت حادثة وفاة أحدهم بعد تجرّعه نصف كأس من البيريدين.[15] إنّ أقلّ جرعة مميتة للإنسان معروفة للبيريدين هي 500 مغ لكل كيلوغرام. عند الجرعات المرتفعة يكون للبيريدين تأثير مخدّر، وعندما تكون تراكيز الأبخرة فوق 3600 جزء في المليون ppm فإنّ ذلك يمثّل خطراً على الصحّة.[18] يمكن أن يكون للبيريدين آثار سلبية ثانوية من حيث السمّية العصبية والجينية.[15][58][113] وفق دراسة أجريت بين سنتي 1981 و 1983 من المعهد الوطني الأمريكي للسلامة والصحة المهنية فإن عدد الأفراد الذين كانوا على تماس مباشر مع البيريدين في عملهم كان حوالي 43 ألف أمريكي.[114]
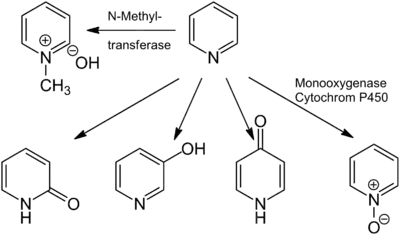
لا توجد أدلّة كافية تشير إلى كون البيريدين مسرطناً للإنسان؛ على الرغم من أن بعض الدراسات أشارت إلى إمكانية وجود آثار مسرطنة للبيريدين على الحيوانات.[112] تشير البيانات المتوفّرة أن احتواء مياه الشرب على البيريدين أدّت إلى تخفيض قابلية الحركة للنطاف عند الفئران في كافّة مستويات التعرّض للجرعات؛ كما زادت مدّة الدورة النزوية عند أعلى مستوى جرعة عند الجرذان.[112] إنّ الناتج الرئيسي لاستقلاب البيريدين هو N-ميثيل هيدروكسيد البيريدينيوم؛[58][113] وذلك بواسطة الإنزيم الناقل لمجموعة الميثيل على ذرّة النتروجين N-methyltransferase. من نواتج الاستقلاب أيضاً كل من N-أكسيد البيريدين ومركّبات هيدروكسي البيريدين المختلفة، والتي يحصل عليها بواسطة إنزيم مونوأكسجيناز. يتحلّل البيريدين بفعل البكتريا إلى الأمونياك وثنائي أكسيد الكربون؛[115] وفي تلك العملية تتحلّل حلقة البيريدين بشكل أسرع بالمقارنة مع البيكولين واللوتيدين و2-كلورو البيريدين وأمينو البيريدين؛[116] كما وجد أنّ عدداً من محلّلات البيريدين أظهرت تراكيز مرتفعة من ريبوفلافين.[117]
تحدث تأثيرات متبادلة (تآثرات) بين المركّبات الحلقية غير المتجانسة الحاوية على النتروجين متضمّنةً البيريدين مع التربة، عن طريق آليات متعدّدة معتمدة على pH الوسط، بما فيها حدوث تجزئة في المواد العضوية الترابية والتبادل الأيوني وحدوث تفاعلات تعقيد على السطح.[118] إن حدوث امتزاز على السطوح في الحالات المذكورة يقلّل من التوافر الحيوي لمركّبات البيريدين للمحلّلات المكروبية والكائنات الحية الأخرى، وبالتالي يقلّل من معدّلات التحلّل ويزيد من السمّية البيئية.[119] تتحرّر كمّيّات قليلة من البيريدين إلى الوسط المحيط البيئي من العمليات الصناعية مثل صناعة الفولاذ،[120] بالإضافة إلى الصخر الزيتي وتغويز الفحم والتكويك وترميد النفايات.[15] يمكن أن يصل تركيز البيريدين في الغلاف الجوي عند منشآت الصخر الزيتي إلى 13 ميكروغرام/م3؛[121] كما أنّ تراكيز البيريدين في المياه الجوفية بالقرب من محطّات تغويز الفحم وصلت إلى 53 ميكروغرام/م3.[122]
المراجع
- Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book)، Cambridge: The Royal Society of Chemistry، 2014، ص. 141، doi:10.1039/9781849733069-FP001، ISBN 978-0-85404-182-4.
- العنوان : PYRIDINE — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/1049 — تاريخ الاطلاع: 18 نوفمبر 2016 — الرخصة: محتوى حر
- مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/1049
- "Pyridine"، Encyclopædia Britannica Online، مؤرشف من الأصل في 24 ديسمبر 2014.
- "Iodine Solution (0.02 M in THF/pyridine/H2O 70:20:10)"، Sigma-Aldrich، مؤرشف من الأصل في 04 مارس 2020، اطلع عليه بتاريخ 28 نوفمبر 2011.
- Weissberger, A.؛ Klingberg, A.؛ Barnes, R. A.؛ Brody, F.؛ Ruby, P.R. (1960)، Pyridine and its Derivatives، New York: Interscience، ج. 1.
- Anderson, T. (1849). Transactions of the Royal Society of Edinburgh. 16: 123.
- Anderson, T. (1849)، "Producte der trocknen Destillation thierischer Materien" [Products of the dry distillation of animal matter]، Annalen der Chemie und Pharmacie، 70: 32، doi:10.1002/jlac.18490700105.
- Anderson, T. (1851)، "Ueber die Producte der trocknen Destillation thierischer Materien" [On the products of dry distillation of animal matter]، Annalen der Chemie und Pharmacie، 80: 44، doi:10.1002/jlac.18510800104.
- Körner, W. (1869). Giornale academico di Palermo. 5.
- Dewar, J. (1871). Chemical News. 23: 38.
- Rocke, Alan J. (1988)، "Koerner, Dewar and the Structure of Pyridine"، Bulletin for the History of Chemistry، 2: 4، مؤرشف من الأصل في 24 سبتمبر 2018.

- Ladenburg, Albert، Lectures on the history of the development of chemistry since the time of Lavoisier. (PDF)، ص. 283–287، مؤرشف من الأصل (PDF) في 20 سبتمبر 2018.

- Bansal, Raj K. (1999)، Heterocyclic Chemistry، ص. 216، ISBN 81-224-1212-2، مؤرشف من الأصل في 9 يناير 2020.
- "Pyridine" (PDF)، IARC Monographs 77، Washington DC: OSHA، 1985، مؤرشف من الأصل (PDF) في 4 مارس 2016.
{{استشهاد ويب}}: غير مسموح بالترميز المائل أو الغامق في:|عمل=(مساعدة) - "A. Henninger, aus Paris. 12. April 1877"، Berichte der deutschen chemischen Gesellschaft (Correspondence)، 10: 727، 1877، doi:10.1002/cber.187701001202.
- Chichibabin, A. E. (1924)، "Über Kondensation der Aldehyde mit Ammoniak zu Pyridinebasen" [On condensation of aldehydes with ammonia to make pyridines]، Journal für Praktische Chemie، 107: 122، doi:10.1002/prac.19241070110، مؤرشف من الأصل في 20 سبتمبر 2018.
- Shimizu, S.؛ Watanabe, N.؛ Kataoka, T.؛ Shoji, T.؛ Abe, N.؛ Morishita, S.؛ Ichimura, H. (2005)، "Pyridine and Pyridine Derivatives"، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش، doi:10.1002/14356007.a22_399
- Powell, W. H. (1983)، "Revision of the extended Hantzsch-Widman system of nomenclature for hetero mono-cycles" (PDF)، Pure and Applied Chemistry، 55 (2): 409–416، doi:10.1351/pac198855020409، مؤرشف من الأصل (PDF) في 20 سبتمبر 2018.
- Hellwinkel, D. (1998)، Die systematische Nomenklatur der Organischen Chemie (ط. 4th)، Berlin: Springer، ص. 45، ISBN 3-540-63221-2.
- Burdock, G. A., المحرر (1995)، Fenaroli's Handbook of Flavor Ingredients (ط. 3rd)، Boca Raton: CRC Press، ج. 2، ISBN 0-8493-2710-5.
- Täufel, A.؛ Ternes, W.؛ Tunger, L.؛ Zobel, M. (2005)، Lebensmittel-Lexikon (ط. 4th)، Behr، ص. 450، ISBN 3-89947-165-2.
- Tang, Jian؛ Jin, Qi Zhang؛ Shen, Guo Hui؛ Ho, Chi Tang؛ Chang, Stephen S. (1983)، "Isolation and identification of volatile compounds from fried chicken"، Journal of Agricultural and Food Chemistry، 31 (6): 1287، doi:10.1021/jf00120a035.
- Shibamoto, Takayuki؛ Kamiya, Yoko؛ Mihara, Satoru (1981)، "Isolation and identification of volatile compounds in cooked meat: sukiyaki"، Journal of Agricultural and Food Chemistry، 29: 57، doi:10.1021/jf00103a015.
- Aeschbacher, HU؛ Wolleb, U؛ Löliger, J؛ Spadone, JC؛ Liardon, R (1989)، "Contribution of coffee aroma constituents to the mutagenicity of coffee"، Food and Chemical Toxicology، 27 (4): 227–232، doi:10.1016/0278-6915(89)90160-9، PMID 2659457.
- Buttery, Ron G.؛ Seifert, Richard M.؛ Guadagni, Dante G.؛ Ling, Louisa C. (1971)، "Characterization of Volatile Pyrazine and Pyridine Components of Potato Chips"، Journal of Agricultural and Food Chemistry، Washington, DC: ACS، 19 (5): 969–971، doi:10.1021/jf60177a020.
- Ho, Chi Tang؛ Lee, Ken N.؛ Jin, Qi Zhang (1983)، "Isolation and identification of volatile flavor compounds in fried bacon"، Journal of Agricultural and Food Chemistry، 31 (2): 336، doi:10.1021/jf00116a038.
- Dumont, Jean Pierre؛ Adda, Jacques (1978)، "Occurrence of sesquiterpene in mountain cheese volatiles"، Journal of Agricultural and Food Chemistry، 26 (2): 364، doi:10.1021/jf60216a037.
- Vitzthum, Otto G.؛ Werkhoff, Peter؛ Hubert, Peter (1975)، "New volatile constituents of black tea flavor"، Journal of Agricultural and Food Chemistry، 23 (5): 999، doi:10.1021/jf60201a032.
- Täufel, A.؛ Ternes, W.؛ Tunger, L.؛ Zobel, M. (2005)، Lebensmittel-Lexikon (ط. 4th)، Behr، ص. 226، ISBN 3-89947-165-2.
- Labows, John N., Jr.؛ Warren, Craig B., (1981)، "Odorants as Chemical Messengers"، في Moskowitz, Howard R. (المحرر)، Odor Quality and Chemical Structure، Washington, DC: American Chemical Society، ص. 195–210، doi:10.1021/bk-1981-0148.fw001، ISBN 9780841206076.
{{استشهاد بكتاب}}: صيانة CS1: extra punctuation (link) - Kostelc, J. G.؛ Preti, G.؛ Nelson, P. R.؛ Brauner, L.؛ Baehni, P. (1984)، "Oral Odors in Early Experimental Gingivitis"، Journal of Periodontology Research، 19 (3): 303–312، doi:10.1111/j.1600-0765.1984.tb00821.x، PMID 6235346.
- M. Curvall, C. R. Enzell, B. Pettersson: An evaluation of the utility of four in vitro short term tests for predicting the cytotoxicity of individual compounds derived from tobacco smoke, in: Cell Biology and Toxicology, 1984, 1, S. 173–193; دُوِي:10.1007/BF00125573.
- I. Schmeltz, D. Hoffmann: Nitrogen-containing compounds in tobacco and tobacco smoke, in: Chemical Reviews, 1977, 77, S. 295–311; دُوِي:10.1021/cr60307a001.
- Gossauer, A. (2006)، Struktur und Reaktivität der Biomoleküle، Weinheim: Wiley-VCH، ص. 488، ISBN 3-906390-29-2.
- Frank, R. L.؛ Seven, R. P. (1949)، "Pyridines. IV. A Study of the Chichibabin Synthesis"، Journal of the American Chemical Society، 71 (8): 2629–2635، doi:10.1021/ja01176a008.
- DE patent 1917037, ICI, issued 1968
- JP patent 7039545, Nippon Kayaku, issued 1967
- BE patent 758201, Koei Chemicals, issued 1969
- Mensch, F. (1969). Erdöl Kohle Erdgas Petrochemie. 2: 67–71
- Hantzsch, A. (1881)، "Condensationsprodukte aus Aldehydammoniak und ketonartigen Verbindungen" [Condensation products from aldehyde ammonia and ketone-type compounds]، Berichte der deutschen chemischen Gesellschaft، 14 (2): 1637، doi:10.1002/cber.18810140214.
- Knoevenagel, E.؛ Fries, A. (1898)، "Synthesen in der Pyridinreihe. Ueber eine Erweiterung der Hantzsch'schen Dihydropyridinsynthese" [Syntheses in the pyridine series. On an extension of the Hantzsch dihydropyridine synthesis]، Berichte der deutschen chemischen Gesellschaft، 31: 761، doi:10.1002/cber.189803101157.
- Behr, A. (2008)، Angewandte homogene Katalyse، Weinheim: Wiley-VCH، ص. 722، ISBN 3-527-31666-3.
- Kroehnke, Fritz (1976)، "The Specific Synthesis of Pyridines and Oligopyridines"، Synthesis، 1976 (1): 1–24، doi:10.1055/s-1976-23941..
- Skell, P. S.؛ Sandler, R. S. (1958)، "Reactions of 1,1-Dihalocyclopropanes with Electrophilic Reagents. Synthetic Route for Inserting a Carbon Atom Between the Atoms of a Double Bond"، Journal of the American Chemical Society، 80 (8): 2024، doi:10.1021/ja01541a070.
- Jones, R. L.؛ Rees, C. W. (1969)، "Mechanism of heterocyclic ring expansions. Part III. Reaction of pyrroles with dichlorocarbene"، Journal of the Chemical Society C: Organic (18): 2249، doi:10.1039/J39690002249.
- Gambacorta, A.؛ Nicoletti, R.؛ Cerrini, S.؛ Fedeli, W.؛ Gavuzzo, E. (1978)، "Trapping and structure determination of an intermediate in the reaction between 2-methyl-5-t-butylpyrrole and dichlorocarbene"، Tetrahedron Letters، 19 (27): 2439، doi:10.1016/S0040-4039(01)94795-1.
- "Gattermann–Skita"، Institute of Chemistry, Skopje، مؤرشف من الأصل في 16 يونيو 2006.
- Gattermann, L.؛ Skita, A. (1916)، "Eine Synthese von Pyridin-Derivaten" [A synthesis of pyridine derivatives]، Chemische Berichte، 49 (1): 494–501، doi:10.1002/cber.19160490155.
- Tarr, J. B.؛ Arditti, J. (1982)، "Niacin Biosynthesis in Seedlings of Zea mays"، Plant Physiology، 69 (3): 553–556، doi:10.1104/pp.69.3.553، PMC 426252، PMID 16662247.
- Lide, p. 3-448
- Mootz, D. (1981)، "Crystal structures of pyridine and pyridine trihydrate"، The Journal of Chemical Physics، 75 (3): 1517، Bibcode:1981JChPh..75.1517M، doi:10.1063/1.442204.
- Lide, p. 3-673
- RÖMPP Online – Version 3.5، Thieme Chemistry، Stuttgart: Georg Thieme، 2009.
- Lide, p. 5-28
- Lide, p. 6-211
- Lide, p. 6-221
- Record of Pyridine in the GESTIS Substance Database from the IFA
- Majer, V.؛ Svoboda, V. (1985)، Enthalpies of Vaporization of Organic Compounds: A Critical Review and Data Compilation، Oxford: Blackwell Scientific Publications، ISBN 0-632-01529-2.
- Domalski, Eugene S.؛ Hearing, Elizabeth D. (1996)، "Heat Capacities and Entropies of Organic Compounds in the Condensed Phase"، Journal of Physical and Chemical Reference Data، 25: 1، Bibcode:1996JPCRD..25....1D، doi:10.1063/1.555985.
- Cox, E. (1958)، "Crystal Structure of Benzene"، Reviews of Modern Physics، 30: 159، Bibcode:1958RvMP...30..159C، doi:10.1103/RevModPhys.30.159.
- Lide, p. 6-67
- McCullough, J. P.؛ Douslin, D. R.؛ Messerly, J. F.؛ Hossenlopp, I. A.؛ Kincheloe, T. C.؛ Waddington, Guy (1957)، "Pyridine: Experimental and Calculated Chemical Thermodynamic Properties between 0 and 1500 °K.; a Revised Vibrational Assignment"، Journal of the American Chemical Society، 79 (16): 4289، doi:10.1021/ja01573a014.
- Joule, p. 14
- Joule, p. 16
- "Pyridine hydrochloride MSDS" (PDF)، Alfa Aesar، مؤرشف من الأصل (PDF) في 18 أكتوبر 2014، اطلع عليه بتاريخ 26 يونيو 2010.
- Joule, pp. 125–141
- Davies, D. T. (1992)، Aromatic Heterocyclic Chemistry، Oxford University Press، ISBN 0-19-855660-8.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=/|تاريخ=mismatch (مساعدة) - Milcent, R.؛ Chau, F. (2002)، Chimie organique hétérocyclique: Structures fondamentales، EDP Sciences، ص. 241–282، ISBN 2-86883-583-X.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|سنة=/|تاريخ=mismatch (مساعدة) - Krygowski, T. M.؛ Szatyowicz, H.؛ Zachara, J. E. (2005)، "How H-bonding Modifies Molecular Structure and π-Electron Delocalization in the Ring of Pyridine/Pyridinium Derivatives Involved in H-Bond Complexation"، J. Org. Chem.، 70 (22): 8859–8865، doi:10.1021/jo051354h، PMID 16238319.
- "IUPAC SC-Database: A comprehensive database of published data on equilibrium constants of metal complexes and ligands"، مؤرشف من الأصل في 8 أكتوبر 2018.
- Nakamoto, K. (1997)، Infrared and Raman spectra of Inorganic and Coordination compounds، Part A (ط. 5th)، Wiley، ISBN 0-471-16394-5.
- Nakamoto, K.، Infrared and Raman spectra of Inorganic and Coordination compounds، Part B (ط. 5th)، ص. 24، ISBN 0-471-16392-9.
- Elschenbroich, C. (2008)، Organometallchemie (ط. 6th)، Vieweg & Teubner، ص. 524–525، ISBN 3-8351-0167-6.
- Joule, p. 7
- Joule, p. 129
- Bakke, Jan M.؛ Hegbom, Ingrid؛ Verne, Hans Peter؛ Weidlein, Johann؛ Schnöckel, Hansgeorg؛ Paulsen, Gudrun B.؛ Nielsen, Ruby I.؛ Olsen, Carl E.؛ Pedersen, Christian؛ Stidsen, Carsten E. (1994)، "Dinitrogen Pentoxide-Sulfur Dioxide, a New nitrate ion system"، Acta Chemica Scandinavica، 48: 181، doi:10.3891/acta.chem.scand.48-0181.
- Ono, Noboru؛ Murashima, Takashi؛ Nishi, Keiji؛ Nakamoto, Ken-Ichi؛ Kato, Atsushi؛ Tamai, Ryuji؛ Uno, Hidemitsu (2002)، "Preparation of Novel Heteroisoindoles from nitropyridines and Nitropyridones"، Heterocycles، 58: 301، doi:10.3987/COM-02-S(M)22.
- Duffy, Joseph L.؛ Laali, Kenneth K. (1991)، "Aprotic Nitration (NO2+BF4−) of 2-Halo- and 2,6-Dihalopyridines and Transfer-Nitration Chemistry of Their N-Nitropyridinium Cations"، The Journal of Organic Chemistry، 56 (9): 3006، doi:10.1021/jo00009a015.
- Joule, p. 126
- Gabriel, S. (1882)، "Note on nicotinic acid from pyridine"، Berichte der deutschen chemischen Gesellschaft، 15: 834، doi:10.1002/cber.188201501180.
- Möller, Ernst Friedrich؛ Birkofer, Leonhard (1942)، "Konstitutionsspezifität der Nicotinsäure als Wuchsstoff bei Proteus vulgaris und Streptobacterium plantarum" [Constitutional specificity of nicotinic acid as a growth factor in Proteus vulgaris and Streptobacterium plantarum]، Berichte der deutschen chemischen Gesellschaft (A and B Series)، 75 (9): 1108، doi:10.1002/cber.19420750912.
- Joule, p. 130
- Joule, p. 133
- Shreve, R. Norris؛ Riechers, E. H.؛ Rubenkoenig, Harry؛ Goodman, A. H. (1940)، "Amination in the Heterocyclic Series by Sodium amide"، Industrial & Engineering Chemistry، 32 (2): 173، doi:10.1021/ie50362a008.
- Badger, G؛ Sasse, W (1963)، "The Action of Metal Catalysts on Pyridines"، Advances in Heterocyclic Chemistry، Advances in Heterocyclic Chemistry، ج. 2، ص. 179، doi:10.1016/S0065-2725(08)60749-7، ISBN 9780120206025.
- Sasse, W. H. F. (1966)، "2,2′-bipyridine" (PDF)، Organic Syntheses، 46: 5–8، doi:10.1002/0471264180.os046.02، ISBN 0471264229، مؤرشف من الأصل (PDF) في 8 أكتوبر 2012، اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Burrows, George H.؛ King, Louis A. (1935)، "The Free Energy Change that Accompanies Hydrogenation of pyridines to piperidines"، Journal of the American Chemical Society، 57 (10): 1789، doi:10.1021/ja01313a011.
- Cox, J. D.؛ Pilcher, G. (1970)، "Thermochemistry of Organic and Organometallic Compounds"، New York: Academic Press، : 1–636، ISBN 0-12-194350-X.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة) - Tanner, Dennis D.؛ Yang, Chi Ming (1993)، "On the structure and mechanism of formation of the Lansbury reagent, lithium tetrakis(N-dihydropyridyl) aluminate"، The Journal of Organic Chemistry، 58 (7): 1840، doi:10.1021/jo00059a041.
- De Koning, A.؛ Budzelaar, P. H. M.؛ Boersma, J.؛ Van Der Kerk, G. J. M. (1980)، "Specific and selective reduction of aromatic nitrogen heterocycles with the bis-pyridine complexes of bis(1,4-dihydro-1-pyridyl)zinc and bis(1,4-dihydro-1-pyridyl)magnesium"، Journal of Organometallic Chemistry، 199 (2): 153، doi:10.1016/S0022-328X(00)83849-8.
- Ferles, M. (1959). Collection of Czechoslovak Chemical Communications. 24: 1029–1033.
- Sherman, A. R. “Pyridine” in e-EROS (Encyclopedia of Reagents for Organic Synthesis) (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. دُوِي:10.1002/047084289X.rp280 Article Online Posting Date: April 15, 2001.
- "Pyridine's Development in China"، AgroChemEx، 11 مايو 2010، مؤرشف من الأصل في 20 سبتمبر 2018.
- "Environmental and health criteria for paraquat and diquat"، Geneva: World Health Organization، 1984، مؤرشف من الأصل في 6 أكتوبر 2018.
- Sherman, A. R. (2004)، "Pyridine"، في Paquette, L. (المحرر)، Encyclopedia of Reagents for Organic Synthesis، e-EROS (Encyclopedia of Reagents for Organic Synthesis)، New York: J. Wiley & Sons، doi:10.1002/047084289X.rp280، ISBN 0471936235.
- "Wasserbestimmung mit Karl-Fischer-Titration" [Water analysis with the Karl Fischer titration] (PDF)، Jena University، مؤرشف من الأصل (PDF) في 18 مارس 2020.
- Terry, C. E.؛ Ryan, R. P.؛ Leffingwell, S. S.، Toxicology Desk Reference: The Toxic Exposure & Medical Monitoring Index: The Toxic Exposure and Medical Monitoring Index (ط. 5th)، Taylor & Francis، ص. 1062، ISBN 1-56032-795-2.
- Täufel, A.؛ Ternes, W.؛ Tunger, L.؛ Zobel, M. (2005)، Lebensmittel-Lexikon (ط. 4th)، Behr، ص. 218، ISBN 3-89947-165-2.
- Eller, K.؛ Henkes, E.؛ Rossbacher, R.؛ Hoke, H. (2005)، "Amines, aliphatic"، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش،
- Corey, E. J.؛ Suggs, W. (1975)، "Pyridinium Chlorochromate. An Efficient Reagent for Oxidation of Primary and Secondary Alcohols to Carbonyl Compounds"، Tetrahedron Letters، 16 (31): 2647–2650، doi:10.1016/S0040-4039(00)75204-X.
- Cornforth, R. H.؛ Cornforth, J. W.؛ Popjak, G. (1962)، "Preparation of R- and S-mevalonolactones"، Tetrahedron، 18 (12): 1351–1354، doi:10.1016/S0040-4020(01)99289-0.
- Collins, J. C.؛ Hess, W. W.؛ Frank, F. J. (1968)، "Dipyridine-chromium(VI) oxide oxidation of alcohols in dichloromethane"، Tetrahedron Lett.، 9 (30): 3363–3366، doi:10.1016/S0040-4039(00)89494-0.
- (1988)"Aldehydes from Primary Alcohols by Oxidation with Chromium Trioxide: Heptanal". Org. Synth.; Coll. Vol. 6: 644.
- Tojo, G.؛ Fernandez, M. (2006)، Oxidation of alcohols to aldehydes and ketones: a guide to current common practice، New York: Springer، ص. 28, 29, 86، ISBN 0-387-23607-4، مؤرشف من الأصل في 04 مارس 2020.
- Bamford, C. H.؛ Tipper, C. F. H (1980)، Comprehensive Chemical Kinetics: Non-radical Polymerisation، Amsterdam: Elsevier، ISBN 0-444-41252-2.
- Hopper, A. V. (2007)، Recent Developments in Polymer Research، Nova Science، ISBN 1-60021-346-4.
- Crabtree, Robert (1979)، "Iridium compounds in catalysis"، Accounts of Chemical Research، 12 (9): 331، doi:10.1021/ar50141a005.
- "Database of the (EPA)"، U.S. Environmental Protection Agency، مؤرشف من الأصل في 21 مارس 2019.
- "Pyridine MSDS" (PDF)، Alfa Aesar، مؤرشف من الأصل (PDF) في 3 أبريل 2015، اطلع عليه بتاريخ 03 يونيو 2010.
- Aylward, G (2008)، SI Chemical Data (ط. 6th)، ISBN 978-0-470-81638-7.
- International Agency for Research on Cancer (IARC) (22 أغسطس 2000)، "Pyridine Summary & Evaluation"، IARC Summaries & Evaluations، IPCS INCHEM، مؤرشف من الأصل في 2 أكتوبر 2018، اطلع عليه بتاريخ 17 يناير 2007.
- Bonnard, N.؛ Brondeau, M. T.؛ Miraval, S.؛ Pillière, F.؛ Protois, J. C.؛ Schneider, O.، "Pyridine" (PDF)، Fiche Toxicologique (باللغة الفرنسية)، INRS، مؤرشف من الأصل (PDF) في 20 سبتمبر 2018.
- National Occupational Exposure Survey 1981–83، Cincinnati, OH: Department of Health and Human Services, Public Health Service, Centers for Disease Control, National Institute for Occuptional Safety and Health.
- Sims, G. K.؛ O'Loughlin, E. J. (1989)، "Degradation of pyridines in the environment"، CRC Critical Reviews in Environmental Control، 19 (4): 309–340، doi:10.1080/10643388909388372.
- Sims, G. K.؛ Sommers, L.E. (1986)، "Biodegradation of pyridine derivatives in soil suspensions"، Environmental Toxicology and Chemistry، 5 (6): 503–509، doi:10.1002/etc.5620050601.
- Sims, G. K.؛ O'Loughlin, E.J. (1992)، "Riboflavin production during growth of Micrococcus luteus on pyridine"، Applied and Environmental Microbiology، 58 (10): 3423–3425، PMC 183117، PMID 16348793.
- Bi, E.؛ Schmidt, T. C.؛ Haderlein, S. B. (2006)، "Sorption of heterocyclic organic compounds to reference soils: column studies for process identification"، Environ Sci Technol، 40 (19): 5962–5970، doi:10.1021/es060470e، PMID 17051786.
- O'Loughlin, E. J؛ Traina, S. J.؛ Sims, G. K. (2000)، "Effects of sorption on the biodegradation of 2-methylpyridine in aqueous suspensions of reference clay minerals"، Environmental Toxicology and Chemistry، 19 (9): 2168–2174، doi:10.1002/etc.5620190904.
- Junk, G. A.؛ Ford, C. S. (1980)، "A review of organic emissions from selected combustion processes"، Chemosphere، 9 (4): 187، doi:10.1016/0045-6535(80)90079-X.
- Hawthorne, Steven B.؛ Sievers, Robert E. (1984)، "Emissions of organic air pollutants from shale oil wastewaters"، Environmental Science & Technology، 18 (6): 483، Bibcode:1984EnST...18..483H، doi:10.1021/es00124a016.
- Stuermer, Daniel H.؛ Ng, Douglas J.؛ Morris, Clarence J. (1982)، "Organic contaminants in groundwater near to underground coal gasification site in northeastern Wyoming"، Environmental Science & Technology، 16 (9): 582، Bibcode:1982EnST...16..582S، doi:10.1021/es00103a009.
المصادر
- Joule, J. A.؛ Mills, K. (2010)، Heterocyclic Chemistry (ط. الخامسة)، Chichester: Blackwell Publishing، ISBN 1-4051-3300-7، مؤرشف من الأصل في 04 مارس 2020.
- Lide, D. R., المحرر (2009)، Handbook of Chemistry and Physics (ط. التسعون)، Boca Raton: CRC Press، ISBN 978-1-4200-9084-0.
وصلات خارجية
- اصطناع وخواص البيريدين
- عن السلامة الكيميائية للبيريدين
- السلامة والمخاطر للبيريدين
- طرق اصطناع البيريدين
- بوابة الكيمياء
- بوابة الكيمياء الحيوية
