نورإبينفرين
نُورإِبينِفْرِين(1) أو نُورأدرينالين(2) مادّةٌ كيميائية عضوية من عائلة الكاتيكولامينات، والتي يصنّف دورها الوظيفي ضمن الهرمونات والناقلات العصبية في الدماغ والجسم. يُعتَبر نورإبينفرين أيضًا اسم دواءٍ دوليٍ غيرُ مسجّل الملكية.[3] بعيدًا عن الاسم المُستعمل للمادّة نفسها، إلّا أنّهُ يُشار إلى أجزاء الجسم التي تُنتجها أو تتأثّر بها باسم «نُورأَدْريني».[4]
| نورإبينفرين | |
|---|---|
 | |
 نورإبينفرين | |
| الاسم النظامي | |
| (R)-4-(2-amino-1-hydroxyethyl)benzene-1,2-diol | |
| يعالج | |
| اعتبارات علاجية | |
| بيانات دوائية | |
| استقلاب (أيض) الدواء | MAO-A؛ COMT |
| بيانات فيزيولوجية | |
| النسيج الحيوي المصدري | الموضع الأزرق؛ الجهاز العصبي الودّي؛ لب الغدة الكظرية |
| النسيج الحيوي المستهدف | كافة الأجهزة |
| المستقبلات | α1، α2، β1، β3 |
| الناهضات | المحاكيات الودية، كلونيدين، إيزوبرينالين |
| المناهضات (الضادّات) | مضادّات الاكتئاب ثلاثية الحلقات، محصرات بيتا، مضادّات الذهان |
| المركب الطليعي (السلف) | دوبامين |
| الاصطناع الحيوي | بيتا-هيدروكسيلاز الدوبامين |
| الاستقلاب (الأيض) | MAO-A؛ COMT |
| معرّفات | |
| CAS | 51-41-2 |
| ك ع ت | C01CA03 |
| بوب كيم | CID 439260 |
| IUPHAR | 505 |
| ECHA InfoCard ID | 100.000.088 |
| درغ بنك | DB00368 |
| كيم سبايدر | 388394 |
| المكون الفريد | X4W3ENH1CV |
| كيوتو | C00547 |
| ChEMBL | CHEMBL1437 |
| بيانات كيميائية | |
| الصيغة الكيميائية | C8H11NO3 |
تُعتَبر الوظيفة العامّة للنورإبينفرين هي استنفارُ الدماغ والجسم للعمل. يكون إفرازُ النورإبينفرين مُنخفضًا أثناء النوم، ويرتفعُ أثناء اليقظة، ويصل إلى مستوياتٍ أعلى بكثيرٍ أثناء حالات التوتّر أو الخطر، في ما يُعرف باستجابة الكرّ أو الفرّ.[5] يعمل النورإبينفرين في الدماغ على زيادة اليقظة والتنبيه، ويُعزّزُ التيقّظ وتكوين واسترجاع الذاكرة، ويُركّز الانتباه، كما يزيدُ من القلق والتململ. أمّا في باقي أجزاء الجسم، فإنَّ النورإبينفرين يزيدُ من معدّل سرعة القلب وضغط الدم، ويُحفّز إفراز الجلوكوز من مخازن الطاقة، كما يزيدُ من تدفّق الدم إلى العضلات الهيكلية، ويُقلّل من تدفّق الدم إلى الجهاز الهضمي، ويُثبّط إفراغ المثانة وحركة الجهاز الهضمي.[6]
يُنتَج النورإبينفرين في الدماغ في أنويةٍ صغيرةٍ ذات تأثيرٍ قويٍّ على مناطق أخرى من الدماغ، والأهمّ من هذه الأنوية هو الموضع الأزرق الموجود في الجسر.[5] يُستعمَل النورإبينفرين خارج الدماغ كناقلٍ عصبيٍ بواسطة العقد الودّية الموجودة بالقرب من النخاع الشوكيّ أو في البطن، كما يُفرَز مباشرةً إلى مجرى الدم بواسطة الغدد الكظرية. بغضّ النظر عن كيفية ومكان إفرازه، فإنَّ النورإبينفرين يعملُ على الخلايا المُستهدَفة عبر ربط وتفعيل مستقبلات الأدرينالية الموجودة على سطح الخلية.[7]
تُوجد مجموعةٌ متنوّعةٌ من الأدوية المُهمّة طبيًا والتي تعمل عبر تغيير أفعال أنظمة النُورأدرينالين. يستخدَم النورإبينفرين على نطاقٍ واسعٍ كدواءٍ قابلٍ للحقن لعلاج انخفاض ضغط الدمّ الحادّ. تستخدَم مُحصِرات بيتّا في علاج الماء الأزرق والصداع النصفي وبعض مشاكل القلب والأوعية الدموية، حيثُ تقاوم محصرات بيتا بمعارضة آثار النُورأدرينالين. تُستعمَل مُحصِرات ألفا لعلاج مجموعةٍ من مشاكل القلب والأوعية الدموية وعددٍ من الحالات النفسية، حيثُ تقاوم مُحصِرات ألفا مجموعةً من تأثيرات النُورأدرينالين.[8] غالبًا ما يكون لناهضات ألفا-2 تأثيرٌ مُهدّئ، وتستخدَم بشكلٍ شائعٍ في تحسين التخدير أثناء الجراحة، بالإضافة إلى استعمالها في علاج إدمان المخدّرات أو الكحول.[9] تُسبّب العديد من الأدوية النفسية الهامّة تأثيراتٍ قويّةٍ على أنظمة النُورأدرينالين في الدماغ، ممّا يؤدّي إلى آثارٍ جانبيةٍ قد تكون مفيدةً أو ضارّةً.[10]
التسمية
اشتُّقّ الاسم «نُورأدرينالين» noradrenalin من جذورٍ لاتينية تعني «في أو بجانب الكُلى»، ويشيعُ استعمال هذا الاسم في المملكة المتحدة، أمّا في الولايات المتحدة فيُستعمل اسم «نُورإِبينِفْرِين» Norepinephrine، وهو مُشتقٌّ من جذورٍ يونانية تعني نفس المعنى؛[11] حيث أن كلمة nephros تعني كلية في الإغريقية أما -epi فتعني أعلى (في إشارة إلى موقع الغدة الكظرية أعلى الكليتين)؛[12] أمّا السابقة نور- فهي مُشتَقّة من كلمة «normal»، والتي كانت تستخدم في بدايات تسمية المركّبات الكيميائية إلى الشكل منزوع الميثيل بالكامل من المركب الأم.[13]
البنية
ينتمي النورإبينفرين كيميائياً من حيث البنية إلى عائلة الكاتيكولامينات والفينيثيلامينات.[14] الكاتيكولامين هو ناقل عصبي أحادي الأمين وهو مركب عضوي يعتمد في بنيته على الكاتيكول (حلقة بنزين حاوية على مجموعتي هيدروكسيل متجاورتين) مع وجود مجموعة أمينية على سلسلة جانبية.[15] عندما عدم وجود مجموعتي الهيدروكسيل في الكاتيكولامين يسمّى المركّب فينيثيلامين، وهو أيضاً ناقل عصبي أحادي الأمين وأمين نزر. بالتالي فإنّ مجموعة الكاتيكولامينات هي مجموعة فرعية من الفينيثيلامينات، ذات التأثير المنبّه للجهاز العصبي المركزي عند البشر.
للكاتيكولامينات دور هرموني مهمّ في الجسم، وأشهرها بالإضافة إلى النورإبينفرين كلّ من الدوبامين والأدرينالين. تختلف بنية النورإبينفرين عن بنية الأدرينالين بأنّ الأخيرة تحتوي على مجموعة ميثيل مرتبطةٍ بذرّة النتروجين في المجموعة الأمينية.[14]
 بنية النورإبينفرين
بنية النورإبينفرين بنية الإبينفرين (الأدرينالين)
بنية الإبينفرين (الأدرينالين) بنية الكاتيكول
بنية الكاتيكول
الكيمياء الحيوية
الاصطناع الحيوي
يُصطنَع النورإبينفرين حيوياً انطلاقاً من الحمض الأميني تيروسين عبر سلسلة من الخطوات الإنزيمية في لب الغدة الكظرية وعصبونات الألياف العصبية التالية للعقدة في الجهاز العصبي الودّي. تجدر الإشارة أنّه في حين أنّ عملية تحوّل التيروسين إلى دوبامين تجري بشكلٍ سائدٍ في السيتوبلازم، فإنّ عملية تحوّل الدوبامين إلى نورإبينفرين تتمّ بشكل سائدٍ داخل الحويصلات المشبكية بأثرٍ من الإنزيم بيتا-هيدروكسيلاز الدوبامين.[19]
يكون مسار الاصطناع الرئيسي على الشكل:[19]
فينيل ألانين ← تيروسين ← L-دوبا ← دوبامين ← نورإبينفرين
حيث تتوفّر الأحماض الأمينية من عملية استقلاب (أيض) البروتينات المتوفّرة في الغذاء اليومي.[19]
هناك عدد من الإنزيمات الضروري وجودها لتأمين اصطناع النورإبينفرين وفق المخطّط المرفق. يُحوَّل L-فينيل ألانين إلى L-تيروسين بواسطة الإنزيم هيدروكسيلاز الفينيل ألانين (PAH)، والذي يصنّف ضمن إنزيمات هيدروكسيلاز الحمض الأميني العطري المعتمد على (AAAH)؛ ويقوم حينها الأكسجين الجزيئي (O2) ورباعي هيدرو البيوبتيرين بدور عامل مرافق. في خطوة تالية، يُحوَّل L-تيروسين إلى L-دوبا بواسطة الإنزيم هيدروكسيلاز التيروسين؛ ويقوم حينها رباعي هيدرو البيوبتيرين والأكسجين الجزيئي وأيونات الحديد الثنائي (2+Fe) بدور عامل مرافق.[19] بعد ذلك يُحوَّل L-دوبا إلى دوبامين بواسطة الإنزيم نازعة كربوكسيل L-الحمض الأميني العطري (AADC)، حيث تقوم فوسفات البيريدوكسال بدور عامل مرافق.[19] في الخطوة الأخيرة يُحوَّل الدوبامين إلى نورإبينفرين بواسطة الإنزيم بيتا-هيدروكسيلاز الدوبامين (والذي يعرَف أيضاً باسم بيتا-مونوأكسجيناز الدوبامين)؛ ويقوم حينها الأكسجين الجزيئي وحمض الأسكوربيك (فيتامين سي) بدور عامل مرافق.[19]
التحوّل إلى أدرينالين
في جسم الإنسان يتمّ تحويل النورإبينفرين إلى أدرينالين (إبينفرين) بواسطة الإنزيم ناقلة ميثيل-N فينيل إيثانولامين (PNMT) مع دخول S-أدينوسيل-L-ميثيونين عاملاً مرافقاً للإنزيم.[19] أثناء عملية الاصطناع يكون من الضروري وجود كمّيات كافية من العوامل المرافقة، الأمر الذي يتطلّب اصطناعها؛[19] إذ أنّ النقص أو العوز في أحد الأحماض الأمينية أو العوامل المرافقة يمكن له أن يسبّب خللاً في اصطناع النواقل العصبية.[19]
التكسير
يُكسَّر الدوبامين في الثديّيات إلى مستقلَباته (نواتج عملية الأيض أو الاستقلاب) بمساعدة الإنزيمات في الجسم؛ حيث تحدث المرحلة الأوّلية في هذه العملية بأثر تحفيزي من إحدى الإنزيمين أكسيداز أحادي الأمين (MAO-A) أو ناقلة ميثيل-O الكاتيكول (COMT).[20] يمكن أن يحدث التكسير بعد ذلك وفق مسارات استقلابية متعدّدة.
تتضمّن المنتجات النهائية الأساسية لعملية التكسير هذه إمّا فانيليل حمض المندليك (مشتقّ فانيليني لحمض المندليك) أو على هيئة شكل مترافق من 3-ميثوكسي-4-هيدروكسي فينيل الغليكول (MHPG)؛ واللذان لم توجد لهما أيّة فعّالية حيوية، ويطرحان في البول.[7]

الوظائف
| العائلة | المستقبل | النوع | الآلية |
|---|---|---|---|
| ألفـا | α1 | مقترن بوحدة Gq | زيادة IP3 والكالسيوم عبر تنشيط فوسفوليباز سي. |
| α2 | مقترن بوحدة Gi/Go | تخفيض cAMP عبر تثبيط محلقة الأدينيلات. | |
| بيتـا | β1 | مقترن بوحدة Gs | زيادة cAMP عبر تنشيط محلقة الأدينيلات. |
| β2 | |||
| β3 |
التأثيرات الخلوية
مثل العديد من المواد الحيوية النشطة الأخرى، يمارس النورإبينفرين تأثيراته عبر الارتباط بالمستقبلات المتواجدة على سطح الخلية وتنشيطها. حُدِّدَت عائلتان كبيرتان من مستقبلات النورإبينفرين وتعرفان باسم مستقبلات ألفا وبيتا أدرينالية الفعل.[7] تنقسم مستقبلات ألفا إلى النوعين الفرعيين ألفا 1 وألفا 2 وتنقسم مستقبلات بيتّا إلى الأنواع الفرعية بيتّا 1 وبيتّا 2 وبيتّا 3.[7] تعمل جميع هذه المستقبلات كمستقبلات مقترنة بالبروتين ج، ويعني ذلك أنّها تمارس تأثيراتها عبر نظام رسول ثانٍ معقّد.[7] لدى مستقبلات ألفا 2 عادةً تاثيرات مثبِّطة، لكن يمكن أن تتواجد قبل المشبك (أي على سطح العصبونات التي تحرّر النورإبينفرين) لذلك التأثير الصافي لتنشيط مستقبلات ألفا 2 هو غالباً انخفاضٌ في كمّية النورإبينفرين المحرَّرَة.[7] مستقبلات ألفا 1 وجميع أنواع مستقبلات بيتّا الثلاث لديها في العادة تأثيرات استثارية.[7]
التخزين والتحرير والاسترداد

يعمل النورإبينفرين داخل الدماغ كناقل عصبي، ويتمّ التحكّم فيه عبر مجموعة من الآليات الشائعة لدى جميع النواقل العصبية أحادية الأمين. بعد التخليق، يُنقَل النورإبينفرن من العصارة الخلوية إلى الحويصلات المشبكية بواسطة ناقل أحادي الأمين الحويصلي (VMAT).[21] ثم يُخزَّن في هذه الحويصلات حتّى يتمّ إفراغه في الشقّ المشبكي، عادةً بعد أن يسبّب جهد الفعل تفريغ الحويصلات لمحتواها مباشرةً في الشقّ المشبكي عبر عملية تسمّى الإخراج الخلوي.[7]
عند بلوغه الشقّ المشبكي يرتبط النورإبينفرين بالمستقبلات وينشّطها. بعد حدوث جهد الفعل، تنفصل جزيئات النورإبينفرين بسرعة عن مستقبلاتها ويُعاد امتصاصها من قبل العصبون قبل المشبكي عبر استردادٍ يتوسّطه ناقل النورإبينفرين (NET).[22] عندما يرجع النورإبينفرين إلى العصارة الخلوية، يمكن حينها هدمه بواسطة أكسيداز أحادي الأمين أو إعادة تخزينه في الحويصلات بواسطة ناقل أحادي الأمين الحويصلي وتوفيره لتحرير مستقبلي.[21]
الجهاز العصبي الودّي
النورإبينفرين هو الناقل العصبي الرئيسي المستخدم بواسطة الجهاز العصبي الودّي، الذي يتكوّن من حوالي دزينتين من سلسلة العقد الودّية المتواجدة بجوار الحبل الشوكي، بالإضافة إلى عقد مجاورة للفقار تتواجد في الصدر والبطن.[6] هذه العقد الودية مرتبطة بالعديد من الأعضاء منها: العينين والغدد اللعابية والقلب والرئتين والكبد والمرارة والمعدة والأمعاء والكليتين والمثانة والأعضاء التكاثرية والعضلات والجلد والغدّتان الكظريتان.[6] يسبّب التنشيط الودّي للغدد الكظرية إفراز الجزء المسمّى لب الغدة الكظرية للنورإبينفرين (وكذلك الإبينفرين) في مجرى الدم، حيث يعمل كهرمون ويستطيع الوصول إلى المزيد من الأنسجة المتنوعة.[6]
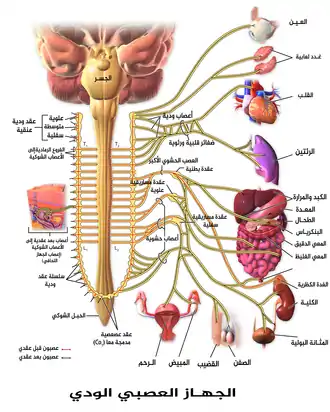
بشكلٍ عام، فإنّ تأثير النورإبينفرين على العضو المستهدَف هو بتغيير حالته بطريقةٍ تجعله أكثر مناسبة ومساعدة لحركة الجسم النشطة، غالبا بتكلفةٍ في زيادة استخدام الطاقة وزيادة في التردّي والتلف.[23] يمكن مناقضة هذا التأثير بتأثيرات الجهاز العصبي الودّي التي يتوسّطها الأسيتيل كولين، والتي تغيّر معظم نفس العناصر إلى حالة أكثر مناسبة ومساعدة للراحة والتعافي وهضم الطعام، وهي حالة في العادة أقلّ تكلفة في استهلاك الطاقة.[23]
تشمل التأثيرات الودّية للنورإبينفرين:
- في العينين: زيادة في إنتاج الدموع ما يجعل العين رطبة،[24] وتوسع الحدقة عبر انقباض العضلة الموسّعة للحدقة.
- في القلب: زيادة كمّية الدمّ التي يتمّ ضخّها.[25]
- في النسيج الدهني البني: زيادة في حرق الحُريْرات لتوليد حرارة الجسم (توليد الحرارة).[26]
- العديد من التأثيرات على الجهاز المناعي: الجهاز العصبي الودّي هو المسار الرئيسي للتآثر بين الجهاز المناعي والدماغ، والعديد من الأعضاء تستقبل مُدخلات ودية بما في ذلك: الغدّة الزعترية والطحال والعقدة اللمفاوية. مع ذلك فهذه التأثيرات معقّدة، حيث تُنشَّط بعض العمليات المناعية بينما تثبَّط أخرى.[27]
- في الشرايين: تضييق الأوعية الدموية، مسبّباً زيادة في ضغط الدم.[28]
- في الكليتين: تحرير الرينين وإبقاء الصوديوم في مجرى الدمّ.[29]
- في الكبد: زيادة إنتاج الغلوكوز، سواءً بواسطة تحلل الغليكوجين بعد تناول وجبة أو بواسطة استحداث الجلوكوز عند عدم تناول الطعام لفترة.[29] إذ أنّ الغلوكوز هو مصدر الطاقة الرئيسي للجسد في معظم الظروف.
- في البنكرياس: زيادة تحرير الغلوكاغون، وهو هرمون تأثيره الرئيسي زيادة إنتاج الغلوكوز بواسطة الكبد.[29]
- في العضلات الهيكلية: زيادة في استهلاك الغلوكوز.[29]
- في النسيج الدهني: (الخلايا الدهنية) زيادة في تحلل الدهن، وهو تحويل الليبيدات إلى مواد يمكن استخدامها مباشرة كمصادر طاقة بواسطة العضلات والأنسجة الأخرى.[29]
- في المعدة والأمعاء: تخفيض في نشاط الهضم. وهذا ينتج عن تأثير مثبّط للنورإبينفرين على الجهاز العصبي المعوي، يؤدّي إلى انخفاض الحركة المعدية المعوية وتدفق الدم وإفراز المواد الهاضمة.[30]
وُجِد أنّ بإمكان الكانابينويد الداخلي أنانداميد والكانابينويد WIN 55,212-2 تغيير الاستجابة العامّة لتنبيه عصب ودّي، ممّا يشير إلى أنّ مستقبلات CB1 قبل الموصلية تتوسّط الفعل التثبيطي الودّي. وعليه يمكن للكانابيودات (أشباه القنّب) تثبيط المكوّنات نورأدرنالية الفعل وبيورينية الفعل الخاصّة بالنقل العصبي الودّي.[31]
الجهاز العصبي المركزي
تشكّل العصبونات نورأدرينالية الفعل في الدماغ نظام نقلٍ عصبي خاصّاً بها، ويمارس هذا النظام -حين يُنشَّط- تأثيراتٍ على مناطق كبيرة من الدماغ. تتجلّى هذه التأثيرات في التأهّب واليقظة والاستعداد للقيام بفعل.
العصبونات نورأدرينالية الفعل (العصبونات التي ناقلها العصبي الأساسي هو نورإبينفرين) صغيرة العدد نسبياً، وأجسام خلاياها مُجمَّعة في مناطق معدودة وصغيرة نسبياً من الدماغ، لكنّها ترسل امتدادات إلى عدّة مناطق أخرى من الدماغ وتمارس تأثيرات قوّية على أهدافها. حُدّدت مواضع مجموعات الخلايا نورأدرينالية الفعل هذه أوّل مرّة سنة 1964 بواسطة أنيكا دالستروم وكجيل فوكس (3) اللذان رمزا لها بحروف A (إشارة إلى aminergic أي أميني الفعل أو تنتج أمينات).[32] في مخطّطهما، تحتوي المواقع من A1 حتى A7 على الناقل العصبي نورإبينفرين، بينما تحتوي المناطق A8 حتى A14 على الدوبامين. تتواجد مجموعة الخلايا نورأدرينالية الفعل A1 في الجزء الذنبي البطني الجانبي من لب الغدة الكظرية، وتلعب دوراً في التحكّم في أيض سائل الجسم.[33] تتواجد مجموعة الخلايا نورأدرينالية الفعل A2 في منطقة بجذع الدماغ تسمّى النواة المفردة، ولهذه الخلايا دورٌ في العديد من الاستجابات منها التحكّم في الغذاء المتناوَل والاستجابات للإجهاد.[34] تمتدّ مجموعات الخلايا A5 وA7 عموماً إلى الحبل الشوكي.[35]

إنّ أهمّ مصدرٍ للنورإبينفرين في الدماغ هو الموضع الأزرق، الذي يحتوي على مجموعة الخلايا نورأدرينالية الفعل A6 ومجموعة الخلايا المجاورة A4. الموضع الأزرق صغيرٌ إلى حدٍ كبير، وبلغة الأرقام يقدَّر أنّه يحتوي على حوالي 15 ألف عصبون في الرئيسيات، وهذا أقلّ من واحد من المليون من عصبونات الدماغ، لكنها ترسل امتدادات إلى كلّ جزءٍ مهمٍّ من الدماغ وكذلك إلى النخاع الشوكي.[5]
يتناسب نشاط الموضع الأزرق بشكل كبير مع اليقظة والتأهّب وسرعة ردّة الفعل. إنّ نشاط الموضع الأزرق منخفض أثناء النوم، كما ينخفض لحدّ الزوال أثناء حالة نوم حركة العين السريعة (الحلم) (REM).[36] ينشط الموقع الأزرق إلى مستوى القيمة القاعدية أثناء اليقظة، لكن يزيد نشاطه مؤقّتاً حين يواجه الفرد أيّ نوعٍ من المنبّهات التي تجذب الاهتمام. تُولِّد المنبّهات غير السارّة، مثل الألم أو صعوبة التنفّس أو انتفاخ المثانة أو الحرّ أو البرد، زياداتٍ كبيرةٍ في نشاط الموضع الأزرق. في حين أنّ الحالات غير السارّة الشديدة مثل الخوف الشديد أو الألم الشديد تصاحبها مستويات مرتفعة جدّاً في نشاط الموضع الأزرق.[5]
يؤثّر تحرير النورإبينفرين بواسطة الموضع الأزرق على وظيفة الدماغ بطرق عديدة، إذ يحسّن من معالجة المُدخلات الحسّية ومن الانتباه ومن تكوين واسترجاع كلّ من الذاكرة طويلة المدى والذاكرة العاملة، كما يحسّن قابلية الدماغ للاستجابة للمُدخلات عبر تغيير نمط النشاط في القشرة أمام الجبهية ومناطق أخرى.[37] يكون التحكّم في مستوى اليقظة قويّاً بالشكل الكافي بحيث أنّ كبت نشاط الموضع الأزرق المُحدَثِ بواسطة الدواء يملك تأثيراً مهدّئاً قويّاً.[36]
يوجد تشابه كبير بين الحالات التي تُنشِّط الموضع الأزرق في الدماغ والحالات التي تُنشِّط الجهاز العصبي الودّي في الأطراف: الموضع الأزرق يعبّئ ويحضِّر الدماغ للفعل بينما يعبئ الجهاز الودّي الجسم للفعل. تمّ اقتراح أن هذا التشابه ينبع من كون أن كلاهما يتمّ التحكّم فيه بدرجة كبيرة بواسطة نفس بُنى الدماغ، وبشكلٍ أخصّ جزء في جذع الدماغ يسمى النواة عرطلية الخلايا.[5]
علم الأدوية
يمارس عدد كبير من الأدوية تأثيراته عبر التآثر مع أنظمة النورإبينفرين في الدماغ أو الجسم. ويشمل استخدامها معالجة مشاكل الأوعية والقلب، والصدمة، ومجموعة متنوّعة من الحالات النفسية. تنقسم هذه الأدوية إلى نوعين: المحاكيات الودية وهي أدوية تحاكي أو تحسّن على الأقلّ بعض تأثيرات النورإبينفرين المحرَّر بواسطة الجهاز العصبي الودّي، والحالَّات الودّية وهي أدوية معاكسة التأثير، فتحصر وتثبّط على الأقلّ بعض تأثيراته.[8] كلا هاتين المجموعتين الكبيرتين ذات استخدامات متنوّعة، وذلك يعتمد بالتحديد على التأثيرات التي تحسّنها أو تحصرها.[8]
يُصنَّف دواء النورإبينفرين في حدّ ذاته من الأدوية محاكية الودّي: وتأثيراته في زيادة معدّل دقّات القلب وتضييق الأوعية الدموية عندما يُعطَى عبر حقن وريدي تجعله مفيداً جدّاً في معالجة الحالات الطبّية الطارئة التي تتعلّق بضغط دموي منخفض جدّاً.[8] توصي حملة النجاة من الإنتان بأن يكون النورإبينفرين العامل الأول في معالجة الصدمة الإنتانية والتي تكون غير مستجيبة للإنعاش بالسوائل، مُكمَّلاً بفازوبرسين والأدرينالين؛ في حين أن استخدام الدوبامين يكون محصوراً في المرضى الذين تكون حالاتهم مختارة بعناية.[38]
مُحصِرات بيتا
محصرات بيتا هي أدوية حالة الودي تثبّط تأثيرات مستقبلات بيتّا الأدرينالينية في حين تملك تأثيراً صغيراً أو منعدماً على مستقبلات ألفا. تُستخدم هذه الأدوية في بعض الأحيان لمعالجة ضغط الدم المرتفع والرجفان الأذيني وقصور القلب الاحتقاني، إلّا أنّ مراجعاتٍ حديثة استنتجت أنّ أنواعاً أخرى من الأدوية هي الأفضل عادةً في معالجة هذه الأمراض.[39][40] يمكن أن تكون محصرات بيتّا اختياراً حيوياً لأمراض قلبية وعائية أخرى منها الذبحة الصدرية ومتلازمة مارفان.[41] وهي واسعة الاستخدام كذلك في معالجة الماء الأزرق على هيئة قطرات للعين في أغلب الأحيان.[42] بسبب تأثيراتها في تخفيض أعراض القلق والرعاش فهي تُستخدم أحياناً بواسطة الفنّانين وخطباء الجماهير والرياضيين لتخفيض قلق الأداء، وذلك رغم عدم الموافقة والمصادقة الطبّية على استخدامها لذلك الغرض، ورغم أنها ممنوعة من طرف اللجنة الأولمبية الدولية.[43][44]
مع ذلك، فإنّ فائدة محصرات بيتّا محدودة بسبب مجموعة من الأعراض الجانبية الخطيرة منها: تخفيض معدّل دقّات القلب وانخفاض في ضغط الدم والربو ونقص سكر الدم التفاعلي.[42] يمكن أن تكون التأثيرات السلبية حادّة بشكل خاصّ لدى الأفراد المرضى بالسكري.[39]
مُحصِرات ألفا
محصرات ألفا هي أدوية حالة الودي تثبّط تأثيرات مستقبلات ألفا الأدرينالينية في حين تملك تأثيراً صغيراً أو منعدماً على مستقبلات بيتّا.[45] يمكن أن يكون للأدوية التي تنتمي إلى هذه المجموعة تأثيرات مختلفة، وذلك حسب إن كانت تثبّط مستقبلات ألفا-1 بشكل أساسي أو ألفا-2 أو كلاهما. تتواجد مستقبلات ألفا-2 على العصبونات المحرِّرة للنورإبينفرين وتملك تأثيرات مثبّطة عليها، ولذلك فإنّ حصر وتثبيط مستقبلات ألفا-2 تنتج عنه زيادة في النورإبينفرين المحرّر.[45] إنّ مستقبلات ألفا-1 عادةً ما تتواجد على على الخلايا المستهدَفة وتملك تأثيرات استثارية عليها، ولذلك فإنّ حصر وتثبيط مستقبلات ألفا ينتج عنه عادةً حصر بعض تأثيرات النورإبينفرين.[45] إنّ الأدوية مثل فنتولامين، التي تعمل على كلا النوعين من المستقبلات، يمكن أن تُنتِج توليفة معقّدة من كلا التأثيرات. في معظم الحالات التي يستخدم فيها المصطلح «محصرات ألفا» من غير تخصيص فإنه يشير إلى مناهضات ألفا-1 الانتقائية.
لمحصرات ألفا-1 استخدامات متنوّعة ولأن أحد تأثيراتها هو استرخاء عضلاتٍ في عنق المثانة، فهي تُستخدم عادة في معالجة تضخّم البروستات الحميد، وفي المساعدة في التخلّص من حصي المثانة. كما تساعد محصرات ألفا الأفراد -على الأرجح- في التخلّص من حصي الكلية.[46] تأثيراتها على الجهاز العصبي المركزي تجعلها مفيدة في معالجة اضطراب القلق العام واضطراب الهلع واضطراب الكرب التالي للصدمة النفسية.[47] مع ذلك يمكن أن يكون لها آثار جانبية معتبرة منها انخفاض ضغط الدم.[45]
تعمل بعض مضادّات الاكتئاب جزئياً كمحصرات ألفا-2 انتقائية، وأشهر العقاقير المعروفة من هذا القسم هو يوهمبين الذي استُخلص من لحاء شجرة اليوهمب.[48] يعمل اليوهمبين كمحسّن لفحولية الذكور، لكن فائدته لذلك الغرض محدودة بسبب تأثيراتٍ جانبية كبيرة منها القلق والأرق،[48] ويمكن أن تسبّب الجرعات الزائدة منه زيادة خطيرة في ضغط الدم.[48] اليوهمبين ممنوع في العديد من الدول، ما عدا الولايات المتحدة، إذ ولأنه يُستخلص من النبات بدل اصطناعه كيميائياً، فإنه يباع فيها ضمن المكمّلات الغذائية من دون وصفة.[49]
ناهضات ألفا-2
ناهضات ألفا-2 هي أدوية محاكية الودي تنشِّط مستقبلات ألفا-2 أو تحسّن من تأثيراتها.[9] لأنّ مستقبلات ألفا-2 ذات تأثيرات مثبّطة والعديد منها يتواجد قبل المشبك على العصبونات المحرِّرة للنورإبينفرين، يكون التأثير الصافي لهذه الأدوية عادةً بتخفيض كمّية النورإبينفرين المحرّر.[9] الأدوية في هذه المجموعة ذات تأثيرات مسكِّنة قوية في العادّة، وذلك بسبب تأثيراتها المثبّطة على الموضع الأزرق.[9] يُستخدم الكلونيدين على سبيل المثال لمعالجة اضطرابات القلق والأرق، وكذلك كمهدّئ ممهّد للعلاج للمرضى الذين هم على وشك الخضوع لعملية جراحية.[50] الزيلازين هو دواء آخر من هذه المجموعة، وهو مهدّئ قوي كذلك وعادةً ما يستخدم إلى جانب الكيتامين في التخدير العام في الجراحة البيطرية، وفي الولايات المتحدة لم يُصادق بعد على استخدامه على البشر.[51]
المنبهات ومضادات الاكتئاب
المنشّطات ومضادّات الاكتئاب هي أدوية يُعتقد أنّ تأثيراتها الرئيسية تتوسّطها مختلف أنظمة النواقل العصبية (الدوبامين بالنسبة للمنشّطات، والسيروتونين بالنسبة لمضادّات الاكتئاب)، لكنّ العديد منها يزيد من معدّلات النورإبينفرين. إنّ الأمفيتامين على سبيل المثال هو منشّط يزيد من تحرير النورإبينفرين والدوبامين كذلك.[10] مثبّطات أكسيداز أحادي الأمين هي مضادّات اكتئاب تقوم بتثبيط الأيض التفكيكي للنورإبينفرين وكذلك السيروتونين. في بعض الحالات، من الصعب التمييز بين التأثيرات التي يتوسّطها النورإبينفرين والتأثيرات الخاصّة بنواقل عصبية أخرى.
الأمراض والاضطرابات
تحدثٌ عددٌ من المُشكلات الطبّية الهامّة نتيجةً لخللٍ في نظام النورإبينفرين في الدماغ أو الجسم.
فرط تنشيط الجهاز العصبي الودّي
لا يُعتبر فرط تنشيط الجهاز العصبي الودّي حالةً منفردةً معترفًا بها، ولكنهُ مكوّنٌ من عددٍ من الحالات، وكذلك كنتيجةٍ محتملةٍ لاستعمال أدويةٍ مُحاكيةٍ للجهاز الودي. تُسبّب هذه الحالة مجموعةً مُتنوّعةً من الأعراض وتشملُ الألم وسرعة ضربات القلب وارتفاع ضغط الدمّ والتعرّق وخفقان القلب والقلق والصداع والشحوب وانخفاض نسبة الغلوكوز في الدم. إذا كان النشاط الودّي مرتفعًا لفترةٍ طويلة، فإنّه قد يُسبب فقدانًا في الوزن وتغيّراتٍ جسميةٍ أُخرى مرتبطةٍ بالتوتر.
تتضمّن قائمة الحالات التي قد تُسبّب فرط تنشيط الجهاز العصبي الودّي: إصابات الدماغ الشديدة،[52] وتلف الحبل الشوكي،[53] وفشل القلب،[54] وارتفاع ضغط الدم،[55] وأمراض الكلى،[56] وأنواعٍ مختلفةٍ من الإجهاد.
ورم القواتم
ورم القواتم هو ورمٌ نادرٌ، يحدثُ في لب الغدة الكظرية، إمّا بسبب عوامل وراثية أو أنواعٍ معيّنةٍ من السرطان، حيثُ يؤدّي إلى زيادةٍ مُفرطةٍ في كمّية النورإبينفرين والإبينفرين المُفرز في مجرى الدم. تحدث عددٌ من الأعراض وأكثرها وضوحًا هي أعراض فرط النشاط الودّي، والتي تتضمّن ارتفاع ضغط الدم، الذي قد يصل إلى مستوياتٍ مُميتة. يعتبر الاستئصال الجراحي للورم أكثر العلاجات فعاليةً.
الإجهاد
يُعرف الإجهاد فيزيولوجيًا بأنّهُ أيُّ حالةٍ تُهدّد الاستقرار المُستمرّ للجسم ووظائفه.[4] يُؤثّر الإجهاد على مجموعةٍ واسعةٍ من أجهزة الجسم، وأكثرها تنشيطًا باستمرار هما المحور الوطائي النخامي الكظري والجهاز النورإبينفريني، والذي يتضمّن الجهاز العصبي الودّي وجهاز الموضع الأزرق المُتمركز في الدماغ.[4] تُثيرُ أنواع المُجهدات المتنوّعةُ زيادةً في النشاط النورأدريني، والذي يستنفرُ الدماغ والجسم لمواجهة التهديد.[4] إذا استمر الإجهاد المُزمن لفترةٍ طويلةٍ، فإنه قد يُسبّب أضرارًا بأجزاءٍ كثيرةٍ من الجسم، حيثُ يحدثُ جزءٌ كبيرٌ من التلف بسبب تأثيرات الإفراز المُستمر للنورإبينفرين؛ وذلك بسبب الوظيفة العامّة للنورإبينفرين والتي تتمثّل في توجيه إمكانيات الجسم بعيدًا عن وظائف المُحافظة والتجديد والتكاثر، وتوجّهُها إلى الأجهزة المُطلوبة للحركة النشطة. يمكن أن تتضمّن النتائج تباطؤ النموّ (عند الأطفال) والأرق وفقدان الرغبة الجنسية ومشاكل في الجهاز الهضمي وضعف مقاومة الأمراض ومعدّلاتٍ أبطأ في التئام الجروح والاكتئاب وزيادة التعرّض للإدمان.[4]
اضطراب نقص الانتباه مع فرط النشاط
اضطراب نقص الانتباه مع فرط النشاط هو حالةٌ نفسية، تتضمّن مشاكلًا في الانتباه واندفاعًا وفرطًا في النشاط.[57] عادةً ما يُعالج باستعمال الأدوية المنبّهة مثل ميثيل الفينيدات (ريتالين)، والذي يتمثّل تأثيره الأساسي في زيادة مُستويات الدوبامين في الدماغ، ولكنّ أدوية هذه المجموعة تؤدّي عمومًا إلى زيادة مستويات النورإبينفرين في الدماغ، ويصعُب تحديد ما إذا كان هذا التأثير ذو قيمةٍ سريرية. تُوجد أيضًا أدلّةٌ أساسيةُ على أنَّ العديد من الأشخاص الذين يعانون من اضطراب نقص الانتباه مع فرط النشاط يُظهرون علاماتٍ حيويةٍ تتضمّن تغييرًا في معالجة النورإبينفرين.[58] أُجريت تجاربٌ لعلاج اضطراب نقص الانتباه مع فرط النشاط بعددٍ من الأدوية ذات التأثير الأساسي على النورإبينفرين، والتي تتضمّن الغوانفاسين والكلونيدين والأتوموكسيتين، وتبيّن أنَّ لها تأثيرات مماثلة للمنبّهات.[59][60]
فشل الجهاز العصبي الذاتي
قد تؤدّي العُديد من الحالات مثل مرض باركنسون والسكري وفشل الجهاز العصبي الذاتي الخالص إلى فقدان الخلايا العصبية التي تُفرز النورإبينفرين في الجهاز العصبي الودّي. تكون الأعراضُ واسعةَ الانتشار، وأخطرها انخفاضُ معدّل ضربات القلب والانخفاض الشديد في ضغط الدمّ أثناء الراحة، ممّا يجعل من المستحيل على الأشخاص المُصابين بالوقوف لأكثر من بضع ثوانٍ دون إغماء. قد يتضمّن العلاجُ تغييرات غذائية أو أدوية.[61]
علم الأحياء المقارن والتطوّر

تمّ الإبلاغ عن تواجد النورإبينفرين في تشكيلةٍ واسعة من الأجناس الحيوانية منها: الأوّليات،[62] والصفيحيات، واللاسعات (قنديل بحر والأجناس ذات الصلة به)،[63] لكن ليس في المشطيات (حاملات الأمشاط) التي يختلف نظامها العصبي بشكل كبير عن باقي تلك الحيوانات.[64] النورإبينفرين متواجد عموماً في ثانويات الفم (الفقاريات، إلخ.) لكنه مستبدَل بالأكتوبامين في أوليات الفم (مفصليات الأرجل والرخويات والديدان المسطّحة والديدان الأسطوانية والحلقيات، إلخ.) وهو مركّب كيميائي قريب الصلة بالنورإبينفرين وله مسار تخليق قريب الصلة كذلك.[62] في الحشرات، للأكتوبامين وظائف تحذيرية وتنشيطية تتوافق (على الأقل تقريباً) مع وظائف النورإبينفرين لدى الفقاريات.[65] طُرحت فرضية تقول أن الأكتوبامين تطوّر لأخذ مكان النورإبينفرين وليس العكس، مع ذلك، أُبلِغ عن احتواء الجهاز العصبي للسهيمات (حبليات بدائية) على الأكتوبامين وليس النورإبينفرين، وهذا يضع صعوبات أمام هذه الفرضية.[62]
التاريخ
في بداية القرن العشرين، قام والتر كانون، وهو الذي عمّم فكرة قيام الجهاز الودّي الكظري بتجهيز الجسم لحالة الكر والفر، مع زميله أرتورو روزنبلويث بوضع نظريةٍ عن اثنين من السيمباثينات (4) وهما سيمباثين E (استثاري) وسيمباثين I (تثبيطي)، بصفتها مسؤولةً عن أفعال الكر والفر.[66] في الفترة ما بين 1934-1938، اقترح الصيدلاني البلجيكي زينون بك والصيادلة الكنديين والأمريكيين أنّ النورإبينفرين قد يكون ناقلًا ودّيًا.[66] في عام 1939، حدّد هيرمان بلاشكو وبيتر هولتز (5) آلية الاصطناع الحيوي للنورإبينفرين في جسم الفقاريات.[67][68] نشر أولف فون أولر أوّل سلسلةٍ من المقالات التي أثبتت دور النورإبينفرين كناقلٍ عصبي في عام 1945،[69] حيثُ أثبت وجود النورإبينفرين في أنسجة المخّ والأعصاب الودّية، وأورد دليلًا بأنهُ سيمباثين كانون وروزنبلويث.
هوامش
1. نُورإِبينِفْرِين[ِ 1][ِ 2][ِ 3][ِ 4] أو نورأبينِفْرين[ِ 1][ِ 5] (بالإنجليزية: Norepinephrine) ويُعرف اختصارًا NE.
2. نُورأدرينالين[ِ 6][ِ 7][ِ 8][ِ 9][ِ 10] (بالإنجليزية: Noradrenaline) ويُعرف اختصارًا NA.
3. Annica Dahlström و Kjell Fuxe
4. السيمباثين أو الوُدِّين (بالإنجليزية: Sympathin) هو هُرمونٌ وسيطٌ للدُّفعات العصبية عند مشابك الأعصاب الوُدِّية.[ِ 11]
5 Hermann Blaschko و Peter Holtz
المراجع
باللغة الإنجليزية
- مُعرِّف المُصطلَحات المرجعيَّة في ملف المخدرات الوطني (NDF-RT): https://bioportal.bioontology.org/ontologies/NDFRT?p=classes&conceptid=N0000147945 — تاريخ الاطلاع: 13 ديسمبر 2016
- العنوان : norepinephrine — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/439260 — تاريخ الاطلاع: 19 نوفمبر 2016 — الرخصة: محتوى حر
- "(-)-noradrenaline"، IUPHAR database، International Union of Basic and Clinical Pharmacology، مؤرشف من الأصل في 3 أبريل 2019، اطلع عليه بتاريخ 2 يناير 2016.
- Chrousos GP (2009)، "Stress and disorders of the stress system"، Nat Rev Endocrinol، 5 (7): 374–81، doi:10.1038/nrendo.2009.106، PMID 19488073، مؤرشف من الأصل في 23 فبراير 2020.
- Sara SJ, Bouret S (2012)، "Orienting and reorienting: the locus coeruleus mediates cognition through arousal"، Neuron، 76 (1): 130–41، doi:10.1016/j.neuron.2012.09.011، PMID 23040811.
- Hamill RW, Shapiro RE, Vizzard MA (2012)، "Peripheral Autonomic Nervous System"، في Robertson D, Biaggioni I, وآخرون (المحررون)، Primer on the Autonomic Nervous System، Academic Press، ص. 17–20، ISBN 978-0-12-386525-0.
- Rang HP, Ritter JM, Flower R, Henderson G (2014)، "Chapter 14: Noradrenergic transmission"، Rang & Dale's Pharmacology، Elsevier Health Sciences، ص. 177–196، ISBN 978-0-7020-5497-6.
- Gardenhire DS (2013)، Rau's Respiratory Care Pharmacology، Elsevier Health Sciences، ص. 88، ISBN 978-0-323-27714-3.
- Lemke KA (2004)، "Perioperative use of selective alpha-2 agonists and antagonists in small animals"، Can. Vet. J.، 45 (6): 475–80، PMC 548630، PMID 15283516.
- Heal, David J.؛ Smith, Sharon L.؛ Gosden, Jane؛ Nutt, David J. (يونيو 2013)، "Amphetamine, past and present—a pharmacological and clinical perspective"، Journal of Psychopharmacology، 27 (6): 479–496، doi:10.1177/0269881113482532، PMC 3666194، PMID 23539642.
- Aronson JK (فبراير 2000)، "'Where name and image meet'—the argument for 'adrenaline'"، British Medical Journal، 320 (7233): 506–9، doi:10.1136/bmj.320.7233.506، PMC 1127537، PMID 10678871.
- "epinephrine (n.)"، Etymonline، مؤرشف من الأصل في 1 مايو 2019، اطلع عليه بتاريخ 12/2019.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Gaddum JH (يونيو 1956)، "The Prefix 'Nor' in Chemical Nomenclature"، Nature، 177 (1046): 1046، Bibcode:1956Natur.177.1046G، doi:10.1038/1771046b0.
- "Norepinephrine"، PubChem، مؤرشف من الأصل في 13 سبتمبر 2019، اطلع عليه بتاريخ 06 نوفمبر 2015.
- Fitzgerald, P. A. (2011)، "Chapter 11. Adrenal Medulla and Paraganglia"، في Gardner, D. G.؛ Shoback, D. (المحررون)، Greenspan's Basic & Clinical Endocrinology (ط. 9th)، New York: McGraw-Hill، اطلع عليه بتاريخ 26 أكتوبر 2011.
- Broadley KJ (مارس 2010)، "The vascular effects of trace amines and amphetamines"، Pharmacol. Ther.، 125 (3): 363–375، doi:10.1016/j.pharmthera.2009.11.005، PMID 19948186.
- Lindemann L, Hoener MC (مايو 2005)، "A renaissance in trace amines inspired by a novel GPCR family"، Trends Pharmacol. Sci.، 26 (5): 274–281، doi:10.1016/j.tips.2005.03.007، PMID 15860375.
- Wang X, Li J, Dong G, Yue J (فبراير 2014)، "The endogenous substrates of brain CYP2D"، Eur. J. Pharmacol.، 724: 211–218، doi:10.1016/j.ejphar.2013.12.025، PMID 24374199.
- Musacchio JM (2013)، "Chapter 1: Enzymes involved in the biosynthesis and degradation of catecholamines"، في Iverson L (المحرر)، Biochemistry of Biogenic Amines، Springer، ص. 1–35، ISBN 978-1-4684-3171-1.
- Griffith, Robert K. (2013)، "Chapter 10: Adrenergic Receptors and Drugs Affecting Adrenergic Neurotransmission"، في Lemke, Thomas L.؛ Williams, David A.؛ Zito, S. William؛ Roche, Victoria F. (المحررون)، Foye's Principles of Medicinal Chemistry (ط. 7th)، Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins، ص. 343، ISBN 978-1-60913-345-0.
- Eiden LE, Sch?fer MK, Weihe E, Schütz B (2004)، "The vesicular amine transporter family (SLC18): amine/proton antiporters required for vesicular accumulation and regulated exocytotic secretion of monoamines and acetylcholine"، Pflügers Arch.، 447 (5): 636–40، doi:10.1007/s00424-003-1100-5، PMID 12827358.
{{استشهاد بدورية محكمة}}: Vancouver style error: non-Latin character in name 2 (مساعدة) - Torres GE, Gainetdinov RR, Caron MG (2003)، "Plasma membrane monoamine transporters: structure, regulation and function"، Nature Reviews Neuroscience، 4 (1): 13–25، doi:10.1038/nrn1008، PMID 12511858.
- Schacter D, Gilbert D, Wegner D, Hood B (2011)، Psychology: European Edition، Palgrave Macmillan، ص. 93، ISBN 978-0-230-34367-2.
- Dartt DA (مايو 2009)، "Neural regulation of lacrimal gland secretory processes: relevance in dry eye diseases"، Progress in Retinal and Eye Research، 28 (3): 155–77، doi:10.1016/j.preteyeres.2009.04.003، PMC 3652637، PMID 19376264.
- Tank AW, Lee Wong D (يناير 2015)، Peripheral and central effects of circulating catecholamines، Comprehensive Physiology، ج. 5، ص. 1–15، doi:10.1002/cphy.c140007، ISBN 9780470650714، PMID 25589262.
- Bahler L, Molenaars RJ, Verberne HJ, Holleman F (سبتمبر 2015)، "Role of the autonomic nervous system in activation of human brown adipose tissue: A review of the literature"، Diabetes & Metabolism، 41 (6): 437–445، doi:10.1016/j.diabet.2015.08.005، PMID 26404650.
- Kenney MJ, Ganta CK (يوليو 2014)، Autonomic nervous system and immune system interactions، Comprehensive Physiology، ج. 4، ص. 1177–200، doi:10.1002/cphy.c130051، ISBN 9780470650714، PMC 4374437، PMID 24944034.
- Chistiakov DA, Ashwell KW, Orekhov AN, Bobryshev YV (2015)، "Innervation of the arterial wall and its modification in atherosclerosis"، Auton Neurosci، 193: 7–11، doi:10.1016/j.autneu.2015.06.005، PMID 26164815.
- Thorp AA, Schlaich MP (2015)، "Relevance of Sympathetic Nervous System Activation in Obesity and Metabolic Syndrome"، J Diabetes Res، 2015: 1–11، doi:10.1155/2015/341583، PMC 4430650، PMID 26064978.
- Konturek SJ, Konturek JW, Pawlik T, Brzozowski T (2004)، "Brain-gut axis and its role in the control of food intake" (PDF)، J. Physiol. Pharmacol.، 55 (1 Pt 2): 137–54، PMID 15082874، مؤرشف من الأصل (PDF) في 16 سبتمبر 2018.
- Pakdeechote, P؛ Dunn, W R؛ Ralevic, V (2007)، "Cannabinoids inhibit noradrenergic and purinergic sympathetic cotransmission in the rat isolated mesenteric arterial bed"، British Journal of Pharmacology، 152 (5): 725–733، doi:10.1038/sj.bjp.0707397، ISSN 0007-1188، PMC 2190027، PMID 17641668، مؤرشف من الأصل في 17 ديسمبر 2019.
- Dahlstroem A, Fuxe K (1964)، "Evidence for the existence of monoamine-containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons"، Acta Physiologica Scandinavica. Supplementum، 232 (Supplement 232): 1–55، PMID 14229500.
- Antunes-Rodrigues J, de Castro M, Elias LL, Valença MM, McCann SM (يناير 2004)، "Neuroendocrine control of body fluid metabolism"، Physiological Reviews، 84 (1): 169–208، doi:10.1152/physrev.00017.2003، PMID 14715914.
- Rinaman L (فبراير 2011)، "Hindbrain noradrenergic A2 neurons: diverse roles in autonomic, endocrine, cognitive, and behavioral functions"، American Journal of Physiology. Regulatory, Integrative and Comparative Physiology، 300 (2): R222–35، doi:10.1152/ajpregu.00556.2010، PMC 3043801، PMID 20962208.
- Bruinstroop E, Cano G, Vanderhorst VG, Cavalcante JC, Wirth J, Sena-Esteves M, Saper CB (يونيو 2012)، "Spinal projections of the A5, A6 (locus coeruleus), and A7 noradrenergic cell groups in rats"، The Journal of Comparative Neurology، 520 (9): 1985–2001، doi:10.1002/cne.23024، PMC 3508755، PMID 22173709.
- Berridge CW, Schmeichel BE, Espana RA (2012)، "Noradrenergic modulation of wakefulness/arousal"، Sleep Med Rev، 16 (2): 187–97، doi:10.1016/j.smrv.2011.12.003، PMC 3278579، PMID 22296742.
- Sara SJ (2015)، "Locus Coeruleus in time with the making of memories"، Curr. Opin. Neurobiol.، 35: 87–94، doi:10.1016/j.conb.2015.07.004، PMID 26241632.
- Rhodes, Andrew؛ Evans, Laura E (مارس 2017)، "Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock 2016"، Critical Care Medicine، 45 (3): 486–552، doi:10.1097/CCM.0000000000002255، PMID 28098591،
We recommend norepinephrine as the first-choice vasopressor (strong recommendation, moderate quality of evidence).
- Deedwania PC (2015)، "Management of Patients With Stable Angina and Type 2 Diabetes"، Rev Cardiovasc Med، 16 (2): 105–13، PMID 26198557.
- Mareev Y, Cleland JG (2015)، "Should β-Blockers Be Used in Patients With Heart Failure and Atrial Fibrillation?"، Clin Ther، 37 (10): 2215–24، doi:10.1016/j.clinthera.2015.08.017، PMID 26391145.
- Kumar A, Agarwal S (2014)، "Marfan syndrome: An eyesight of syndrome"، Meta Gene، 2: 96–105، doi:10.1016/j.mgene.2013.10.008، PMC 4287801، PMID 25606393.
- Inoue K (2014)، "Managing adverse effects of glaucoma medications"، Clin Ophthalmol، 8: 903–13، doi:10.2147/OPTH.S44708، PMC 4025938، PMID 24872675.
- Brugués AO (2011)، "Music performance anxiety-part 2. a review of treatment options"، Med Probl Perform Art، 26 (3): 164–71، PMID 21987072.
- Fitch K (2012)، "Proscribed drugs at the Olympic Games: permitted use and misuse (doping) by athletes"، Clin Med، 12 (3): 257–60، doi:10.7861/clinmedicine.12-3-257، PMC 4953490، PMID 22783779.
- Lilley LL, Collins SR, Snyder JS (2014)، Pharmacology and the Nursing Process (ط. 7th)، Elsevier Health Sciences، ص. 313–316، ISBN 978-0-323-29361-7.
- Campschroer, Thijs؛ Zhu, Xiaoye؛ Vernooij, Robin Wm؛ Lock, Mtw Tycho (5 أبريل 2018)، "Alpha-blockers as medical expulsive therapy for ureteral stones"، The Cochrane Database of Systematic Reviews، 4: CD008509، doi:10.1002/14651858.CD008509.pub3، ISSN 1469-493X، PMC 6494465، PMID 29620795.
- Green B (2014)، "Prazosin in the treatment of PTSD"، J Psychiatr Pract، 20 (4): 253–9، doi:10.1097/01.pra.0000452561.98286.1e، PMID 25036580.
- Corazza O, Martinotti G, Santacroce R, Chillemi E, Di Giannantonio M, Schifano F, Cellek S (2014)، "Sexual enhancement products for sale online: raising awareness of the psychoactive effects of yohimbine, maca, horny goat weed, and Ginkgo biloba"، Biomed Res Int، 2014: 1–13، doi:10.1155/2014/841798، PMC 4082836، PMID 25025070.
- EFSA Panel on Food Additives and Nutrient Sources Added to Food (2013)، "Scientific Opinion on the evaluation of the safety in use of Yohimbe"، EFSA Journal، 11 (7): 3302، doi:10.2903/j.efsa.2013.3302.
- Belkin MR, Schwartz TL (2015)، "Alpha-2 receptor agonists for the treatment of posttraumatic stress disorder"، Drugs Context، 4: 1–5، doi:10.7573/dic.212286، PMC 4544272، PMID 26322115.
- Greene SA, Thurmon JC (1988)، "Xylazine—a review of its pharmacology and use in veterinary medicine"، J. Vet. Pharmacol. Ther.، 11 (4): 295–313، doi:10.1111/j.1365-2885.1988.tb00189.x، PMID 3062194.
- Lump D, Moyer M (2014)، "Paroxysmal sympathetic hyperactivity after severe brain injury"، Curr Neurol Neurosci Rep، 14 (11): 494، doi:10.1007/s11910-014-0494-0، PMID 25220846.
- Amzallag M (1993)، "Autonomic hyperreflexia"، Int Anesthesiol Clin، 31 (1): 87–102، doi:10.1097/00004311-199331010-00009، PMID 8440534.
- McCrink KA, Brill A, Lymperopoulos A (2015)، "Adrenal G protein-coupled receptor kinase-2 in regulation of sympathetic nervous system activity in heart failure"، World J Cardiol، 7 (9): 539–43، doi:10.4330/wjc.v7.i9.539، PMC 4577680، PMID 26413230.
- Malpas SC (2010)، "Sympathetic nervous system overactivity and its role in the development of cardiovascular disease"، Physiol. Rev.، 90 (2): 513–57، doi:10.1152/physrev.00007.2009، PMID 20393193.
- Ksiazek A, Załuska W (2008)، "Sympathetic overactivity in uremia"، J Ren Nutr، 18 (1): 118–21، doi:10.1053/j.jrn.2007.10.024، PMID 18089457.
- Kooij SJ, Bejerot S, وآخرون (2010)، "European consensus statement on diagnosis and treatment of adult ADHD: The European Network Adult ADHD"، BMC Psychiatry، 10: 67، doi:10.1186/1471-244X-10-67، PMC 2942810، PMID 20815868.
- Faraone SV, Bonvicini C, Scassellati C (2014)، "Biomarkers in the diagnosis of ADHD--promising directions"، Curr Psychiatry Rep، 16 (11): 497، doi:10.1007/s11920-014-0497-1، PMID 25298126.
- Bello NT (2015)، "Clinical utility of guanfacine extended release in the treatment of ADHD in children and adolescents"، Patient Prefer Adherence، 9: 877–85، doi:10.2147/PPA.S73167، PMC 4494608، PMID 26170637.
- Clemow DB, Bushe CJ (2015)، "Atomoxetine in patients with ADHD: A clinical and pharmacological review of the onset, trajectory, duration of response and implications for patients"، J. Psychopharmacol. (Oxford)، 29 (12): 1221–30، doi:10.1177/0269881115602489، PMID 26349559.
- Shibao C, Okamoto L, Biaggioni I (2012)، "Pharmacotherapy of autonomic failure"، Pharmacol. Ther.، 134 (3): 279–86، doi:10.1016/j.pharmthera.2011.05.009، PMC 3358114، PMID 21664375.
- Pflüger HJ, Stevensonb PA (2005)، "Evolutionary aspects of octopaminergic systems with emphasis on arthropods"، Arthropod Structure & Development، 34 (3): 379–396، doi:10.1016/j.asd.2005.04.004، مؤرشف من الأصل في 23 فبراير 2020.
- Kass-Simon G, Pierobon P (2007)، "Cnidarian chemical neurotransmission, an updated overview"، Comp. Biochem. Physiol., Part a Mol. Integr. Physiol.، 146 (1): 9–25، doi:10.1016/j.cbpa.2006.09.008، PMID 17101286.
- Moroz LL (2015)، "Convergent evolution of neural systems in ctenophores"، J. Exp. Biol.، 218 (Pt 4): 598–611، doi:10.1242/jeb.110692، PMC 4334147، PMID 25696823.
- Verlinden H, Vleugels R, Marchal E, Badisco L, Pflüger HJ, Blenau W, Broeck JV (2010)، "The role of octopamine in locusts and other arthropods"، J. Insect Physiol.، 56 (8): 854–67، doi:10.1016/j.jinsphys.2010.05.018، PMID 20621695.
- Bacq ZM (1983)، "Chemical transmission of nerve impulses"، في Parnham MJ, Bruinvels J (المحررون)، Discoveries in Pharmacology, Volume 1، Amsterdam: Elsevier، ص. 49–103، ISBN 978-0-444-80493-8.
- Herman Blaschko (1987)، "A half-century of research on catecholamine biosynthesis"، Journal of Applied Cardiology: 171–183.
- P. Holtz (1939)، "Dopadecarboxylase"، Die Naturwissenschaften (باللغة الألمانية)، 27 (43): 724–725، Bibcode:1939NW.....27..724H، doi:10.1007/bf01494245.
- von Euler US (1945)، "A sympathomimetic pressor substance in animal organ extracts"، Nature، 156 (3949): 18–19، Bibcode:1945Natur.156...18V، doi:10.1038/156018b0.
باللغة العربيَّة
- "ترجمة (Norepinephrine) في موقع القاموس"، www.alqamoos.org، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 30 نوفمبر 2019.
- "ترجمة (Norepinephrine) في قاموس العلوم المصور الجديد"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 30 نوفمبر 2019.
- "ترجمة (Norepinephrine) في معجم الصيدلة الموحد"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 30 نوفمبر 2019.
- "ترجمة (Norepinephrine) في معجم مرعشي الطبي الكبير"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 30 نوفمبر 2019.
- "ترجمة (Norepinephrine) في المعجم الطبي الموحد"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 30 نوفمبر 2019.
- "ترجمة (Noradrenaline) في المعجم الطبي الموحد"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 30 نوفمبر 2019.
- "ترجمة (Noradrenaline) في معجم مرعشي الطبي الكبير"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 30 نوفمبر 2019.
- "ترجمة (Noradrenaline) في قاموس العلوم المصور الجديد"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 30 نوفمبر 2019.
- "ترجمة (Noradrenaline) في المعجم الصيدلي الموحد"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 30 نوفمبر 2019.
- "ترجمة (Noradrenaline) في موقع القاموس"، www.alqamoos.org، مؤرشف من الأصل في 17 ديسمبر 2019، اطلع عليه بتاريخ 30 نوفمبر 2019.
- "ترجمة (Sympathin) في القاموس الطبي"، مكتبة لبنان ناشرون، مؤرشف من الأصل في 18 ديسمبر 2019، اطلع عليه بتاريخ 1 ديسمبر 2019.
وصلات خارجية
- بوابة الكيمياء
- بوابة طب
- بوابة علوم عصبية
- بوابة صيدلة
- بوابة الكيمياء الحيوية
