منغنيز
المنغنيز [ملاحظة 1] عنصرٌ كيميائي رمزه Mn وعدده الذرّي 25، وهو ينتمي إلى عناصر المستوى الفرعي d ويقع على رأس عناصر المجموعة السابعة في الجدول الدوري؛ ويصنّف كيميائياً ضمن الفلزّات الانتقالية. المنغنيز فلزٌّ صلدٌ مساميّ ذو لون رمادي فضّي؛ وهو يوجد في الطبيعة في العديد من المعادن، وعلى الأغلب مرافقاً للحديد. كان يوهان غوتليب غان من الرائدين في اكتشاف هذا العنصر، إذ تمكّن سنة 1774 من عزله بشكله الحرّ باختزال أكسيده بالكربون (الفحم)؛ وهناك صلة وصلٍ بين تسميته على هذا الشكل وبين تسمية عنصر المغنيسيوم، وكذلك بين تسمية معدن المغنيتيت (حجر المغناطيس).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | منغنيز، 25، Mn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 7، 4، d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 54.938045 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ar]; 4s2 3d5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 13, 2 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 7.21 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 5.95 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1519 ك، 1246 °س، 2275 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 2334 ك، 2061 °س، 3742 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 12.91 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 221 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 26.32 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 7, 6, 5, 4, 3, 2, 1, -1, -2, -3 (أكاسيده إما حمضية أو قاعدية أو مذبذبة وذلك حسب حالة الأكسدة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.55 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 717.3 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1509.0 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3248 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 127 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | (لف مغزلي منخفض) 139±5 ،
(لف مغزلي مرتفع) 161±8 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الجسم | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية مسايرة | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 1.44 ميكروأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 7.81 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 21.7 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 5150 متر/ثانية (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 198 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 120 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 6.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 196 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7439-96-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر المنغنيز | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
يدخل المنغنيز في العديد من التطبيقات، وأهمّها استخدامه مكوّناً في السبائك، وخاصّةً على شكل سبيكة فرّومنغنيز في صناعة الفولاذ المقاوم للصدأ. يحسّن المنغنيز عند إضافته للسبائك من المتانة، ومن قابلية التصنيع ومقاومة الاهتراء. لمركّبات المنغنيز أيضاً تطبيقات واسعة، إذ يعدّ ثنائي أكسيد المنغنيز من المؤكسدات القويّة، ولذلك يدخل في تركيب البطّاريات القلوية؛ كما يُستخدَم أيضاً في صناعة الزجاج والخزف والسيراميك.
للمنغنيز دورٌ حيويٌّ مهمٌّ في عملية التركيب الضوئي، إذ يساهم مع الكالسيوم في تكوين معقّدٍ عنقوديّ ضروريّ من أجل أكسدة الماء إلى الأكسجين. يعدّ المنغنيز من المغذّيات الأساسية، فهو يساهم في استقلاب المغذّيات الكبرى، وفي تشكّل العظام، وفي دعم جهاز المناعة ضد الجذور الكيميائية الحرّة؛ كما أن وجوده ضروري لعمل عددٍ من البروتينات، ويوجد في المواقع النشطة لبعض الإنزيمات. يتركّز وجود المنغنيز في جسم الإنسان في العظام وفي الكبد والكليتين؛ كما يرتيط هذا العنصر مع البروتينات الفلزّية، مثل الإنزيم المخلّق للغلوتامين، في الخلايا النجمية في الدماغ البشري.
التاريخ وأصل التسمية
- أصل التسمية
إنّ أصل تسمية هذا العنصر معقّد، فللاسم «منغنيز» جذورٌ مرتبطةٌ بالكلمة الإغريقية «Μαγνησία» (مغنيسيا)، وهو الجذر نفسه الذي سُمّي على أساسه عنصر المغنيسيوم. ففي العصور القديمة، جرى التمييز بين مَعدَنين أسوَدَين كانا يُجلبَان من المناطق التي سكنتها قبيلة مَغْنيت [ملاحظة 2] اليونانية القديمة، وذلك إمّا في منطقة في اليونان القديمة تدعى مغنيسيا، والتي تقع حالياً في إقليم ثيساليا، أو إلى مدنٍ مندثرةٍ حملت نفس الاسم مثل مغنيسيا (على جبل سيبيلوس) [ملاحظة 3] أو مغنيسيا (على نهر مندريس) [ملاحظة 4] والواقعة حالياً في تركيا.[1] لذلك حَمَل ذانِكَ المعدنان اسم «مَغْنِس» [ملاحظة 5]، وكان يُميَّز بينهما بوصف أحدهما بالذكر والآخر بالأنثى، فالنوع الذكر منهما قادرٌ على جذب الحديد، بالتالي، فهو وفق المفاهيم العلمية الحديثة خام المغنيتيت [ملاحظة 6] المغناطيسي؛ أمّا النوع الأنثى فهو غير قادر على جذب الحديد، وكان يستخدم من أجل إزالة تلوّن الزجاج؛[2] بالتالي، فهو وفق المفاهيم العلمية الحديثة خام البيرولوسيت [ملاحظة 7]، المتكوّن كيميائياً من ثنائي أكسيد المنغنيز.[3] أطلقَ صُنّاع الزجاج على ثنائي أكسيد المنغنيز في القرن السادس عشر اسم «منغنيزوم» [ملاحظة 8]، وذلك ربّما من دمج كلمتَين اثنتَين، إذ كان ينبغي التمييز أيضاً بين الخامات القادمة من مغنيسيا، وذلك بين خامة «مغنيسيا نيغرا» [ملاحظة 9] السوداء، وبين خامة «مغنيسيا ألبا» [ملاحظة 10] البيضاء، التي كانت مفيدةً أيضاً في صناعة الزجاج. بالتالي اندمج حرف «ن» من كلمة «نيغرا» فأصبح هناك حرفا نون في الاسم؛ وعلى هذا النسق أطلق العالم ميكيلي مركاتي [ملاحظة 11] على خامة «مغنيسيا نيغرا» اسم«منغنيزا» [ملاحظة 12]؛ وفي نهاية المطاف، أصبح الفلزَ المُستخرَج من خامة «مغنيسيا نيغرا» السوداء يُعرَف باسم «منغنيز»؛ في حين أنّ الفلزّ المُستخرَج من خامة «مغنيسيا ألبا» البيضاء (أكسيد المغنيسيوم) يُعرَف باسم «مغنيسيوم».[3]
- العصور القديمة والوسطى
ينتشر ثنائي أكسيد المنغنيز في الطبيعة بشكلٍ كبير، ولذلك استُخدَم منذ العصر الحجري على شكل خضاب أسود. وقد عُثرَ على رسومات تعود إلى ذلك العصر في كهوفٍ عدّة في جنوبي غربي أوروبا، مثل الرسومات في كهف إكاين [ملاحظة 13] في إسبانيا؛ وكذلك الرسومات في كهف لاسكو [ملاحظة 14]، وفي كهف غارغاس [ملاحظة 15] في فرنسا، والتي قُدّرَ أنّها تعود إلى 30-24 ألف سنة خلت.[5] استخدم المصريون القدماء ومن بعدهم الرومان مركّبات المنغنيز، إمّا لإضافة الألوان إلى الزجاج أو لإزالتها منه؛[6] وقد امتدّ هذا الاستخدام خلال العصور الوسطى على شكل «صابون صناع الزجاج» [ملاحظة 16]، كما يتّضح من الزجاج العائد إلى القرن الرابع عشر من البندقية.[7]
- العصور الحديثة

في القرن الثامن عشر أجريت تجارب عدّة على مركّبات المنغنيز، وخاصّةً على مركّب ثنائي أكسيد المنغنيز نظراً لاستخدامه في صناعة الزجاج، إذ كان متاحاً ومتوفّراً بسهولة. فاكتشف الباحثان إغناطيوس غوتفريد كايم [ملاحظة 17] ويوهان رودولف غلاوبر [ملاحظة 18] أنّه يمكن تحويل ثنائي أكسيد المنغنيز إلى بيرمنغنات، وهو كاشف كيميائي مهمٌّ ومفيدٌ في المختبرات.[8] وكان كارل فلهلم شيله [ملاحظة 19] قد استخدم ثنائي أكسيد المنغنيز على شكل البيرولوسيت في إنتاج غاز الكلور؛ وذلك عن طريق معالجة الأكسيد بحمض الهيدروكلوريك؛ والذي كان يُستحصَل أوّلاً من تفاعل حمض الكبريتيك الممدّد (زيت الزاج) مع كلوريد الصوديوم (ملح الطعام)، ثمّ لاحقاً من عملية لوبلان [ملاحظة 20]؛ أمّا الأكسيد فكان يعاد تدويره وفق عملية ولدون [ملاحظة 21]. مَثَّلَ إنتاج الكلور ومساحيق الهيبوكلوريت المبيضة مجالاً واسعاً لاستخدام خامات المنغنيز تجارياً. كانت الشكوك تحوم على احتواء معدن البيرولوسيت على عنصرٍ جديدٍ لم يكن مكتشفاً حينئذ، وذلك ما كان شيله وآخرون مدركين له؛ ولكنّ عزْلَ هذا العنصر لأوّل مرّة كان على يد يوهان غوتليب غان [ملاحظة 22]، والذي تمكّن من ذلك عندما عالج أكسيد المنغنيز بالفحم (الكربون)، ممّا أدّى إلى اختزاله والحصول على عيّنة غير نقيّة من الفلزّ.[8]
استُخدمَت خامات الحديد ذات المحتوى المرتفع من المنغنيز المُستَجلبة من اليونان منذ بدايات صناعة الفولاذ، وقد وجد أنّ ذلك يزيد من صلادته؛[9] وفي بداية القرن التاسع عشر أصبح استخدام المنغنيز في هذا المجال، مثل دخوله في عملية بسمر [ملاحظة 23]، من أساسيّات تلك الصناعة،[10] ومُنحَت العديد من براءات الاختراع في هذا الصدد؛[11] مثلما فعل روبرت هادفيلد [ملاحظة 24] عند تطويره لسبيكة فولاذ المنغنيز.[12] بدأت الأبحاث تُنشَر حول دور المنغنيز في الصناعة؛ كما ساهم اختراع خلية لوكلانشيه [ملاحظة 25] الكهربائية والتطوّر المستمرّ اللاحق للبطّاريات الحاوية على ثنائي أكسيد المنغنيز في ازدياد الطلب العالمي عليه.[13] يؤدّي التعرّض المزمن والمستمرّ إلى غبار المنغنيز أو أبخرته إلى حدوث اضطراب عصبي؛ وقد ظهرت هذه الحالة تاريخياً مع بداية تعدين واستخراج المنغنيز الخام من المناجم ومع إنتاج سبائكه؛ إذ بدأت تظهر حالات توعّك للعمّال إبّان التعرّض لهذا الفلزّ.[14][15] تعُرَف هذه الحالة باسم التسممّ بالمنغنيز، وكان الأكاديمي جون كوبر [ملاحظة 26] أوّل من وصف هذا الاضطراب سنة 1837.[16]
الوفرة الطبيعية

لا يوجد المنغنيز بشكله العنصري الحرّ في الطبيعة، ولكنه يدخل في تركيب العديد من المعادن. تبلغ نسبة المنغنيز في القشرة الأرضية مقدار 950 جزء في المليون [ملاحظة 27]، أي ما يعادل حوالي 0.1%؛[17] وذلك بشكلٍ مقاربٍ لوفرة عُنصرَي الفوسفور والفلور. بعد الحديد والتيتانيوم يعدّ المنغنيز ثالث الفلزّات الانتقالية من حيث الوفرة؛ كما يعدّ العنصر الثاني عشر وفقاً لترتيب العناصر في القشرة الأرضية. تحتوي التربة على نسبة متفاوتة من المنغنيز تتراوح بين 7–9000 جزء في المليون، وذلك بنسبة وسطية تبلغ 440 جزء في المليون.[18] تحوي مياه البحار على نسبةٍ ضئيلةٍ من المنغنيز، وهي تبلغ مقدار حوالي 10 أجزاء في المليون؛ في حين أنّ الغلاف الجوّي للأرض يحوي على تركيز من المنغنيز مقداره 0.01 ميكروغرام/م3.[18]
توجد هناك معادن مختلفة للمنغنيز، منها المنغنيت [ملاحظة 28] والهاوسمانيت [ملاحظة 29] والرودونيت [ملاحظة 30] والبيرولوسيت [ملاحظة 31] والبراونيت [ملاحظة 32]؛[19] بالإضافة إلى معادن أخرى أقلّ انتشاراً مثل سيلوميلان [ملاحظة 33] ورودوكروسيت.[ملاحظة 34] يعدّ خام البيرولوسيت، والمتكوّن كيميائياً من ثنائي أكسيد المنغنيز MnO2، من أهمّ خامات المنغنيز اقتصادياً؛ كما يمكن أن يوجد على شكل عنصرٍ مرافقٍ للحديد في خاماته، مثل السفاليريت.[20][21] تتركّز حوالي 80% من خامات المنغنيز في جنوب أفريقيا؛ وخاصّةً في صحراء كالاهاري في مقاطعة كيب الشمالية، والتي تُقدَّر الاحتياطات فيها بمقدار 15 بليون طنّ. استُخرجَ من جنوب أفريقيا في سنة 2011 مقدار 3.4 مليون طنّ من هذا الفلزّ؛ ولكن توجد توضّعات رسوبية مهمّة في بلدان أخرى، مثل أوكرانيا وأستراليا والهند والصين والغابون وغانا والبرازيل وكازاخستان وماليزيا.[22]

في الغلاف الصخري
يوجد المنغنيز في التربة في ثلاث حالات أكسدة؛ وهي المنغنيز ثنائي التكافؤ على شكل أيون منحلّ 2+Mn؛ وكذلك على شكل منغنيز ثلاثيّ ورباعيّ التكافؤ على هيئة أكاسيد وهيدروكسيدات صلبة صعبة الانحلال مثل MnOOH وMnO2. تؤثّر قيمة pH التربة وحالة التهوية على طبيعة النوع الكيميائي للمنغنيز في حالات الأكسدة المذكورة؛ فعند قيمة pH أقلّ من 6 وعند ظروف لاهوائية، فإنّ المنغنيز الثنائي يكون مسيطراً؛ أمّا عند ظروف هوائية أكثر قاعدية فإنّ أكاسيد وهيدروكسيدات المنغنيز الثلاثي والرباعي تكون سائدة. بشكلٍ غير مباشر يمكن للنشاط الميكروبي في الوسط أن يؤثّر على حموضة أو على حالة تهوية التربة، وبالتالي على نوع المنغنيز السائد في الوسط.[23]
توجد أكاسيد المنغنيز الثلاثي والرباعي على هيئة لَطخات بنّية إلى سوداء، وكذلك على شكل عُقَيدَات صغيرة على جسيمات الرمل والغِرْيَن [ملاحظة 35] والغُضَار. يكون لهذه التغطيات السطحية على الجسيمات الأخرى مساحة سطح مرتفعة، وتكون حاملةً للشحنة الكهربائية السالبة. تستطيع تلك المواقع المشحونة أن تمتزّ وتبقي العديد من الكاتيونات (الأيونات موجبة الشحنة) قريبةً من السطح، وخاصّةً كاتيونات الفلزّات مثل الكروم أو النحاس أو الزنك أو الرصاص؛ كما يمكن لها أن تقوم بامتزاز أحماض عضوية ومركّبات أخرى. تساعد هذه الظروف على حدوث تفاعلات أكسدة واختزال، مثل اختزال أكاسيد المنغنيز الثلاثي والرباعي إلى المنغنيز الثنائي، وأكسدة الكروم الثلاثي إلى رباعي، والهيدروكينون عديم اللون إلى بوليميرات الكينون ذات اللون البنّي المحمرّ.[24]
في الغلاف المائي

ترتفع نسبة وفرة العديد من العناصر في المحيطات بالقرب من المنافس المائية الحرارية؛[25] والتي يكون المنغنيز بالقرب منها غالباً على شكلٍ منحلّ [ملاحظة 36]؛[26] أو على شكل جُسيمات معلّقة [ملاحظة 37]، والتي يتطوّر تشكلّها في أعمدة الغازات الطافية [ملاحظة 38] فوق مصدر المنفس المائي الحراري النشط.[25] يرتفع عادةً تركيز المنغنيز المنحلّ بالقرب من السطح وبالقرب من المناطق الساحلية، وذلك يعود إلى وجود موارد خارجية إضافية من مياه الأنهار التي تصبّ في البحار والمحيطات، وكذلك من جسيمات الغبار المحمولة بالرياح، ومن رسوبيات الرفّ القاري، وكذلك من الأنشطة البشرية مثل تعدين المنغنيز وصناعة الفولاذ على اليابسة. بالمقابل، يمكن أن يرتفع تركيز المنغنيز المنحلّ طبيعياً من النشاط الحيوي عبر التركيب الضوئي؛ وكذلك من تفاعلات الأكسدة والاختزال المُحَفَّزة بالأشعّة فوق البنفسجية، والتي تساعد على التدوير الداخلي [ملاحظة 39] من خلال تسريع عملية تذاوب [ملاحظة 40] أكاسيد المنغنيز والكسح التأكسدي [ملاحظة 41]، ممّا يمنع من هبوط المنغنيز إلى أعماق أكبر.[27]
هناك كمّيّات وفيرة من المنغنيز في قيعان البحار والمحيطات، وذلك على هيئة عُقَيدات كرويّة من المنغنيز [ملاحظة 42]؛[28][29] ووفقاً لإحدى التقديرات يوجد منها هناك حوالي 500 بليون طنّ في كافّة أرجاء العالم.[30] وهي كتل متحجّرة مسامية مؤلّفة من أكاسيد عدّة فلزات؛ وتحوي وسطياً على حوالي 30% من المنغنيز؛[31] وظهرت دراسات مختلفة من أجل تقييم احتمالية استخراج المنغنيز منها، وخاصّةً في سبعينيات القرن العشرين بعد الإعلان عن مشروع أزوريان من الولايات المتّحدة؛[32] ليتبيّن فيما بعد أنّ هدف المشروع كان عملية استخباراتية عسكرية لانتشال غواصة K-129 السوفيتية.[33] بالنهاية؛ وُجِدَ أنّ فكرة استخراج المنغنيز من العُقَيدات المنتشرة في باطن البحار والمحيطات غير مجدية اقتصادياً؛[34][35] وعلاوةً على ذلك، فإنّها تعود بأضرار بيئية جسيمة على الحياة البحريّة.[36][37]
الاستخراج والإنتاج

تحوي خامات المنغنيز على محتوى يتراوح وسطياً بين 38% إلى 55% من هذا الفلزّ؛ وغالباً ما تُستخرَج الخامات إمّا وفق أسلوب التعدين السطحي أو وفق أسلوب تعدين الغرف والأعمدة.[ملاحظة 43] اعتماداً على التطبيق المستقبلي فإنّه عادةً ما يُميَّز بين صِنفَين من خامات المنغنيز؛ فالأوّل هو صنف درجة البطّارية،[ملاحظة 44] والحاوي على 44% من المنغنيز على الأقلّ في تركيبه، بالإضافة إلى نسبٍ ضئيلةٍ فقط من فلزّات أخرى، مثل النحاس والنيكل والكوبالت، ممّا يُمَكّن من استخدامه في صناعة البطّاريات القلوية؛ أمّا الآخر فهو صنف الدرجة الكيميائية [ملاحظة 45]، والمُستخدَم من أجل إنتاج المنغنيز النقيّ ومركّبات المنغنيز الكيميائية المختلفة.[35] من أجل الحصول على سبيكة الفرّومنغنيز الحديدية، تُمزَج خامة المنغنيز مع خامة الحديد والكربون في فرنٍ لافحٍ أو فرن القوس الكهربائي، حيث يحدث تفاعل اختزال؛[10] ويتراوح محتوى المنغنيز في هذه السبيكة من 30 إلى 80%.[20] كما يمكن الحصول على سبيكة سيليكومنغنيز [ملاحظة 46] عند إضافة الكوارتز مصدراً للسيليكون إلى الخامة.[35]
لا يمكن الحصول على فلزّ المنغنيز اللازم من أجل إنتاج السبائك الخالية من الحديد من الاختزال المباشر بالكربون، لأنّ هذا الفلزّ يُشكّل كربيدات مستقرّة مثل مركّب Mn7C3؛ ويتطلّب الأمر رفع درجة الحرارة إلى حوالي 1600 °س، وذلك غير مجدٍ اقتصادياً. لذلك يُعمَد إلى اتّباع وسائل علم الفلزّات المائي من أجل استحصال فلزّ المنغنيز،[38] وذلك عبر عملية تصويل خام المنغنيز بحمض الكبريتيك.[39] تُجرَى عملية التصويل تدريجياً باختزال خامة المنغنيز المُكوَّم مباشرةً، وذلك من خلال تخليل الغاز الطبيعي المشتعل أسفل الكومة، ممّا يؤمّن مصدراً حرارياً، والذي ينبغي أن تكون درجة حرارته على الأقلّ 850 °س، كما يؤمّن وجود عامل مختزل من أحادي أكسيد الكربون؛ ممّا يساعد على اختزال خامة المنغنيز إلى أكسيد المنغنيز الثنائي بشكلٍ أوّليّ ومنه إلى المنغنيز النقي لاحقاً. كما يساعد طحن الخامة بشكلٍ ناعمٍ إلى جسيمات يتراوح أحجامها بين 150-250 ميكرومتر على زيادة مساحة السطح، ممّا يرفع من كفاءة التصويل. ثمّ يُعالَج المسحوق مع حمض الكبريتيك وبوجود أملاح الحديد الثنائي بنسبة 1.6:1؛ فيتفاعل الحديد مع أكسيد المنغنيز الثنائي ليُستحصَل على المنغنيز الفلزّي بالإضافة إلى أكسيد هيدروكسيد الحديد الثلاثي؛ وتعطي هذه العملية مردوداً بنسبة 92% من المنغنيز.[40] بعد ذلك تُطبَّق عملية استخلاص كهربائي من أجل عمليات التنقية اللاحقة، ويُستخدَم لذلك الغرض محلولٌ نقيٌّ من كبريتات المنغنيز الثنائي، والذي يخضع إلى تحليل كهربائي في خلية أقطابها من الفولاذ عند فرق جهد يقع بين 5-7 فولت. يُجمَع المنغنيز النقيّ من على المِهبَط، في حين يتشكّل الأكسجين على المِصعَد.[35]
النظائر
للمنغنيز ستّة وعشرون نظيراً تتراوح أعدادها الكتلية بين 44 و 69 وحدة متل ذرّية؛ من بينها نظيرٌ مستقرٌّ طبيعيّ وحيد، وهو النظير منغنيز-55 55Mn؛ مع وجود نظيرٍ مشعٍّ شبه مستقرّ وهو منغنيز-53 53Mn بعمر نصف مقداره 3.7 مليون سنة. أمّا النظائر المشعّة المتبقيّة فأكثرها استقراراً هو منغنيز-54 54Mn بعمر نصف 312.3 يوم؛ والنظير منغنيز-52 52Mn بعمر نصف 5.591 يوم. لباقي نظائر المنغنيز المشعّة أعمار نصف أقلّ من ثلاث ساعات، وأغلبها دون الدقيقة الواحدة. أمّا أقلّ نظائر المنغنيز المشعّة عمراً هو النظير منغنيز-44 بعمر نصف أقلّ من 105 نانو ثانية. هنالك ثلاث مُصاوغات نووية للمنغنيز. إنّ نمط الاضمحلال لنظائر المنغنيز المشعّة التي لها عدد كتلة أقلّ من النظير المستقرّ 55Mn هو على شكل التقاط إلكترون؛ في حين يكون للنظائر الأعلى على شكل اضمحلال بيتّا.[41]
ينتمي المنغنيز إلى مجموعة العناصر الكيميائية التي يُظنّ أنّها خضعت إلى عمليات تخليق داخل النجوم الكبرى في فترة زمنية وجيزة قبل انفجار المستعرات العظمى في الكون.[42] رغم أنّ النظير منغنيز-53 53Mn شبه مستقرّ، ولكنّه يضمحلّ بعد 3.7 مليون سنة إلى نظير الكروم-53 53Cr، ولذلك فإنّ وفرته في الكون قليلة نسبياً، وهو ينشأ من أثر الأشعّة الكونية على الحديد.[43][44]
يساهم تحديد نسبة وفرة نظائر المنغنيز إلى نظائر الكروم في الأحجار النيزكية عبر أساليب جيوكيمياء النظائر والتأريخ الإشعاعي من أجل تقدير عمر الكون.[45]
الخواص الفيزيائية
يوجد المنغنيز في الحالة النقيّة على هيئة فلزٍّ ذي لون رمادي فضّي؛ وهو صلد لكنّه هشّ جدّاً وقابل للتقصّف؛ لكنّه يفقد بريقه ولمعانه عند التعرّض لأكسجين الهواء وفي الظروف مرتفعة الرطوبة، إذ يتأكسد بسهولة.[20] ينصهر المنغنيز عند الدرجة 1246 °س؛ ويغلي عند الدرجة 2100 °س.[46]
على العكس من أغلب باقي الفلزّات الأخرى لا يتبلور المنغنيز عند درجة حرارة الغرفة وفق تعبئة متراصّة أو وفق نظام بلّوري مكعّب مركزي الجسم، إنّما في بنية بلّورية مكعّبة غير نمطية. على العموم، توجد هناك أربعة أشكال مختلفة مستقرّة يتبلور عليها المنغنيز عند درجات حرارة متفاوتة. فعند درجة حرارة الغرفة يكون المنغنيز وفق البنية α (ألفا). تكون بنية المنغنيز من الشكل ألفا مستقرّة من الناحية الديناميكية الحرارية (الثرموديناميكية) حتّى درجات حرارة تصل إلى 727 °س؛[47] وهي بنية مكعّبة مشوّهة يصل فيها عدد الذرّات داخل وحدة الخلية إلى 58 ذرّة؛ وهي تكون مُجَمّعة على هيئة أربع زُمَر متفاوتة المحيط، وذات عدد تناسقي يقع بين 12-16.[48] عند درجات حرارة تقع في المجال بين 727 °س إلى 1095 °س فإنّ البنية البلورية للمنغنيز تتبع النمط β (بيتّا)، وهي بنية مكعّبة مشوّهة أيضاً، وهي ذات عشرون وحدة صيغة لكلّ وحدة خلية، ويقع العدد التناسقي لها بين 12-14.[49] تبدأ البنية البلّورية للمنغنيز بأخذ شكل التعبئة المتراصّة عند درجات حرارة تفوق 1095 °س، وهو النمط γ (غامّا)، وهو نمط بلّوري مكعّب مركزي الوجوه، وهو نمط تبلْور النحاس. أمّا عند درجات حرارة تفوق 1133 °س تتغيّر البنية إلى نظام بلّوري مكعّب مركزي الجسم، والذي يرمز له بالرمز δ (دلتا)، وهو نمط تبلْور التنغستن.[47]
يتميّز المنغنيز على العموم بأنّه ذو مغناطيسية مسايرة؛[50] ويكون على ذلك في النمط ألفا؛ ولكنه يصبح عند درجة حرارة نييل [ملاحظة 47]، والتي تبلغ 100 كلفن بالنسبة للمنغنيز، ذات خواص مغناطيسية حديدية مضادّة؛ وتلك ظاهرة لا يبديها الشكل بيتّا.[51]
| نمط التبلور | α-Mn[48] | β-Mn[49] | γ-Mn[52] | δ-Mn[52] |
|---|---|---|---|---|
| شكل البنية |  |  | 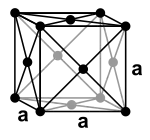 | 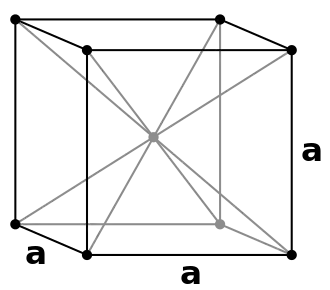 |
| نظام التبلور | مكعب | مكعب | مكعب | مكعب |
| العدد التناسقي | 16+16+13+12 | 14+12 | 12 | 8 |
| الزمرة الفراغية | I43m | P4132 | Fm3m | Im3m |
| ثابت الشبكة البلورية | 891.1 بيكومتر | 631.5 بيكومتر | 386.3 بيكومتر | 308.1 بيكومتر |
| عدد الذرات لكل وحدة خلية | 58 | 20 | 4 | 2 |
| الكثافة النظرية | 7.463 غ/سم3 | 7.24 غ/سم3 | 6.33 غ/سم3 | 6.238 غ/سم3 |
الخواص الكيميائية
ينتمي المنغنيز كيميائياً إلى مجموعة الفلزّات الانتقالية في الجدول الدوري؛ وهو لا ينتمي إلى الفلزّات النبيلة، بالتالي فهو فلزٌّ وضيع. فعلى سبيل المثال يتفاعل المنغنيز مع الأكسجين ببطء وتتشكّل طبقة من الأكسيد على سطحه، في حين أنّ مسحوق المنغنيز الناعم يكون تلقائي الاشتعال في وسطٍ من الأكسجين، ويتحوّل بسرعة إلى أكسيد المنغنيز الثنائي والثلاثي Mn3O4. يتفاعل المنغنيز أيضاً مع العديد من اللا فلزّات مثل الفلور والكلور والبور والفوسفور والكربون والسيليكون والزرنيخ والكبريت؛ وتكون تلك التفاعلات الكيميائية بطيئة عند درجة حرارة الغرفة، ويرتفع معدّل التفاعل عند زيادة درجة الحرارة. يتفاعل المنغنيز مع النتروجين عند درجات حرارة تتجاوز 1200 °س إلى نتريد المنغنيز Mn3N2؛ في حين لا يتفاعل مع الهيدروجين.[20][53]
كما هو الحال مع باقي الفلزّات غير النبيلة فإنّ المنغنيز ينحلّ في الأحماض الممدّدة مع انطلاق غاز الهيدروجين نتيجةً لذلك؛ ولكن على العكس من الكروم فإنّه لا تتشكّل طبقة مُخَمّلة من الأكسيد على السطح. من جهةٍ أخرى، فعند حلّ المنغنيز في حمض الكبريتيك المركّز تتشكّل كبريتات المنغنيز وينطلق غاز ثنائي أكسيد الكبريت. هناك عددٌ معتبرٌ من مركّبات المنغنيز اللاعضوية، بالإضافة إلى وجود معقّدات تناسقية من مركّبات المنغنيز العضوية.
المركبات الكيميائية بحالات الأكسدة المختلفة
| حالات الأكسدة المختلفة للمنغنيز مع أمثلة عليها في مركّباته الكيميائية[54] | |
|---|---|
| 0 | Mn2(CO)10 |
| +1 | MnC5H4CH3(CO)3 |
| +2 | MnCl2؛ MnCO3؛ MnO |
| +3 | MnF3؛ Mn2O3 |
| +4 | MnO2 |
| +5 | K3MnO4 |
| +6 | K2MnO4 |
| +7 | KMnO4؛ Mn2O7 |
مثل باقي الفلزّات الانتقالية يمكن للمنغنيز أن يوجد في حالات أكسدة مختلفة في مركّباته الكيميائية؛ أكثرها شيوعاً هي +2 و +3 و +4 و +6 و +7. تتغيّر ألوان محاليل المنغنيز المائية باختلاف حالات الأكسدة؛ فلون محاليل المنغنيز الثنائي ذات لون وردي، ومحاليل المنغنيز الثلاثي ذات لون أحمر، ومحاليل المنغنيز الرباعي ذات لون بنّي، ومحاليل المنغنيز الخماسي ذات لون أزرق، ومحاليل المنغنيز السداسي ذات لون أخضر، ومحاليل المنغنيز السباعي ذات لون بنفسجي.[20][53] في حالات الأكسدة المرتفعة، خاصّةً في حالة الأكسدة +7، يكون المنغنيز من المؤكسدات القوية.[20]
- المنغنيز الثنائي
-sulfate-tetrahydrate-sample.jpg.webp)
في المحاليل المائية تكون أيونات المنغنيز الثنائي 2+Mn مُمَيّهة على الشكل 2+[Mn(H2O)6]، وهي ذات استقرارية كبيرة وثباتية تجاه تفاعلات الأكسدة والاختزال، ويعود السبب في ذلك إلى كون المدار الذرّي نصف ممتلئ، وذلك يمنح الأيون استقراراً طاقياً مُفَضّلاً. يعدّ المنغنيز الثنائي من أكثر حالات الأكسدة لهذا العنصر استقراراً؛ وتكون محاليله المائية فيها ذات لون وردي أو زهري فاتح، ويُعرَف العديد من المركّبات الكيميائية له في حالة الأكسدة تلك، مثل كبريتات المنغنيز الثنائي MnSO4 وكربونات المنغنيز الثنائي MnCO3. من المركّبات الأخرى للمنغنيز الثنائي كلّ من أكسيد المنغنيز الثنائي MnO وأسيتات المنغنيز الثنائي Mn(CH3COO)2؛ وكذلك مركّب كلوريد المنغنيز الثنائي MnCl2، والذي يدخل في العديد من التطبيقات الصناعية؛[55] وكذلك هيدروكسيد المنغنيز الثنائي Mn(OH)2، وهو مركّب غير مستقرّ، ويتأكسد بسهولة بأكسجين الهواء إلى أكسيد هيدروكسيد المنغنيز الثلاثي والرباعي،[ملاحظة 48] ولذلك يُستخدَم في تجربة فينكلر لتحديد محتوى الأكسجين في العيّنات.[56]

عادةً ما يكون للمنغنيز الثنائي في مركّباته عددُ كمٍّ مغزليٍّ مرتفع مقداره S = 5/2، رغم وجود بعض الحالات التي تكون فيها قيمته منخفضة على الشكل S =1/2 في بعض المركّبات.[57] لا يمكن حدوث انتقالات إلكترونية داخلية بين المدارات الفرعية d–d، لأنها غير ممكنة كمومياً، وذلك يفسّر اللون الزهري الشاحب لأغلب مركّبات المنغنيز الثنائي.[58][59] يوجد العديد من المعقّدات التناسقية للمنغنيز الثنائي، وهي معقّدات ذات عدد مغزلي مرتفع، وتحوي على خمسة إلكترونات غير متزاوجة، بالتالي فهي ذات عزم مغناطيسي مرتفع. ومن الصعب التنبّؤ وفق نظرية المجال البلّوري بالبنية الجزيئية؛ بالتالي فإنّه حسب نوع الربيطة يمكن أن يكون لهذه المعقّدات بنية جزيئية رباعية السطوح أو ثمانية السطوح أو مستوية مربّعة أو على هيئة اثنا عشريّ السطوح. من المعقّدات العضوية المعروفة للمنغنيز في حالة الأكسدة +2 مركّب منغنوسين، وهو من معقّدات الميتالوسين، ويكون عدد الإلكترونات الكلّي فيه 17 إلكتروناً، وهو بذلك أقلّ بإلكترون واحد مقارنةًً بمعقّد الفرّوسين، وهو بذلك لا يحقّق قاعدة 18 إلكترون. ولكنّه بالرغم من ذلك، وبسبب التوزيع الإلكتروني d5 المميّز مرتفع عدد الكمّ المغزلي المغناطيسي، فإنّه من الصعب اختزاله إلى المنغنيز الأحادي +Mn ويوجد في الحالة الصلبة على هيئة بنية مُبلمَرة.[60]
- المنغنيز الثلاثي
تتميّز محاليل المنغنيز الثلاثي المائية بلونها الأحمر، كما أنّه من السهل على مركّبات المنغنيز الثلاثي أن تخضع إلى تفاعل عدم تناسب في المحاليل لتتحوّل إلى مركّبات المنغنيز الثنائي والرباعي الموافقة. تميل معقّدات المنغنيز الثلاثي أن تتبنّى بنية جزيئية ثمانية السطوح مشوّهة بسبب تأثير يان-تيلر. من المركّبات المعروفة للمنغنيز الثلاثي كلّ من أكسيد المنغنيز الثلاثي Mn2O3 وأسيتات المنغنيز الثلاثي Mn(CH3COO)3. كما يُعرَف له مركَبا الهاليد: فلوريد المنغنيز الثلاثي MnF3 وكلوريد المنغنيز الثلاثي MnCl3؛ في حين أنّ البروميد واليوديد غير موجودة، لأن أيونات البروميد −Br واليوديد −I قادرةٌ على اختزال المنغنيز الثلاثي إلى ثنائي.[61]
- المنغنيز الرباعي
أشهر مركّبات المنغنيز في حالة الأكسدة الرباعية هو أكسيد المنغنيز الرباعي MnO2، والذي يعرف أيضاً باسم ثنائي أكسيد المنغنيز. وهو من المؤكسدات القويّة، ويُستخدَم في صناعة البطّاريات القلوية. يعطي تفاعل أكسيد المنغنيز الرباعي مع حمض الهيدروكلوريك مركّب كلوريد المنغنيز الثنائي مع انطلاق غاز الكلور، وقد كان هذا التفاعل يُستخدَم سابقاً من أجل تحضير غاز الكلور:
يُعرَف من الهاليدات للمنغنيز الرباعي مركّب فلوريد المنغنيز الرباعي MnF4، وهو مؤكسد قوي، ويُحضّر من فلورة ثنائي فلوريد المنغنيز MnF2 بالفلور أو ثنائي فلوريد الكريبتون.[62]

- المنغنيز الخماسي
لا تعدّ حالة الأكسدة هذه من حالات الأكسدة الشائعة للمنغنيز، ومن الأمثلة على المركّبات المعروفة للمنغنيز فيها مركّب هيبومنغنات البوتاسيوم K3MnO4. يمكن الحصول على المنغنيز الخماسي من إذابة ثنائي أكسيد المنغنيز في مصهور نتريت الصوديوم.[63]
- المنغنيز السداسي
أشهر مركّبات المنغنيز في حالة الأكسدة السداسية هو مركّب منغنات البوتاسيوم K2MnO4، والذي يُحضّر من إذابة ثنائي أكسيد المنغنيز في محلول قلوي من هيدروكسيد البوتاسيوم بوجود أكسجين الهواء.
- المنغنيز السباعي
لمركّبات المنغنيز السباعي لونٌ بنفسجي، وهي من المؤكسدات القويّة، ومن الأمثلة عليها مركّب أكسيد المنغنيز السباعي Mn2O7؛ بالإضافة إلى مركّبات البيرمنغنات المختلفة، مثل بيرمنغنات البوتاسيوم KMnO4 وبيرمنغنات الصوديوم NaMnO4 وبيرمنغنات الباريوم Ba(MnO4)2. يعدّ بيرمنغنات البوتاسيوم من الكواشف الكيميائية الشائعة في المختبرات.[64]
- حالات أكسدة أخرى
يوجد المنغنيز في حالة الأكسدة 0 في المعقّدات التناسقية مثل عشاري كربونيل ثنائي المنغنيز Mn2(CO)10، وهو معقّد يحوي على رابطة أحادية بين ذرّتي منغنيز في بنيته؛ في حين تصادف حالة الأكسدة +1 النادرة للمنغنيز في بعض مركّبات المنغنيز العضوية، مثل مركّب خماسي كربونيل هيدريد المنغنيز HMn(CO)5 أو ميثيل حلقي بنتاديينيل ثلاثي كربونيل المنغنيز MnC5H4CH3(CO)3. في حالات نادرة أيضاً يوجد المنغنيز في حالة أكسدة سالبة بمقدار (-3) في معقّد Mn(NO)3CO.[20]
التحليل الكيميائي
يمكن الكشف عن أيونات المنغنيز الثنائي نوعياً من خلال تفاعل أكسدة لتشكيل مركّبات البيرمنغنات ذات اللون البنفسجي المميّز، ويُستحصَل على ذلك من التفاعل مع أكسيد الرصاص الرباعي أو بيركبريتات الأمونيوم (بوجود أيونات الفضّة للتحفيز) أو باستخدام محاليل هيبوبروميت القلوية:
من أجل الحصول على نتائج واضحة يُستحسَن إجراء فصل للكاتيونات الموجودة في العيّنة، وذلك بإضافة مزيجٍ قلويّ مؤكسد من بيروكسيد الهيدروجين في وسطٍ من هيدروكسيد الصوديوم أو البوتاسيوم، ممّا يؤدّي إلى أكسدة المنغنيز الثنائي والحصول على راسبٍ صلبٍ من أكسيد هيدروكسيد المنغنيز الرباعي:
في تفاعل كشفٍ آخر، تؤدّي إضافة مركّب فورمالدوكسيم [ملاحظة 49] إلى وسطٍ حاوٍ على أيونات المنغنيز الثنائي إلى تلوّن المحلول بلون برتقالي إلى بنّي محمرّ.[65]
يمكن الكشف عن المنغنيز كمّيّاً باستخدام وسائل التحليل الآلي المختلفة، من خلالمطيافية الامتصاص الذرّي عند طول موجة مقداره 279.5 نانومتر على سبيل المثال؛[53] أو من خلال تجارب القياس الضوئي لتحديد تركيز البيرمنغنات، حيث تكون قيمة قمّة الامتصاص عند طول موجة مقداره 525 نانومتر.[66] من جهةٍ أخرى، يمكن اتّباع الوسائل التحليلية التقليدية مثل طرائق المعايرة.[67]
الدور الحيوي
يُصنّف المنغنيز ضمن العناصر المغذّية الضرورية بالنسبة لعددٍ معتبرٍ من الكائنات الحيّة؛ فهو يدخل في تركيب العديد من الإنزيمات، وكذلك يساهم في تفاعلات الأكسدة والاختزال الحيوية، ويقوم في بعض الأحيان بدور حمض لويس؛ كما يعدّ وجوده ضرورياً في عملية التركيب الضوئي، بالإضافة إلى استخدامه من عددٍ من أنواع البكتريا من أجل عمليّات توليد الطاقة.
عند النباتات

إن المنغنيز من العناصر المهمّة بالنسبة للنباتات، فهو يقوم بدورٍ أساسيٍّ في عملية التركيب الضوئي أثناء توليد الأكسجين في الصانعات اليخضورية (البلاستيدات).[ملاحظة 50] يُعدّ معقّد توليد الأكسجين [ملاحظة 51] جزءاً من النظام الضوئي الثاني [ملاحظة 52] الموجود في الأغشية الكيسيّة [ملاحظة 53] للصانعات اليخضورية، ويدخل في تركيب إنزيم فلزّي مسؤول عن الخطوة النهائية في توليد الأكسجين عبر تفاعل أكسدة الماء ضوئياً في عملية التركيب الضوئي.[68][69] يحوي هذا المعقّد على نواةٍ عنقودية مكوّنة من أربع ذرّات من المنغنيز وذرّة من الكالسيوم، والمرتبطة ببعضها عبر جسور أكسجينية. أثناء التركيب الضوئي تحدث عمليات أكسدة واختزال على ذرّات المنغنيز، بحيث تتغيّر حالة الأكسدة بين المنغنيز الثلاثي والرباعي.[70]
عند الإنسان
يعدّ وجود المنغنيز في الوسط الحيوي داخل جسم الإنسان ضرورياً، فهو يدخل على هيئة عامل مرافق في عددٍ من العمليات الحيوية المهمّة،[71] والتي تتضمّن استقلاب المغذّيات الكبرى [ملاحظة 54] وتشكل العظام؛ وكذلك في عمليات المناعة الدفاعية ضد الجذور الكيميائية الحرّة. يحوي جسم الإنسان على حوالي 12 ميليغرام (مغ) من المنغنيز، ويتركّز وجوده في العظام، وكذلك في الكبد والكليتين؛[18] وكذلك في البنكرياس، كما يوجد أيضاً في الدماغ، وخاصّةً ضمن إنزيم مخلّقة الغلوتامين في الخلايا النجمية.[72]
الإنزيمات
تتضمّن عائلات الإنزيمات الحاوية على المنغنيز عاملاً مرافقاً كلّ من إنزيمات الأكسدة والاختزال [ملاحظة 55] مثل مختزلة الريبونوكليوتيد [ملاحظة 56]، والإنزيمات الناقلة [ملاحظة 57] مثل ناقلة الغليكوزيل [ملاحظة 58]، وإنزيمات الحلمهة [ملاحظة 59]؛ بالإضافة إلى إنزيمات فصم الروابط الكيميائية مثل إنزيمات لياز [ملاحظة 60]، وإنزيمات كيناز [ملاحظة 61] مثل ميفالونات كيناز [ملاحظة 62]، والإنزيمات النازعة لمجموعة الكربوكسيل [ملاحظة 63]؛ وكذلك الإنزيمات المصاوغة [ملاحظة 64]، والإنزيمات المشكّلة للروابط الكيميائية [ملاحظة 65] مثل بيروفات كربوكسيلاز [ملاحظة 66]؛ ومن الإنزيمات الأخرى الحاوية على المنغنيز كلّ من إنزيمات الأرجيناز [ملاحظة 67] وسوبر أكسيد ديسميوتاز [ملاحظة 68] والمُنْتَسِخات العكسية [ملاحظة 69].[53][73] هناك أيضاً عددٌ من البروتينات الحاوية على المنغنيز والداخلة في تركيب ذيفان الخناق والليكتين والإنتغرين.[74]
| ذكور | إناث | ||
|---|---|---|---|
| العمر | الكمّيّة (مغ/اليوم) |
العمر | الكمّيّة (مغ/اليوم) |
| 1–3 | 1.2 | 1–3 | 1.2 |
| 4–8 | 1.5 | 4–8 | 1.5 |
| 9–13 | 1.9 | 9–13 | 1.6 |
| 14–18 | 2.2 | 14–18 | 1.6 |
| 19+ | 2.3 | 19+ | 1.8 |
| حوامل: 2 | |||
| مرضعات: 2.6 | |||
على سبيل المثال، يوجد إنزيم سوبر أكسيد ديسميوتاز الحاوي على المنغنيز داخل الميتوكندريون (المتقدّرة) [ملاحظة 70] والبيروكسيسوم (الجسيمات التأكسدية) [ملاحظة 71]؛[76] وهو يعمل على تحفيز تفاعل فوق الأكسيد (سوبر أكسيد) [ملاحظة 72] إلى أكسجين وبيروكسيد الهيدروجين، وذلك عن طريق أكسدة واختزال المنغنيز بين حالتي الأكسدة +2 و +3:[73]
التوصيات الغذائية
في سنة 2001 حدّثت الأكاديمية الوطنية للطبّ في الولايات المتّحدة الأمريكية قيم الكمّيّات الغذائية المرجعية [ملاحظة 73] بالنسبة للعناصر المعدنية الغذائية. بالنسبة للمنغنيز لم تكن هناك معلومات وافية من أجل تحديد قيم معدّل الحاجة التقريبي [ملاحظة 74] والكمّيّات المُوصى بتناولها [ملاحظة 75]، لذلك حُدِّدَ بدلاً منها قيم المدخول الكافي [ملاحظة 76]؛ ولكن من أجل السلامة وضعت الأكاديمية الحدّ الأقصى للمدخول المقبول [ملاحظة 77] من المنغنيز بمقدار 11 مغ/اليوم.[75] راجعت إدارة الغذاء والدواء الأمريكية [ملاحظة 78] النسبة المئوية للقيم اليومية [ملاحظة 79] الموضوعة على مُلصَقات المُكمّلات الغذائية، وغُيّرت القيمة المرجعية الموصى بها من 2.0 مغ إلى 2.3 مغ لتتوافق مع قيم الكمّيّات الغذائية المرجعية الموضوعة من الأكاديمية الوطنية للطبّ.[77][78]
تعطي الهيئة الأوروبية لسلامة الأغذية [ملاحظة 80] بيانات مقاربة، ولكنّها أعلى قليلاً ممّا هو متّبع في الولايات المتّحدة. فللأشخاص الأكبر من 15 سنة وضعت الهيئة كمّيّة من 3.0 مغ/اليوم من المنغنيز مقداراً كافياً للمدخول اليومي؛ وهو ذاته بالنسبة للمرضعات والحوامل؛ أمّا الأطفال من عمر 1–14 سنة فالكمّيّة تزداد تدريجياً مع تقدّم العمر من 0.5 إلى 2.0 مغ/اليوم؛[79] ولكنّها لم تضع حدّاً أقصى مقبولاً لعدم توفّر بيانات كافية.[80] تجدر الإشارة إلى أنّ حالة عوز المنغنيز [ملاحظة 81] نادرة الحدوث.[81]
الأثر البيئي

يمكن أن يعود وجود المنغنيز بتراكيز مرتفعة بآثار سلبية على البيئة وعلى الصحّة. قد يأتي التعرّض المرتفع من المنغنيز عبر مصادر مختلفة، مثل مياه الشرب والإضافات إلى وقود السيارات ودخان التبغ.
- تلوّث مياه الشرب
للمنغنيز المحمول عبر الماء توافر حيوي أكبر من المنغنيز المنقول عبر الغذاء؛ لذلك قد يكون لتلوّث مياه الشرب بتراكيز مرتفعة من المنغنيز أثرٌ سلبي على الصحّة. فوفقاً لنتائج دراسة نُشِرَت سنة 2010 وُجِدَ أنّ التعرّض لمستويات مرتفعة من المنغنيز في مياه الشرب يترافق مع حدوث حالات إعاقة للنموّ الذهني وانخفاض لنسبة الذكاء عند الأطفال بعمر المدرسة.[82] بالمقابل، وجدت دراسة أنّ جسم الإنسان قادرٌ على التعافي من الآثار الجانبية الضارّة الناجمة عن التعرّض المفرط للمنغنيز في حال إيقاف ذلك التعرّض، إذ أنّ الجسم قادرٌ على التخلّص من الفائض بآلياتٍ ذاتيّة داخلية.[83]
- وقود السيارات
يعدّ مركّب ميثيل حلقي بنتاديينيل ثلاثي كربونيل المنغنيز [ملاحظة 82] أحد الإضافات إلى وقود السيارات (الغازولين)، وذلك بديلاً عن مركّبات الرصاص، من أجل رفع رقم الأوكتان، كما أنه يُخفّض من خبط المحرك؛ إلّا أنّه عمل على الإضرار بالصمّامات القفّازة [ملاحظة 83] بسبب تشكّل مركّبات الكربيد. في النهاية ينطلق المنغنيز عبر العادم، ممّا يؤدّي إلى ارتفاع مستويات المنغنيز في الهواء.[84]
- دخان التبغ
يمتصّ نبات التبغ عدداً من الفلزّات الثقيلة من ضمنها المنغنيز من التربة ويراكمها في الأوراق؛ لذلك فإنّ تدخين التبغ يؤدّي إلى التعرّض لتلك الفلزّات.[85] بالتالي يعدّ المنغنيز مكوّناً من مكوّنات دخان التبغ؛[86] إلّا أنّ بعض الدراسات أظهرت أنّ تراكيز الفلزّات في دخان التبغ منخفضة، لذلك فإنّ تأثيرها الضارّ على الصحّة منخفض.[87]
التأثير على الحياة البحرية
تحتاج العديد من الأنظمة الإنزيمية إلى المنغنيز كي تقوم بدورها على أكمل وجه، لكنّ التراكيز المرتفعة من المنغنيز يمكن أن تكون ذات تأثير سمّي. ويكون ذلك التأثير خطراً على البيئة البحرية، خاصّةً عند التعرّض لفترات من نقص التأكسج (انخفاض تركيز الأكسجين المنحلّ) في الوسط.[88] تعود تلك الظروف بآثار سلبية على الكائنات البحرية، وخاصة السموك؛ إذ بيّنت تقارير ارتفاع تراكيز المنغنيز فيها وتراكمه في الأعضاء الحيوية فيها مثل الخياشم والكبد والدماغ، ممّا يؤدّي إلى إضعاف مناعتها وتعرّضها للعوامل المُمْرضة، الأمر الذي قد يؤدّي إلى نفوقها.[26]
الاستخدامات
لفلزّ المنغنيز عددٌ من التطبيقات في مجالات اختصاصية مهمة، وخاصّةً في مجال التعدين وصناعة السبائك، وكذلك في مجال صناعة البطّاريات.[22]
صناعة السبائك
تؤدّي إضافة المنغنيز أثناء صنع السبائك المختلفة عموماً إلى تحسين الخواص الهندسية مثل رفع الصلابة البنيوية وتحسين قابلية التشكيل؛ بالإضافة إلى زيادة المقاومة ضدّ التآكل.
- إنتاج الفولاذ
يعدّ مجال تعدين الحديد وإنتاج الفولاذ التطبيق الرئيسي لهذا الفلزّ،[89] إذ يُحوّل حوالي 90% من الفلزّ النقيّ المُستخرَج إلى سبائك حديديّة (مثل فرّومنغنيز أو شبيغل آيزن [ملاحظة 84]) من أجل المعالجة اللاحقة. يمتلك المنغنيز خواصاً مميّزة في هذا المجال تتمثّل في مقدرته على الارتباط مع الكبريت وعلى نزع الأكسجين والفوسفور من الوسط، بالإضافة إلى منح خواص هندسية فريدة عند السبك؛[35][39] كما يعدّ المنغنيز مكوّناً أساسياً في صناعة الفولاذ المقاوم للصدأ.[90][91]
تؤدّي إضافة كمّيّات صغيرة من المنغنيز أثناء صناعة الفولاذ إلى تحسين الطواعية وقابلية التشغيل [ملاحظة 85] عند درجات حرارة مرتفعة، وذلك من خلال الارتباط مع الكبريت لتشكيل مركّبات كبريتيد ذات درجة انصهار مرتفعة، ممّا يحول دون تشكيل مركّبات كبريتيد الحديد عند الحدود الحُبَيبيّة [ملاحظة 86]. عند وصول محتوى المنغنيز إلى 4% تصبح ظاهرة تقصّف الفولاذ الظاهرة السائدة، لكنّها تتناقص مع زيادة نسبة المحتوى من المنغنيز، وتصل إلى مستويات مقبولة عند 8%. يكون للفولاذ الحاوي على نسبةٍ من المنغنيز تتراوح بين 8% إلى 15% قيمة مرتفعة من مقاومة الشدّ تصل إلى 863 ميغاباسكال.[92][93]

- سبائك أخرى
يُسبَك المنغنيز مع الفلزّات اللاحديدية من أجل إنتاج عددٍ من السبائك الأخرى؛ مثل إنتاج سبائك الألومنيوم على سبيل المثال. إذ تؤدّي إضافة كمّيّات ضئيلة نسبياً (أقلّ من 1.5%) من المنغنيز إلى الألومنيوم إلى زيادة المقاومة تجاه التآكل، وذلك عن طريق ارتباط هذا الفلزّ مع الشوائب من العناصر الأخرى، التي قد تؤدّي إلى حدوث تآكل غلفاني. تُستخدَم سبائك الألومنيوم تلك الحاوية على كمّيّات ضئيلة من المنغنيز في صناعة عَبَوات المشروبات.[94] في مثالٍ آخر، تتألّف سبيكة منغانين [ملاحظة 87] بشكلٍ رئيسيٍّ من حوالي 83% نحاس و12% منغنيز و5% نيكل؛ وهي تمتلك خواصاً حرارية كهربائية منخفضة، بالتالي تكون المقاومة الكهربائية مثلاً غير متعلّقة بشكلٍ كبيرٍ بتغيّر درجة الحرارة؛ لذلك تُستخدَم تلك السبيكة في صناعة أجهزة القياس.[35]
سك العملات
يُستخدَم فلزّ المنغنيز في بعض الأحيان في سكّ النقود المعدنية، بالإضافة إلى فلزّات أخرى مثل النحاس أو الفضّة أو النيكل.[95] منذ سنة 2000 تُصنَع قطع معدنية خاصّة من الدولار الأمريكي، مثل دولار ساكاجاويا [ملاحظة 88] أو الدولار الأمريكي الرئاسي المعدني [ملاحظة 89] من سبيكة نحاس أصفر مكوّنة من النحاس بالإضافة إلى 7% منغنيز.[96]
تطبيقات لمركبات المنغنيز

- صناعة البطاريات
يُستخدَم أكسيد المنغنيز الرباعي (ثنائي أكسيد المنغنيز) في صناعة البطّاريات الجافّة، حيث يوجد على هيئة مادّة سوداء داخل البطارية، ويعمل على استقبال الإلكترونات من الزنك. يُختزَل ثنائي أكسيد المنغنيز MnO2 إلى أكسيد-هيدروكسيد المنغنيز MnO(OH) أثناء استهلاك البطارية (تفريغ الشحنة)، ممّا يمنع من تشكّل الهيدروجين على المصعد.[97]
تُستخدَم المادّة ذاتها في البطّاريات القلوية، وتخضع إلى التفاعل الكيميائي ذاته، ولكن في وسط كهرلي مختلف. في سنة 2002 استُخدِمَ أكثر من 230 ألف طنّ من ثنائي أكسيد المنغنيز من أجل هذا التطبيق.[13][97]
- المواد الفسفورية
يُستخدَم المنغنيز ثلاثي التكافؤ منشّطاً [ملاحظة 90] من أجل تفعيل في المواد الفسفورية المصدّرة للضوء الأحمر.[98] على الرغم من وجود عددٍ من مركّبات المنغنيز القادرة على إظهار خاصة الضيائية؛[99] إلّا أنّ الغالبية العظمى منها غير مستخدمة في تطبيقات تجارية، نظراً لانخفاض الكفاءة أو لانبعاث الضوء الأحمر الشديد.[100][101] بالرغم من ذلك، وجد أنّ هناك عددٌ من الفلوريدات التي تتنشّط بأيونات المنغنيز الرباعي ذات صفات واعدة في المواد الفسفورية المصدّرة للضوء الأحمر القابلة للاستخدام في الثنائيات الباعثة للضوء [ملاحظة 91].[102][103] من المركّبات الحاوية على المنغنيز التي يكثر استخدامها في الثنائيات الباعثة للضوء مركّب 4+K2SiF6:Mn.[104]
- صناعة الخضب
تدخل مركّبات المنغنيز في صناعة الخُضُب المستخدمة من أجل تلوين الخزف والسيراميك والزجاج؛ فاللون البنّي للخزف يكون في بعض الأحيان نتيجةً لإضافة مركّبات المنغنيز إليه.[105] وفي صناعة الزجاج تُستخدَم مركّبات المنغنيز لضبط الألوان،[7] إذ يتفاعل أكسيد المنغنيز الثلاثي مع أكسيد الحديد الثنائي، فيحدث تفاعل أكسدة واختزال، ممّا يؤدّي إلى إضفاء مزيج من لون أخضر من الحديد الثلاثي ولون زهري من المنغنيز الثنائي.[7] وُجِدَ أنّ خضاب أزرق الإتريوم والإنديوم والمنغنيز يؤدّي إلى إضفاء لون أزرق شديد، وهو يتميّز بعدم سمّيّته وخموله ومقاومته للبهوت.[106]
- متفرقات

- يُستخدَم مركّب ميثيل حلقي بنتاديينيل ثلاثي كربونيل المنغنيز (MMT) ضمن الإضافات إلى وقود السيارات بديلاً عن مركّبات الرصاص لاعتبارات صحّيّة وبيئية، وذلك من أجل تعزيز رقم الأوكتان ومن أجل التقليل من خبط المحرك. يعدّ هذا المركّب من مركّبات المنغنيز العضوية، ويكون المنغنيز فيه بحالة أكسدة نادرة مقدارها +1.[107]
- في مختبرات الكيمياء العضوية يُستخدَم ثنائي أكسيد المنغنيز ضمن المؤكسدات من أجل أكسدة مشتقّات الكحولات البنزيلية والكحولات الأليلية بشكلٍ انتقائي.[108]
- في مجال التصوير التشخيصي الطبّي تعدّ مادّة منغافوديبير [ملاحظة 92] إحدى مواد التباين المرخّص باستخدامها في تقنية التصوير بالرنين المغناطيسي [ملاحظة 93] للكبد، إذ تتميّز بأنّها ذات خواص مغناطيسية مسايرة، وذلك بسبب وجود أيونات المنغنيز الثنائي في البنية. يُعمَد إلى التخلّص من الخواص السمّيّة لأيونات المنغنيز الثنائي لهذه المادّة من خلال تشكيل معقّد تناسقي مع ربيطة ثنائي فوسفات ثنائي بيريدوكسيل [ملاحظة 94]، والذي يُقدّم على هيئة عقار مكمّل يدعى فوديبير [ملاحظة 95]. بشكلٍ قياسيٍ تُجرى عمليّات تصوير الكبد طبّياً اعتماداً على أيونات الغادولينيوم.[109]
المخاطر
مثلما هو الحال مع باقي الفلزّات، فإنّ المنغنيز عندما يكون على شكل مسحوقٍ ناعمٍ فإنّه يكون قابلاً للاشتعال ويتفاعل مع الماء. من أجل إطفاء حرائق الفلزّات ينبغي استخدام مطافئ حريق من الفئة D أو باستخدام الرمل؛ بالمقابل فإنّ الكتل الكبيرة من هذا الفلزّ لا تشتعل بسهولة. على الرغم من أنّ التعرّض للمنغنيز ومركّباته هو أقلّ سمّيّة من فلزّات أخرى أكثر انتشاراً مثل النيكل؛[110] بالرغم من ذلك ينبغي أن لا يتجاوز التعرّض لغبار المنغنيز أو أبخرته مقدار 5 مغ/م3، حتّى لفترات قصيرة،[111] إذ أنّ استنشاق غبار مسحوق المنغنيز أو أبخرته قد يؤدّي إلى حدوث حالة تسمّم، تعرف باسم التسمّم بالمنغنيز [ملاحظة 96]؛ وهي حالة تترافق مع حدوث اضطرابات في المهارات الحركية، بشكلٍ مشابهٍ لأعراض مرض باركنسون؛ بالإضافة إلى حدوث اضطرابات معرفية.[112] تبدأ المشاكل الصحّيّة الناجمة عن عملية استنشاق غبار المنغنيز بتضرّر الرئتين المترافق مع أعراض مثل السعال والتهاب القصبات الحاد والتهاب الرئة؛ ثم تتطوّر الحالة بظهور أعراض التسمّم العصبي وتَضرُّر أنظمة الجهاز العصبي المركزي مثل النظام خارج السبيل الهرمي.[113]
تبلغ قيمة حدّ العتبة مقدار 0.02 مغ/م3 بالنسبة لغبار المنغنيز الدقيق جدّاً، الذي يمكن أن يتخلّل إلى الحويصلات الهوائية؛ في حين أنّه يبلغ مقدار 0.2 مغ/م3 بالنسبة للغبار الناعم القابل للاستنشاق إلى المجاري التنفسية. تضبط إدارة السلامة والصحّة المهنية الأمريكية [ملاحظة 97] مقدار التعرّض للمنغنيز في الولايات المتّحدة؛ ووضعت حدّ التعرّض المسموح [ملاحظة 98] بمقدار 5 مغ/م3 وذلك بالنسبة ليوم عمل من 8 ساعات.[114] أمّا المعهد الوطني للسلامة والصحّة المهنيّة [ملاحظة 99] في الولايات المتّحدة فوضع حدّ التعرّض الموصى به [ملاحظة 100] بمقدار 1 مغ/م3 في يوم عمل من 8 ساعات؛ وحدّ التعرّض القصير بمقدار 3 مغ/م3؛ أمّا عند مستويات تقارب 500 مغ/م3 فإنّ المنغنيز يكون حينها ذا خطورةٍ فوريةٍ للحياة أو الصحّة.[115]
وُجِدَ أيضاً أنّ التعرّض طويل الأمد للمنغنيز حتّى بجرعات منخفضة، مثلما هو الحال في وجوده ضمن مياه الشرب، قد يؤدّي إلى حدوث تأثيرات سلبية على تطوّر الطفل العقلي. إذ أنّ التعرّض المستمرّ لمستويات من المنغنيز في مياه الشرب تتراوح بين 240–350 ميكروغرام/الليتر يؤدّي إلى ضعفٍ في المهارات الحركية الدقيقة وفي سرعة الاستجابة وفي الذاكرة قصيرة الأمد وفي التعرّف البصري، وذلك بالمقارنة مع الأطفال الذين لا يتعرّضون لتلك المستويات من المنغنيز في مياه الشرب؛ وقد جرى تأكيد تلك النتائج بدراسةٍ أجريت في كندا.[82] تبلغ المستويات المأمونة من المنغنيز في مياه الشرب وفق وكالة حماية البيئة الأمريكية [ملاحظة 101] مقدار 50 ميكروغرام/الليتر.[116]
لمركّبات البيرمنغنات سمّيّة أكبر من مركّبات المنغنيز الثنائي؛ وتبلغ قيمة الجرعة المميتة مقدار 10 غ؛ ووردت الكثير من حالات التسمّم جرّاء ذلك. تتميّز البيرمنغنات بقدرتها العالية على الأكسدة، ممّا يؤدّي إلى حدوث نخر للأغشية المخاطية عند تناول تلك المركّبات، وخاصّةً المريء؛ ولا تُمتصّ إلا كمّيّة ضئيلة منها في الأمعاء، إلّا أنّها كافية للتسبّب بأضرارٍ جسيمةٍ على الكليتين والكبد.[117][118]
التسمم بالمنغنيز
التسمّم بالمنغنيز هو اضطراب ثنائي الطور؛ ففي المراحل المبكّرة من الحالة يبدي المصاب أعراضاً من اضطرابات نفسية تتمثّل بالاكتئاب وتقلّب المزاج والسلوك القهري والذهان. تتطوّر الحالة لتؤثّر على المهارات الحركية، وتظهر أعراضٌ تشابه أعراضَ مرض باركنسون،[119] ويرافق ذلك شعورٌ مستمرٌّ بالإرهاق والتعب، والبطء في الكلام، وغياب تعابير الوجه، وظهور الرعاش والمشية المنحنية للأمام، مع تصلّبٍّ للجسم وفقدانٍ للتوازن.[16][120]
على العكس من مرض باركنسون فلا يترافق التسمّم بالمنغنيز مع فقدان حاسّة الشمّ، ولكن لا يستجيب المرضى للعلاج بعقار ليفودوبا [ملاحظة 102]؛[121] ممّا يشير إلى وجود تضرّرٍ بالمسارات العصبية بشكلٍ مختلفٍ عن المسارات الدوبامينية داخل المادّة السوداء.[119] يمكن للمنغنيز أن يتركّز في العُقَد القاعدية [ملاحظة 103]، ممّا يؤدّي إلى ظهور عدم انتظام في الحركة.[122] وُجِدَ أنّ حدوثَ طفرةِ في أحد الجينات،[ملاحظة 104] المسؤولة عن تنظيم تدفّق حركة المنغنيز بين الخلايا كان ذا صلةٍ مع ظهور أعراض مشابهة لمرض باركنسون.[123] بالمقابل، فإن أجسام ليوي، والذي يعد وجودها نمطياً لمرض باركنسون، يكون غائباً في المرضى المصابين بأعراض التسمّم بالمنغنيز الحركية.[122] تبقى الأعراض المرافقة للمراحل المتأخرة من التسمّم بالمنغنيز بادية الشدّة حتى مع زوال مصدر التعرّض وعودة نسبة المنغنيز في الجسم والدماغ إلى المستويات الطبيعية.[120] بالنسبة للتجارب على الحيوانات، بيّنت إحدى التجارب أنّه عند تعريض الجرذان لمستويات مرتفعة من المنغنيز فإنّ ذلك يعزّز من السلوك العدواني الدافع لقتل الفئران.[124]
طالع أيضاً
الهوامش
- أو المنجنيز
- Magnetes
- Magnesia ad Sipylum
- Magnḗsĭa ad Mæándrum
- magnes
- Magnetite
- magnes
- manganesum
- magnesia nigra
- magnesia alba
- Michele Mercati
- manganesa
- Ekain
- Lascaux
- Gargas
- glassmakers soap
- Ignatius Gottfried Kaim
- Johann Rudolf Glauber
- Carl Wilhelm Scheele
- Leblanc process
- Weldon process
- Johan Gottlieb Gahn
- Bessemer process
- Robert Hadfield
- Leclanché cell
- John Couper
- parts per million (ppm)
- Manganite: MnO(OH)
- Hausmannite: Mn2+Mn3+2O4
- Rhodonite: MnSiO3
- Pyrolusite: MnO2
- Braunite: (Mn2+Mn3+6)(SiO12)
- Psilomelane: (Ba,H2O)2Mn5O10
- Rhodochrosite: MnCO3
- silt
- Dissolved manganese (dMn)
- Particulate Mn
- buoyant plumes
- Internal cycling
- dissolution
- oxidative scavenging
- Manganese nodule
- Room and pillar mining
- battery-grade
- chemical-grade
- Silicomanganese
- Néel temperature
- manganese(III,IV)-oxidhydroxide
- Formaldoxime (N-Hydroxymethanimine)
- chloroplast
- oxygen-evolving complex (OEC)
- photosystem II
- thylakoid membranes
- macronutrient metabolism
- oxidoreductase
- Ribonucleotide reductase
- transferase
- Glycosyltransferase
- hydrolase
- lyase
- Kinase
- Mevalonate kinase
- decarboxylases
- isomerase
- ligase
- Pyruvate carboxylase
- arginase
- superoxide dismutase Mn-SOD
- reverse transcriptase
- Mitochondrion
- Peroxisome
- Superoxide
- Dietary Reference Intakes (DRIs)
- Estimated Average Requirements (EARs)
- Recommended Dietary Allowances (RDAs)
- Adequate Intakes (AIs)
- Tolerable upper intake levels (ULs)
- Food and Drug Administration (FDA)
- Daily Value (%DV)
- European Food Safety Authority (EFSA)
- Manganese deficiency
- Methylcyclopentadienyl manganese tricarbonyl (MMT)
- exhaust valve
- Spiegeleisen
- workability
- grain boundaries
- Manganin
- Sacagawea dollar
- Presidential dollar coins
- Activator
- LEDs
- Mangafodipir
- Magnetic resonance imaging (MRI)
- dipyridoxyl diphosphate (DPDP)
- Fodipir
- Manganism
- Occupational Safety and Health Administration (OSHA)
- permissible exposure limit (PEL)
- National Institute for Occupational Safety and Health (NIOSH)
- recommended exposure limit (REL)
- Environmental Protection Agency (EPA)
- L-DOPA
- basal ganglia
- SLC30A10
المراجع
- languagehat (28 مايو 2005)، "MAGNET."، languagehat.com (باللغة الإنجليزية)، مؤرشف من الأصل في 5 مايو 2021، اطلع عليه بتاريخ 18 يونيو 2020.
- Justus von Liebig, Johann C. Poggendorff, Friedrich Wöhler, Hermann Kolbe: Handwörterbuch der reinen und angewandten Chemie. Band 5, 1851, S. 594–595
- Calvert, J. B. (24 يناير 2003)، "Chromium and Manganese"، مؤرشف من الأصل في 31 ديسمبر 2016.
- Chalmin, Emilie؛ Menu, Michel؛ Vignaud, Colette (2003)، "Analysis of rock art painting and technology of Palaeolithic painters"، Measurement Science and Technology، 14 (9): 1590–1597، doi:10.1088/0957-0233/14/9/310.
- Chalmin, E.؛ Vignaud, C.؛ Salomon, H.؛ Farges, F.؛ Susini, J.؛ Menu, M. (2006)، "Minerals discovered in paleolithic black pigments by transmission electron microscopy and micro-X-ray absorption near-edge structure" (PDF)، Applied Physics A، 83 (12): 213–218، Bibcode:2006ApPhA..83..213C، doi:10.1007/s00339-006-3510-7، hdl:2268/67458، S2CID 9221234، مؤرشف من الأصل (PDF) في 17 أغسطس 2017.
- Sayre, E. V.؛ Smith, R. W. (1961)، "Compositional Categories of Ancient Glass"، Science، 133 (3467): 1824–1826، Bibcode:1961Sci...133.1824S، doi:10.1126/science.133.3467.1824، PMID 17818999، S2CID 25198686.
- Mccray, W. Patrick (1998)، "Glassmaking in renaissance Italy: The innovation of venetian cristallo"، JOM، 50 (5): 14–19، Bibcode:1998JOM....50e..14M، doi:10.1007/s11837-998-0024-0، S2CID 111314824.
- Rancke-Madsen, E. (1975)، "The Discovery of an Element"، Centaurus، 19 (4): 299–313، Bibcode:1975Cent...19..299R، doi:10.1111/j.1600-0498.1975.tb00329.x.
- Alessio, L.؛ Campagna, M.؛ Lucchini, R. (2007)، "From lead to manganese through mercury: mythology, science, and lessons for prevention"، American Journal of Industrial Medicine، 50 (11): 779–787، doi:10.1002/ajim.20524، PMID 17918211.
- Corathers, L. A.؛ Machamer, J. F. (2006)، "Manganese"، Industrial Minerals & Rocks: Commodities, Markets, and Uses (ط. 7th)، SME، ص. 631–636، ISBN 978-0-87335-233-8.
- Olsen, Sverre E.؛ Tangstad, Merete؛ Lindstad, Tor (2007)، "History of omanganese"، Production of Manganese Ferroalloys، Tapir Academic Press، ص. 11–12، ISBN 978-82-519-2191-6.
- Tweedale, Geoffrey (1985)، "Sir Robert Abbott Hadfield F.R.S. (1858–1940), and the Discovery of Manganese Steel Geoffrey Tweedale"، Notes and Records of the Royal Society of London، 40 (1): 63–74، doi:10.1098/rsnr.1985.0004، JSTOR 531536.
- Preisler, Eberhard (1980)، "Moderne Verfahren der Großchemie: Braunstein"، Chemie in unserer Zeit (باللغة الألمانية)، 14 (5): 137–148، doi:10.1002/ciuz.19800140502.
- Baselt, R. (2008) Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, CA, pp. 883–886, (ردمك 0-9626523-7-7).
- Normandin, Louise؛ Hazell, A. S. (2002)، "Manganese neurotoxicity: an update of pathophysiologic mechanisms"، Metabolic Brain Disease، 17 (4): 375–87، doi:10.1023/A:1021970120965، PMID 12602514، S2CID 23679769.
- Couper, John (1837)، "On the effects of black oxide of manganese when inhaled into the lungs"، Br. Ann. Med. Pharm. Vital. Stat. Gen. Sci.، 1: 41–42.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 85. Auflage. CRC Press, Boca Raton, Florida, 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth’s Crust and in the Sea.
- Emsley, John (2001)، "Manganese"، Nature's Building Blocks: An A-Z Guide to the Elements، Oxford, UK: Oxford University Press، ص. 249–253، ISBN 978-0-19-850340-8.
- Bhattacharyya, P. K.؛ Dasgupta, Somnath؛ Fukuoka, M.؛ Roy Supriya (1984)، "Geochemistry of braunite and associated phases in metamorphosed non-calcareous manganese ores of India"، Contributions to Mineralogy and Petrology، 87 (1): 65–71، Bibcode:1984CoMP...87...65B، doi:10.1007/BF00371403، S2CID 129495326، مؤرشف من الأصل في 27 مارس 2022.
- Holleman, Arnold F.؛ Wiberg, Egon؛ Wiberg, Nils (1985)، "Mangan"، Lehrbuch der Anorganischen Chemie (باللغة الألمانية) (ط. 91–100)، Walter de Gruyter، ص. 1110–1117، ISBN 978-3-11-007511-3.
- Cook, Nigel J.؛ Ciobanu, Cristiana L.؛ Pring, Allan؛ Skinner, William؛ Shimizu, Masaaki؛ Danyushevsky, Leonid؛ Saini-Eidukat, Bernhardt؛ Melcher, Frank (2009)، "Trace and minor elements in sphalerite: A LA-ICPMS study"، Geochimica et Cosmochimica Acta (باللغة الإنجليزية)، 73 (16): 4761–4791، Bibcode:2009GeCoA..73.4761C، doi:10.1016/j.gca.2009.05.045، مؤرشف من الأصل في 8 نوفمبر 2021.
- USGS Mineral Commodity Summaries 2009
- Bartlett, Richmond؛ Ross, Donald (2005)، "Chemistry of Redox Processes in Soils"، في Tabatabai, M.A.؛ Sparks, D.L. (المحررون)، Chemical Processes in Soils، SSSA Book Series, no. 8، Madison, Wisconsin: Soil Science Society of America، ص. 461–487، LCCN 2005924447.
- Dixon, Joe B.؛ White, G. Norman (2002)، "Manganese Oxides"، في Dixon, J.B.؛ Schulze, D.G. (المحررون)، Soil Mineralogy with Environmental Applications، SSSA Book Series no. 7، Madison, Wisconsin: Soil Science Society of America، ص. 367–386، LCCN 2002100258.
- Ray, Durbar؛ Babu, E. V. S. S. K.؛ Surya Prakash, L. (01 يناير 2017)، "Nature of Suspended Particles in Hydrothermal Plume at 3°40'N Carlsberg Ridge:A Comparison with Deep Oceanic Suspended Matter"، Current Science، 112 (1): 139، doi:10.18520/cs/v112/i01/139-146، ISSN 0011-3891.
- Hernroth, Bodil؛ Tassidis, Helena؛ Baden, Susanne P. (مارس 2020)، "Immunosuppression of aquatic organisms exposed to elevated levels of manganese: From global to molecular perspective"، Developmental & Comparative Immunology، 104: 103536، doi:10.1016/j.dci.2019.103536، ISSN 0145-305X، PMID 31705914، مؤرشف من الأصل في 1 نوفمبر 2021.
- Sim, Nari؛ Orians, Kristin J. (أكتوبر 2019)، "Annual variability of dissolved manganese in Northeast Pacific along Line-P: 2010–2013"، Marine Chemistry، 216: 103702، doi:10.1016/j.marchem.2019.103702، ISSN 0304-4203، مؤرشف من الأصل في 22 نوفمبر 2021.
- Hein, James R. (يناير 2016)، Encyclopedia of Marine Geosciences - Manganese Nodules، Springer، ص. 408–412، مؤرشف من الأصل في 4 نوفمبر 2021، اطلع عليه بتاريخ 02 فبراير 2021.
- Hoseinpour, Vahid؛ Ghaemi, Nasser (01 ديسمبر 2018)، "Green synthesis of manganese nanoparticles: Applications and future perspective–A review"، Journal of Photochemistry and Photobiology B: Biology، 189: 234–243، doi:10.1016/j.jphotobiol.2018.10.022، PMID 30412855، مؤرشف من الأصل في 4 نوفمبر 2021، اطلع عليه بتاريخ 02 فبراير 2021.
- Wang, X؛ Schröder, HC؛ Wiens, M؛ Schlossmacher, U؛ Müller, WEG (2009)، "Manganese/polymetallic nodules: micro-structural characterization of exolithobiontic- and endolithobiontic microbial biofilms by scanning electron microscopy"، Micron، 40 (3): 350–358، doi:10.1016/j.micron.2008.10.005، PMID 19027306.
- International Seabed Authority، "Polymetallic Nodules" (PDF)، isa.org، International Seabed Authority، مؤرشف من الأصل (PDF) في 23 أكتوبر 2021، اطلع عليه بتاريخ 02 فبراير 2021.
- "The CIA secret on the ocean floor"، BBC News (باللغة الإنجليزية)، 19 فبراير 2018، مؤرشف من الأصل في 1 نوفمبر 2021، اطلع عليه بتاريخ 03 مايو 2018.
- "Project Azorian: The CIA's Declassified History of the Glomar Explorer"، National Security Archive at George Washington University، 12 فبراير 2010، مؤرشف من الأصل في 7 أكتوبر 2021، اطلع عليه بتاريخ 18 سبتمبر 2013.
- United Nations Ocean Economics and Technology Office, Technology Branch, United Nations (1978)، Manganese Nodules: Dimensions and Perspectives، Marine Geology، Springer، ج. 41، ص. 343، Bibcode:1981MGeol..41..343C، doi:10.1016/0025-3227(81)90092-X، ISBN 978-90-277-0500-6.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - David B. Wellbeloved, Peter M. Craven, John W. Waudby: Manganese and Manganese Alloys. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005 (doi:10.1002/14356007.a16 077).
- Oebius, Horst U؛ Becker, Hermann J؛ Rolinski, Susanne؛ Jankowski, Jacek A (يناير 2001)، "Parametrization and evaluation of marine environmental impacts produced by deep-sea manganese nodule mining"، Deep Sea Research Part II: Topical Studies in Oceanography، 48 (17–18): 3453–3467، Bibcode:2001DSRII..48.3453O، doi:10.1016/s0967-0645(01)00052-2، ISSN 0967-0645، مؤرشف من الأصل في 12 أغسطس 2021.
- Thompson, Kirsten F.؛ Miller, Kathryn A.؛ Currie, Duncan؛ Johnston, Paul؛ Santillo, David (2018)، "Seabed Mining and Approaches to Governance of the Deep Seabed"، Frontiers in Marine Science، 5، doi:10.3389/fmars.2018.00480، S2CID 54465407.
- R. Elliott, K. Coley, S. Mostaghel, M. Barati: Review of Manganese Processing for Production of TRIP/TWIP Steels, Part 1: Current Practice and Processing Fundamentals. In: JOM. 70, 2018, S. 680, دُوِي:10.1007/s11837-018-2769-4.
- Zhang, Wensheng؛ Cheng, Chu Yong (2007)، "Manganese metallurgy review. Part I: Leaching of ores/secondary materials and recovery of electrolytic/chemical manganese dioxide"، Hydrometallurgy، 89 (3–4): 137–159، doi:10.1016/j.hydromet.2007.08.010.
- Chow, Norman؛ Nacu, Anca؛ Warkentin, Doug؛ Aksenov, Igor & Teh, Hoe (2010)، "The Recovery of Manganese from low grade resources: bench scale metallurgical test program completed" (PDF)، Kemetco Research Inc.، مؤرشف من الأصل (PDF) في 02 فبراير 2012.
- Audi, Georges؛ Bersillon, Olivier؛ Blachot, Jean؛ Wapstra, Aaldert Hendrik (2003)، "The NUBASE evaluation of nuclear and decay properties"، Nuclear Physics A، ج. 729، ص. 3–128، Bibcode:2003NuPhA.729....3A، doi:10.1016/j.nuclphysa.2003.11.001، مؤرشف من الأصل في 9 أغسطس 2017
- Clery, Daniel (04 يونيو 2020)، "The galaxy's brightest explosions go nuclear with an unexpected trigger: pairs of dead stars"، Science، مؤرشف من الأصل في 7 مايو 2021، اطلع عليه بتاريخ 26 يوليو 2021.
- Schaefer, Jeorg؛ Faestermann, Thomas؛ Herzog, Gregory F.؛ Knie, Klaus؛ Korschinek, Gunther؛ Masarik, Jozef؛ Meier, Astrid؛ Poutivtsev, Michail؛ Rugel, Georg؛ Schlüchter, Christian؛ Serifiddin, Feride؛ Winckler, Gisela (2006)، "Terrestrial manganese-53 – A new monitor of Earth surface processes"، Earth and Planetary Science Letters، 251 (3–4): 334–345، Bibcode:2006E&PSL.251..334S، doi:10.1016/j.epsl.2006.09.016.
- J. Schaefer, T. Faestermann, G. Herzog, K. Knie, G. Korschinek, J. Masarik, A. Meier, M. Poutivtsev, G. Rugel, C. Schlüchter: Terrestrial manganese-53 – A new monitor of Earth surface processes. In: Earth and Planetary Science Letters. 251, 2006, S. 334–345, doi:10.1016/j.epsl.2006.09.016.
- Birck, J.؛ Rotaru, M.؛ Allègre, C. (1999)، "53Mn-53Cr evolution of the early solar system"، Geochimica et Cosmochimica Acta، 63 (23–24): 4111–4117، Bibcode:1999GeCoA..63.4111B، doi:10.1016/S0016-7037(99)00312-9.Lugmair, G.؛ Shukolyukov, A. (1998)، "Early solar system timescales according to 53Mn-53Cr systematics"، Geochimica et Cosmochimica Acta، 62 (16): 2863–2886، Bibcode:1998GeCoA..62.2863L، doi:10.1016/S0016-7037(98)00189-6.Trinquier, A.؛ Birck, J.؛ Allègre, C.؛ Göpel, C.؛ Ulfbeck, D. (2008)، "53Mn–53Cr systematics of the early Solar System revisited"، Geochimica et Cosmochimica Acta، 72 (20): 5146–5163، Bibcode:2008GeCoA..72.5146T، doi:10.1016/j.gca.2008.03.023.
- Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337, doi:10.1021/je1011086.
- K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. In: Acta Crystallographica. 1974, B30, S. 193–204, doi:10.1107/S0567740874002469.
- J. A. Oberteuffer, J. A. Ibers: A refinement of the atomic and thermal parameters of α-manganese from a single crystal. In: Acta Crystallographica. 1970, B26, S. 1499–1504, doi:10.1107/S0567740870004399.
- C. B. Shoemaker, D. P. Shoemaker, T. E. Hopkins, S. Yindepit: Refinement of the structure of β-manganese and of a related phase in the Mn-Ni-Si system. In: Acta Crystallographica. B34, 1978, S. 3573–3576, doi:10.1107/S0567740878011620.
- Lide, David R. (2004)، Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics، CRC press، ISBN 978-0-8493-0485-9، مؤرشف من الأصل في 17 ديسمبر 2019، اطلع عليه بتاريخ 07 سبتمبر 2019.
- J. S. Kasper, B. W. Roberts: Antiferromagnetic Structure of α-Manganese and a Magnetic Structure Study of β-Manganese. In: Physical Review. 101, 1956, S. 537–544, doi:10.1103/PhysRev.101.537.
- R. G. W. Wykhoff: Crystal structures. 1963, 1, S. 7–83.
- RÖMPP-Redaktion, Andrea Hartwig (2021)، "Mangan"، RÖMPP Online, Stuttgart, Georg Thieme Verlag، مؤرشف من الأصل في 8 نوفمبر 2021.
- Schmidt, Max (1968)، "VII. Nebengruppe"، Anorganische Chemie II. (باللغة الألمانية)، Wissenschaftsverlag، ص. 100–109.
- Arno H. Reidies: Manganese Compounds. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005 (doi:10.1002/14356007.a16 123).
- Heinrich Remy: Lehrbuch der Anorganischen Chemie. Band II, Akademische Verlagsgesellschaft Geest & Portig, Leipzig 1961, S. 255–258.
- Saha, Amrita؛ Majumdar, Partha؛ Goswami, Sreebrata (2000)، "Low-spin manganese(II) and cobalt(III) complexes of N-aryl-2-pyridylazophenylamines: new tridentate N,N,N-donors derived from cobalt mediated aromatic ring amination of 2-(phenylazo)pyridine. Crystal structure of a manganese(II) complex"، Journal of the Chemical Society, Dalton Transactions (11): 1703–1708، doi:10.1039/a909769d.
- Rayner-Canham, Geoffrey and Overton, Tina (2003) Descriptive Inorganic Chemistry, Macmillan, p. 491, (ردمك 0-7167-4620-4).
- "Ch. 20"، Shriver and Atkins' Inorganic Chemistry، Oxford University Press، 2010، ISBN 978-0-19-923617-6.
- Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner, Wiesbaden 2008, ISBN 978-3-8351-0167-8, S. 460–468.
- Erwin Riedel, Christoph Janiak (2011)، Anorganische Chemie، Walter de Gruyter، ص. 831، ISBN 978-3-11-022566-2.
- Lutar, Karel؛ Jesih, Adolf؛ Žemva, Boris (1988)، "KrF2/MnF4 adducts from KrF2/MnF2 interaction in HF as a route to high purity MnF4"، Polyhedron، ج. 7، ص. 1217–19، doi:10.1016/S0277-5387(00)81212-7.
- Temple, R. B.؛ Thickett, G. W. (1972)، "The formation of manganese(v) in molten sodium nitrite"، Australian Journal of Chemistry، 25 (3): 55، doi:10.1071/CH9720655.
- Luft, J. H. (1956)، "Permanganate – a new fixative for electron microscopy"، Journal of Biophysical and Biochemical Cytology، 2 (6): 799–802، doi:10.1083/jcb.2.6.799، PMC 2224005، PMID 13398447.
- O.G. Koch: Analytische Chemie des Mangans. Springer-Verlag, 2013, ISBN 978-3-642-69853-8, S. 95ff.
- J. Strähle, E. Schweda: Jander · Blasius – Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. Hirzel Verlag, Stuttgart 1995, ISBN 3-7776-0672-3, S. 460.
- J. Strähle, E. Schweda: Jander · Blasius – Einführung in das anorganisch-chemische Praktikum. 14. Auflage. S. Hirzel Verlag, Stuttgart 1995, ISBN 3-7776-0672-3, S. 378–379.
- Umena, Yasufumi؛ Kawakami, Keisuke؛ Shen, Jian-Ren؛ Kamiya, Nobuo (مايو 2011)، "Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å" (PDF)، Nature، 473 (7345): 55–60، Bibcode:2011Natur.473...55U، doi:10.1038/nature09913، PMID 21499260، S2CID 205224374، مؤرشف من الأصل (PDF) في 14 نوفمبر 2021.
- Dismukes, G. Charles؛ Willigen, Rogier T. van (2006)، "Manganese: The Oxygen-Evolving Complex & Models"، Manganese: The Oxygen-Evolving Complex & Models Based in part on the article Manganese: Oxygen-Evolving Complex & Models by Lars-Erik Andréasson & Tore Vänngård which appeared in the Encyclopedia of Inorganic Chemistry, First Edition, First Edition، Encyclopedia of Inorganic Chemistry، doi:10.1002/0470862106.ia128، ISBN 978-0470860786.
- J. Yano u. a.: Where Water Is Oxidized to Dioxygen: Structure of the Photosynthetic Mn4Ca Cluster. In: Science. 314, 2006, S. 821–825, doi:10.1126/science.1128186.
- Erikson, Keith M.؛ Ascher, Michael (2019)، "Chapter 10. Manganese: Its Role in Disease and Health"، في Sigel, Astrid؛ Freisinger, Eva؛ Sigel, Roland K. O.؛ Carver, Peggy L. (Guest editor) (المحررون)، Essential Metals in Medicine:Therapeutic Use and Toxicity of Metal Ions in the Clinic، Metal Ions in Life Sciences، Berlin: de Gruyter GmbH، ج. 19، ص. 253–266، doi:10.1515/9783110527872-016، ISBN 978-3-11-052691-2، PMID 30855111.
{{استشهاد بكتاب}}:|محرر4-الأول=has generic name (مساعدة) - Takeda, A. (2003)، "Manganese action in brain function"، Brain Research Reviews، 41 (1): 79–87، doi:10.1016/S0165-0173(02)00234-5، PMID 12505649، S2CID 1922613.
- Neil A. Law, M. Tyler Caudle, Vincent L. Pecoraro: Manganese Redox Enzymes and Model Systems: Properties, Structures, and Reactivity. In: Advances in Inorganic Chemistry. 46, 1998, S. 305–440, doi:10.1016/S0898-8838(08)60152-X.
- Law, N.؛ Caudle, M.؛ Pecoraro, V. (1998)، Manganese Redox Enzymes and Model Systems: Properties, Structures, and Reactivity، Advances in Inorganic Chemistry، ج. 46، ص. 305، doi:10.1016/S0898-8838(08)60152-X، ISBN 9780120236466.
- Institute of Medicine (US) Panel on Micronutrients (2001)، "Manganese"، Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Chromium, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Chromium، National Academy Press، ص. 394–419، ISBN 978-0-309-07279-3، PMID 25057538.
- R. G. Alscher: Role of superoxide dismutases (SODs) in controlling oxidative stress in plants. In: Journal of Experimental Botany. 53, 2002, S. 1331–1341, doi:10.1093/jexbot/53.372.1331.
- "Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982." (PDF)، مؤرشف من الأصل (PDF) في 19 نوفمبر 2021.
- "Daily Value Reference of the Dietary Supplement Label Database (DSLD)"، Dietary Supplement Label Database (DSLD)، مؤرشف من الأصل في 31 ديسمبر 2020، اطلع عليه بتاريخ 16 مايو 2020.
- "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF)، 2017، مؤرشف من الأصل (PDF) في 17 سبتمبر 2021.
- Tolerable Upper Intake Levels For Vitamins And Minerals (PDF)، European Food Safety Authority، 2006، مؤرشف من الأصل (PDF) في 19 نوفمبر 2021
- "Manganese"، Micronutrient Information Center، Oregon State University, Linus Pauling Institute، 23 أبريل 2014، مؤرشف من الأصل في 5 نوفمبر 2021.
- Bouchard, M. F؛ Sauvé, S؛ Barbeau, B؛ Legrand, M؛ Bouffard, T؛ Limoges, E؛ Bellinger, D. C؛ Mergler, D (2011)، "Intellectual impairment in school-age children exposed to manganese from drinking water"، Environmental Health Perspectives، 119 (1): 138–143، doi:10.1289/ehp.1002321، PMC 3018493، PMID 20855239.
- Devenyi, A. G؛ Barron, T. F؛ Mamourian, A. C (1994)، "Dystonia, hyperintense basal ganglia, and high whole blood manganese levels in Alagille's syndrome"، Gastroenterology، 106 (4): 1068–71، doi:10.1016/0016-5085(94)90769-2، PMID 8143974، مؤرشف من الأصل في 27 مارس 2022.
- Agency for Toxic Substances and Disease Registry (2012) 6. Potential for human exposure, in Toxicological Profile for Manganese, Atlanta, GA: U.S. Department of Health and Human Services. نسخة محفوظة 2021-08-31 على موقع واي باك مشين.
- Pourkhabbaz, A؛ Pourkhabbaz, H (2012)، "Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues"، Iranian Journal of Basic Medical Sciences، 15 (1): 636–644، PMC 3586865، PMID 23493960.
- Talhout, Reinskje؛ Schulz, Thomas؛ Florek, Ewa؛ Van Benthem, Jan؛ Wester, Piet؛ Opperhuizen, Antoon (2011)، "Hazardous Compounds in Tobacco Smoke"، International Journal of Environmental Research and Public Health، 8 (12): 613–628، doi:10.3390/ijerph8020613، PMC 3084482، PMID 21556207.
- Bernhard, David؛ Rossmann, Andrea؛ Wick, Georg (2005)، "Metals in cigarette smoke"، IUBMB Life، 57 (12): 805–9، doi:10.1080/15216540500459667، PMID 16393783، S2CID 35694266.
- Hernroth, Bodil؛ Krång, Anna-Sara؛ Baden, Susanne (فبراير 2015)، "Bacteriostatic suppression in Norway lobster (Nephrops norvegicus) exposed to manganese or hypoxia under pressure of ocean acidification"، Aquatic Toxicology، 159: 217–224، doi:10.1016/j.aquatox.2014.11.025، ISSN 0166-445X، PMID 25553539، مؤرشف من الأصل في 22 نوفمبر 2021.
- Verhoeven, John D. (2007)، Steel metallurgy for the non-metallurgist، Materials Park, Ohio: ASM International، ص. 56–57، ISBN 978-0-87170-858-8، مؤرشف من الأصل في 27 مارس 2022.
- Manganese USGS 2006
- Dastur, Y. N.؛ Leslie, W. C. (1981)، "Mechanism of work hardening in Hadfield manganese steel"، Metallurgical Transactions A، 12 (5): 749–759، Bibcode:1981MTA....12..749D، doi:10.1007/BF02648339، S2CID 136550117.
- Stansbie, John Henry (2007)، Iron and Steel، Read Books، ص. 351–352، ISBN 978-1-4086-2616-0، مؤرشف من الأصل في 20 نوفمبر 2021.
- Brady, George S.؛ Clauser, Henry R.؛ Vaccari. John A. (2002)، Materials Handbook: an encyclopedia for managers, technical professionals, purchasing and production managers, technicians, and supervisors، New York, NY: McGraw-Hill، ص. 585–587، ISBN 978-0-07-136076-0، مؤرشف من الأصل في 22 نوفمبر 2021.
- Kaufman, John Gilbert (2000)، "Applications for Aluminium Alloys and Tempers"، Introduction to aluminum alloys and tempers، ASM International، ص. 93–94، ISBN 978-0-87170-689-8.
- Kuwahara, Raymond T.؛ Skinner III, Robert B.؛ Skinner Jr., Robert B. (2001)، "Nickel coinage in the United States"، Western Journal of Medicine، 175 (2): 112–114، doi:10.1136/ewjm.175.2.112، PMC 1071501، PMID 11483555.
- "Design of the Sacagawea dollar"، United States Mint، مؤرشف من الأصل في 22 أبريل 2021، اطلع عليه بتاريخ 04 مايو 2009.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة) - Dell, R. M. (2000)، "Batteries fifty years of materials development"، Solid State Ionics، 134 (1–2): 139–158، doi:10.1016/S0167-2738(00)00722-0.
- Shigeo Shionoya, William M. Yen, Hajime Yamamoto (Hrsg.): Phosphor Handbook. 2. Auflage. CRC Press, Boca Raton, FL 2006, ISBN 0-8493-3564-7, S. 153ff.
- Chen, Daquin؛ Zhou, Yang؛ Zhong, Jiasong (2016)، "A review on Mn4+ activators in solids for warm white light-emitting diodes"، RSC Advances، 6 (89): 86285–86296، Bibcode:2016RSCAd...686285C، doi:10.1039/C6RA19584A.
- Baur, Florian؛ Jüstel, Thomas (2016)، "Dependence of the optical properties of Mn4+ activated A2Ge4O9 (A=K,Rb) on temperature and chemical environment"، Journal of Luminescence، 177: 354–360، Bibcode:2016JLum..177..354B، doi:10.1016/j.jlumin.2016.04.046.
- Jansen, T.؛ Gorobez, J.؛ Kirm, M.؛ Brik, M. G.؛ Vielhauer, S.؛ Oja, M.؛ Khaidukov, N. M.؛ Makhov, V. N.؛ Jüstel, T. (01 يناير 2018)، "Narrow Band Deep Red Photoluminescence of Y2Mg3Ge3O12:Mn4+,Li+ Inverse Garnet for High Power Phosphor Converted LEDs"، ECS Journal of Solid State Science and Technology، 7 (1): R3086–R3092، doi:10.1149/2.0121801jss.
- Jansen, Thomas؛ Baur, Florian؛ Jüstel, Thomas (2017)، "Red emitting K2NbF7:Mn4+ and K2TaF7:Mn4+ for warm-white LED applications"، Journal of Luminescence، 192: 644–652، Bibcode:2017JLum..192..644J، doi:10.1016/j.jlumin.2017.07.061.
- Zhou, Zhi؛ Zhou, Nan؛ Xia, Mao؛ Yokoyama, Meiso؛ Hintzen, H. T. (Bert) (06 أكتوبر 2016)، "Research progress and application prospects of transition metal Mn4+-activated luminescent materials"، Journal of Materials Chemistry C، 4 (39): 9143–9161، doi:10.1039/c6tc02496c.
- "TriGain LED phosphor system using red Mn4+-doped complex fluorides" (PDF)، GE Global Research، مؤرشف من الأصل (PDF) في 31 أغسطس 2021، اطلع عليه بتاريخ 28 أبريل 2017.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة) - Shepard, Anna Osler (1956)، "Manganese and Iron–Manganese Paints"، Ceramics for the Archaeologist، Carnegie Institution of Washington، ص. 40–42، ISBN 978-0-87279-620-1.
- Smith, Andrew E.؛ وآخرون (02 ديسمبر 2009)، "(3+)Mn in Trigonal Bipyramidal Coordination: A New Blue Chromophore"، Journal of the American Chemical Society، 131 (47): 17084–17086، doi:10.1021/ja9080666، ISSN 0002-7863، PMID 19899792.
- Leigh A. Graham؛ Alison R. Fout؛ Karl R. Kuehne؛ Jennifer L. White؛ Bhaskar Mookherji؛ Fred M. Marks؛ Glenn P. A. Yap؛ Lev N. Zakharov؛ Arnold L. Rheingold & Daniel Rabinovich (2005)، "Manganese(I) poly(mercaptoimidazolyl)borate complexes: spectroscopic and structural characterization of MnH–B interactions in solution and in the solid state"، Dalton Transactions (1): 171–180، doi:10.1039/b412280a، PMID 15605161.
- "Oxidation Reaction of Allylic and Benzylic Alcohol" (PDF)، UNIVERSITY of WISCONSIN–MADISON، نوفمبر 2021، مؤرشف من الأصل (PDF) في 22 نوفمبر 2021.
- M. F. Bellin: MR contrast agents, the old and the new. In: European Journal of Radiology Band 60, Nummer 3, Dezember 2006, S. 314–323, doi:10.1016/j.ejrad.2006.06.021. PMID 17005349.
- Hasan, Heather (2008)، Manganese، The Rosen Publishing Group، ص. 31، ISBN 978-1-4042-1408-8، مؤرشف من الأصل في 22 نوفمبر 2021.
- "Manganese Chemical Background"، Metcalf Institute for Marine and Environmental Reporting University of Rhode Island، أبريل 2006، مؤرشف من الأصل في 28 أغسطس 2006، اطلع عليه بتاريخ 30 أبريل 2008.
- "Risk Assessment Information System Toxicity Summary for Manganese"، Oak Ridge National Laboratory، مؤرشف من الأصل في 21 نوفمبر 2021، اطلع عليه بتاريخ 23 أبريل 2008.
- Annette Santamaria, Sandra Sulsky: Risk Assessment of an Essential Element: Manganese. In: Journal of Toxicology and Environmental Health, Part A. 73, 2010, S. 128–155, doi:10.1080/15287390903337118.
- "Safety and Health Topics: Manganese Compounds (as Mn)"، U.S. Occupational Safety and Health Administration، مؤرشف من الأصل في 1 أغسطس 2017.
- "NIOSH Pocket Guide to Chemical Hazards – Manganese compounds and fume (as Mn)"، Centers for Disease Control، مؤرشف من الأصل في 21 نوفمبر 2021، اطلع عليه بتاريخ 19 نوفمبر 2015.
- "Drinking Water Contaminants"، US EPA، مؤرشف من الأصل في 14 مايو 2021، اطلع عليه بتاريخ 02 فبراير 2015.
- Ong, K. L.؛ Tan, T. H.؛ Cheung, W. L. (1997)، "Potassium permanganate poisoning – a rare cause of fatal self poisoning"، Emergency Medicine Journal، 14 (1): 43–45، doi:10.1136/emj.14.1.43، PMC 1342846، PMID 9023625.
- Young, R.؛ Critchley, J. A.؛ Young, K. K.؛ Freebairn, R. C.؛ Reynolds, A. P.؛ Lolin, Y. I. (1996)، "Fatal acute hepatorenal failure following potassium permanganate ingestion"، Human & Experimental Toxicology، 15 (3): 259–61، doi:10.1177/096032719601500313، PMID 8839216، S2CID 8993404، مؤرشف من الأصل في 27 مارس 2022.
- "Manganese-Induced Parkinsonism Is Not Idiopathic Parkinson's Disease: Environmental and Genetic Evidence"، Toxicological Sciences (Review)، 146 (2): 204–12، أغسطس 2015، doi:10.1093/toxsci/kfv099، PMC 4607750، PMID 26220508.
- Cersosimo, M. G.؛ Koller, W.C. (2007)، "The diagnosis of manganese-induced parkinsonism"، NeuroToxicology، 27 (3): 340–346، doi:10.1016/j.neuro.2005.10.006، PMID 16325915.
- Lu, C. S.؛ Huang, C.C؛ Chu, N.S.؛ Calne, D.B. (1994)، "Levodopa failure in chronic manganism"، Neurology، 44 (9): 1600–1602، doi:10.1212/WNL.44.9.1600، PMID 7936281، S2CID 38040913، مؤرشف من الأصل في 27 مارس 2022.
- "Manganese-Induced Parkinsonism and Parkinson's Disease: Shared and Distinguishable Features"، Int J Environ Res Public Health (Review)، 12 (7): 7519–40، يوليو 2015، doi:10.3390/ijerph120707519، PMC 4515672، PMID 26154659.
- "Manganese-induced neurotoxicity: a review of its behavioral consequences and neuroprotective strategies"، BMC Pharmacology & Toxicology (Review)، 17 (1): 57، نوفمبر 2016، doi:10.1186/s40360-016-0099-0، PMC 5097420، PMID 27814772.
- Lazrishvili, I.؛ وآخرون (2016)، "Manganese loading induces mouse-killing behaviour in nonaggressive rats"، Journal of Biological Physics and Chemistry، 16 (3): 137–141، doi:10.4024/31LA14L.jbpc.16.03.
- بوابة العناصر الكيميائية
- بوابة علم المواد
- بوابة الكيمياء
