حديد
الحديد عنصرٌ كيميائي رمزه Fe وعدده الذرّي 26، وهو ينتمي إلى عناصر المستوى الفرعي d ويقع على رأس عناصر المجموعة الثامنة في الجدول الدوري؛ ويصنّف كيميائياً ضمن الفلزّات الانتقالية. قياساً بالنسبة إلى الكتلة فإنّ الحديد يأتي في المرتبة الأولى من حيث وفرة العناصر الكيميائية في الأرض (32.1%)، وخاصّةً في اللبّ الداخلي والخارجي في باطن الأرض؛ في حين أنّه يأتي في المرتبة الرابعة من حيث وفرة العناصر الكيميائية في القشرة الأرضية، وذلك بعد الأكسجين والسيليكون والألومنيوم؛ بالتالي فهو ثاني أكثر الفلزّات وفرةً في القشرة الأرضية؛ لذلك تنتشر خامات الحديد في عددٍ من مناطق العالم.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فلزي الخطوط الطيفية للحديد | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | حديد، 26، Fe | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 8، 4، d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 55.845 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ar]; 3d6 4s2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 14, 2 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 7.874 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 6.98 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1811 ك، 1538 °س، 2800 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 3134 ك، 2862 °س، 5182 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 13.81 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 340 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 25.10 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.83 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 762.5 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1561.9 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 2957 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 126 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | (لف مغزلي منخفض) 132±3،
(لف مغزلي مرتفع) 152±6 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الجسم | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية حديدية | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1043 كلفن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 96.1 نانوأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 80.4 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 11.8 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | (درجة حرارة الغرفة) 5120 متر·ثانية−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 211 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 82 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 170 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة فيكرز | 608 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 490 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7439-89-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الحديد | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
يستلزم استخراج الحديد من خاماته تطبيق درجات حرارة مرتفعة في القمائن أو الأفران تصل إلى 1500 °س أو أكثر؛ وهي درجات حرارة أعلى بحوالي 500 °س من تلك المتطلّبة لصهر النحاس؛ لذلك فإنّ الفلزّ الأخير اكتشف قبل الحديد في تاريخ تطوّر البشرية. تمكّن الإنسان من اكتشاف الحديد في أوراسيا في الألفية الثانية قبل الميلاد، وفي حوالي 1200 سنة قبل الميلاد بدأ انتشار استخدام الأدوات والمعدّات الحديدية، لتحلّ مكان الأدوات المصنوعة من سبائك النحاس مثل البرونز. كانت تلك الفترة الزمنية فاصلة في تاريخ البشرية، إذ تمثّل الانتقال من العصر البرونزي إلى العصر الحديدي. تمكّن الإنسان فيما بعد من تطوير سبائك مختلفة للحديد، أهمّها سبائك الفولاذ [ملاحظة 1] المختلفة، مثل الفولاذ المقاوم للصدأ والفولاذ السبائكي؛ وكذلك الحديد المطاوع وحديد الصب [ملاحظة 2].
في الحالة النقية وبمعزلٍ عن الهواء يكون الحديد في الظروف القياسية على شكل فلزّ ذو لون رمادي فضّي، وتكون سطوحه ناعمة وملساء. بالمقابل، يؤدّي التماس مع أكسجين الهواء وبوجود الرطوبة إلى تفاعل الحديد وتشكيله طبقةً بنّيّةً محمرّةً من أكاسيد الحديد المُمَيّهة، والتي تدعى بالاسم الشائع: «الصَدَأ». على العكس من أكاسيد الفلزّات الأخرى القادرة على تشكيل طبقات أكسيد مُخَمِّلة، فإنّ صدأ الحديد يشغل حجماً أكبر من الفلزّ ذاته، ممّا يؤدّي بالتالي إلى تقشّر سطح الحديد عندما يصدأ، ممّا يفتح المجال إلى صدأ طبقات جديدة، وهكذا دواليك. من الناحية الكيميائية، يوجد للحديد حالتا أكسدة شائعتان، وهما الحديد الثنائي والحديد الثلاثي. يشترك الحديد في خواصّه العامّة مع خواص الفلزّات الانتقالية الأخرى، بما في ذلك عُنصرَي المجموعة الثامنة المتبقِّيَين: الروثينيوم والأوزميوم. يشكّل الحديد عدداً كبيراً من المركّبات الكيميائية في مختلف حالات الأكسدة من −2 إلى +7؛ بالإضافة إلى تشكيل عددٍ من المعقّدات التناسقية مثل الفِرّوسين وفِرّي أكسالات البوتاسيوم وأزرق بروسيا، والتي لها عددٌ من التطبيقات المعروفة.
يحوي الإنسان البالغ على حوالي 4 غرامات من الحديد، أي ما يعادل 0.005% من وزن الجسم، وذلك غالباً على شكل هيموغلوبين وميوغلوبين. يقوم جزيئا البروتين المذكورَين بدورٍ مهمٍّ في استقلاب الفقاريات، وذلك على الترتيب في نقل الأكسجين في الدم، وفي تخزينه في العضلات. لذلك يعدّ وجود الحديد في الجسم ضرروياً، وهو من المغذّيات الأساسية، إذ يدخل في دورة استقلابية، لذلك ينبغي تعويضه ضمن الطعام بشكلٍ مستمرٍّ. يوجد الحديد أيضاً في المواقع النشطة في عددٍ من إنزيمات الأكسدة والاختزال المهمّة والضرورية للتنفّس الخلوي عند النباتات والحيوانات.
التاريخ
لا يوجد شكٌّ في أنّ الحديد كان واحداً من العناصر المعروفة للإنسان القديم؛[1] إذ توجد أدلّة وشواهد تاريخية متنوّعة على استخدام الحديد في مختلف الحضارات عبر عمليات التنقيب الأثرية في مختلف أرجاء العالم؛ إلّا أنّ تلك الشواهد التاريخية تعدّ قليلةً نسبياً بالمقارنة مع القطع الأثرية المصنوعة من البرونز، أو تلك المصنوعة من الفلزّات النبيلة مثل الذهب والفضّة. قد يعود ذلك إلى أنّ استخدام الحديد كان محدوداً في الفترات التاريخية القديمة، ومن جهةٍ أخرى، فإنّ الحديد عرضةٌ للتآكل في الأجواء الرطبة،[1] لذلك فإنّ الكثير من تلك المُقتَنَيات المصنوعة من الحديد قد فَنِيَت مع مرور الزمن، ولم يبقَ إلا الضخم منها والمحفوظ ضمن ظروفِ خاصّةٍ.[2]
الاستخدام المبكر للحديد النيزكي
.svg.png.webp)
قبل أن يتعلّم الإنسان في مختلف الحضارات القديمة استخراج الحديد من خاماته، كان الإنسان حتّى قبل بداية العصر الحديدي على تماسٍ مع الحديد من خلال الأحجار النَيزَكية المنتشرة على سطح الأرض في عصر ما قبل التاريخ؛ إذ يعود تاريخ أقدم المنتجات الحديدية إلى الألفية الخامسة قبل الميلاد، وكانت مصنوعةً من النيازك.[3] خُصِّصَ هذا النوع من الحديد لاحقاً باسم «الحديد النَيزَكِي» [ملاحظة 3]؛ وهو يتميّز بارتفاع محتوى عنصر النيكل فيه (5-18%). نظراً لنُدرَته فقد كان الحديد النيزكي قيّماً، وكان اسمه في اللغة الهيروغليفية المصرية يشير إلى هبوطه من السماء؛[4] وكان يستخدم في صناعة الأسلحة والأدوات اللازمة لطقوس فتح الفم، بالإضافة إلى استخدامه في صناعة التمائم والحُلِي من جهةٍ أخرى.[5] فقد عُثِرَ في مصر القديمة على خَرَزٍِ للزينة مصنوعٍ من الحديد النيزكي، والتي تعود إلى حضارة جرزة حوالي 3500 سنة قبل الميلاد.[1][6] كما عُثِرَ أيضاً على خنجرٍ من الحديد النيزكي في قبر توت عنخ آمون، وما أكّد مصدره النيزكي أنّ نسبة العناصر الكيميائية من الحديد والكوبالت والنيكل مماثلة لنسبتها في حجرٍ نيزكيٍّ مكتشفٍ بالقرب من تلك المنطقة، والذي قد يكون قد هبط من زخّة شهبٍ قديماً.[7][8][9]
عُثِرَ أيضاً في منطقة بلاد الرافدين على مكتشفاتٍ أثريّةٍ مصنوعةٍ من الحديد النيزكي؛ فبالقرب من مدينة أور عُثِرَ على خنجرٍ ذي نصلٍ مصنوعٍ من حديد نيزكي يعود إلى الحضارة السومرية قبل حوالي 3100 سنة قبل الميلاد.[4][10] بالمقارنة مع الأنواع الأخرى، فإنّ الحديد النيزكي طريٌّ ومطواعٌ نسبياً، وقابلٌ للسحب والطرق، ومن السهل تطريقه على البارد، إلّا أنّه من السهل أن يتقصّف عند تسخيته، بسبب الارتفاع النسبي لمحتوى النيكل فيه.[11]
الاستخراج من الخامات الأرضية

بدأت صناعة الحديد منذ العصر البرونزي الأوسط، ثمّ تطلّب الأمر مرورَ عدّة قرونٍ إلى أنْ حلّ الحديد مكان البرونز في صناعة العِدَد والأسلحة. لم تكن الحرارة الناتجة كافيةً لصهر الحديد، لذا فإنّ الجزء السفلي من المعدن الناتج يكون على شكل كتلةٍ إسفنجية، تعجُّ بالمسام الممتلئة بالرماد والخبث. يعاد تسخين الحديد الناتج لتليينه وصهر الخَبَث، ومن ثُمّ يُطرق مراراً وتكراراً لإزالة الخَبَث المنصهر. ناتج هذه العملية الطويلة والشاقّة هو «الحديد المطاوع» [ملاحظة 5]، وهو سبيكة مرنة ولكن ضعيفة نوعاً ما. تشير القطع الأثرية المُستَحصلة من آسيا الوسطى وبلاد الرافدين وبلاد الشام إلى أنّها مصنوعةٌ من الحديد المستخرج في فترة زمنية تقع بين 3000 إلى 2700 سنة قبل الميلاد.[1] إذ عُثرَ في إشنونة، الواقعة حالياً في العراق، على خنجرٍ ذي نصلٍ مصنوعٍ من حديدٍ خالٍ من النيكل، ممّا يشير إلى استخراجه من مصادر أرضية وليس من الأحجار النيزكية.[4][12][13]

عَرَف الحيثيّون هذا الفلزّ أيضاً؛ إذ تشير الكتابات الأثرية في أرشيف بوغاز كوي إلى أنّ الحديد كان معروفاً أثناء حقبة الملك الحيثي أنيتا [ملاحظة 6] (حوالي 1800 سنة قبل الميلاد)؛[4] وتشير الاكتشافات إلى قيام الحيثيين بصهر الحديد في الفترة ما بين 1500 إلى 1200 سنة قبل الميلاد؛[14] وذلك في أفرانٍ يستخدم فيها منفاخٌ لضخّ الهواء من خلال كومة من الحديد الخام والمدفون في الفحم.[15][16] في البداية صنع الحيثيون الحليّ من الحديد،[17] كما قايضوا الحديد مقابل الفضّة مع الآشوريين في القرن الرابع عشر قبل الميلاد؛[3] وبذلك شاع استخدام الحديد في باقي مناطق الشرق الأدنى إلى حين سقوط إمبراطورية الحيثيين حوالي سنة 1180 قبل الميلاد؛ في الفترة التاريخية التي تمثّل بداية العصر الحديدي.[1][2] تميّزت بداية العصر الحديدي بانهيارٍ متسارعٍ للحضارات والثقافات التي كانت سائدة في العصر البرونزي؛ وتزامنت المئوية الأولى من العصر الحديدي مع حلول العصور المظلمة اليونانية، والتي هُدّمت فيها العديد من المدن وتضرّرت التجارة وتقطّعت طرقها، كما تراجع إنتاج الأدوات المعدنية بشكلٍ كبيرٍ. اختلف انتقال بلدان العالم القديم إلى العصر الحديدي، فبلاد ما بين النهرين كانت قد انتقلت كلّياً للعصر الحديدي حوالي سنة 900 قبل الميلاد. وعلى الرغم من أنّ مصر القديمة كانت قد بدأت تنتج الحديد منذ وقتٍ مبكّرٍ، إلّا أنّ العصر البرونزي ظلّ مسيطراً عليها حتّى الغزو الآشوري لها في سنة 663 قبل الميلاد؛ وحوالي سنة 500 قبل الميلاد، أصبحت النوبة منتِجَاً ومصدِّراً رئيسياً للحديد.[18]
عَرَفت العديد من الحضارات الفولاذ، والذي كان يُستحصَل عليه في أفران الحديد الخالص [ملاحظة 7]؛ إذ كان الحدّادون في المناطق غربيّ جبال زاغروس ماهرين في إنتاج الفولاذ الجيّد حوالي 1000 سنة قبل الميلاد.[1] وهناك بقعٌ جغرافية أخرى شهدت تطوّر صناعة الحديد والفولاذ؛ إذ تشير الدلائل أيضاً إلى صهر الحديد في القارة الأفريقية حوالي القرن الثامن قبل الميلاد، وذلك في زمبابوي؛[1] وفي جنوب الصحراء الكبرى؛[19] وذلك في مواقع عدّة مثل نجد ترميت [ملاحظة 8] في النيجر، وفي موقع تاروغا [ملاحظة 9] الأثري جنوبي شرقي نيجيريا.[2]
كما شهدت شبه القارة الهندية تطوّراً في المعارف المتعلّقة بتعدين الحديد، إذ تشير بعض الدلائل إلى إنتاج الحديد المطاوع عن طريق صهر خاماته في الفترة الواقعة بين 1800 إلى 1200 سنة قبل الميلاد في الهند؛[20] كما توجد إشارات إلى الحديد في النصوص الهندوسية مثل أتارفافيدا [ملاحظة 10].[21] كما ظهرت بعد ذلك نماذج محسّنة ومطوّرة مثل الفولاذ الهندواني [ملاحظة 11] حوالي 300 سنة قبل الميلاد.[2] ففي جنوب الهند وسيريلانكا جرى التمكّن من إنتاج فولاذ مرتفع الجودة بصهر الحديد الخام والفحم والزجاج في بواتق حتّى ينصهر الحديد ويذيب الكربون.[22] انتقلت تلك الفكرة من الهند إلى الصين بحلول القرن الخامس الميلادي؛ ثم انتشر استخدام الحديد في الصين في الفترة ما بين 700 إلى 500 سنة قبل الميلاد؛[23] وكانت طرائق وعمليات صهر الحديد قد وصلت إليها عبر آسيا الوسطى.[24] تمكن الصينيون من إنتاج حديد الصبّ أوّل مرّة في القرن الخامس قبل الميلاد.[25] عُثِرَ على أقدم الآثار المصنوعة من الحديد الصبّ في الصين في مقاطعة جيانغسو؛ واستخدمه الصينيون القدماء في مجال صناعة الأسلحة وفي البناء والزراعة.[26] استخدمت أفران الدَسْت [ملاحظة 12] في فتراتٍ عاصرت حقبة الممالك المتحاربة (403–221 سنة قبل الميلاد).[27] بقي استعمال الأفران اللافحة وأفران الدَسْت مستمرّاً خلال حِقْبَتَي سُلالَتي سونغ وتانغ الحَاكِمَتَين.[28][29]

تعود أقدم الآثار لاستخراج الحديد في المناطق اليونانية إلى حوالي 2000 سنة قبل الميلاد على شكل خَبَثِ في موقع هاغيا تريادا الأثري على جزيرة كريت.[4] انتشر استخدام الحديد في اليونان القديمة في نهاية القرن الحادي عشر قبل الميلاد، ومنها وصل إلى أوروبا.[30] تعدّ بعض المُقْتَنَيات من الحضارة الإتروسكانية والمُكتَشَفة بالقرب من قبور في مدينة بولونيا الإيطالية واحدةً من أقدم المكتشفات الأثرية الأوروبية للحديد، وهي تعود إلى حوالي القرن التاسع قبل الميلاد.[31] يُقَسّم العصر الحديدي في وسط أوروبا إلى فترَتين زمنيَّتَين، وهما: حضارة هالستات (من 800-450 سنة قبل الميلاد) وحضارة لاتين (بداية من 450 سنة قبل الميلاد).[2] ترافق انتشار صناعة الحديد في وسط وغربي أوروبا مع توسّع القلط؛ ووفقاً للكاتب بلينيوس الأكبر كان استخدام الحديد شائعاً في حقبة روما القديمة.[1]
العصور الوسطى

أثناء فترة العصور الوسطى طُوّرت طرائق إنتاج الحديد المطاوع؛ إذ انتشرت ورشات الحدادة التي قامت بتحويل الحديد الغُفْل إلى الحديد الممتاز [ملاحظة 13]؛ وكان وقود الفحم النباتي أساسيّاً في تلك العمليّات.[33] تقدّمت صناعة الحديد أكثر وأكثر باختراعات المسلمين خلال العصر الذهبي للإسلام. شمل ذلك إنشاء مواقع لإنتاج المعادن. وبحلول القرن الحادي عشر، انتشرت تلك المنشآت في كلّ الولايات الإسلامية من الأندلس وشمال أفريقيا غرباً إلى آسيا الوسطى شرقاً.[34] كما أنّ هناك دلائلٌ تشير إلى استخدام ما يشبه الفرن اللافح في عصر الدولة الأيوبية والمماليك.[35] حضّر يعقوب بن إسحاق الكندي (ت 260هـ، 873م) أنواعاً من الحديد الفولاذ بأسلوب المزج والصهر، فقد مَزَج كمّيّة من الحديد المطاوع، وكمّيّة أخرى من الحديد الصلب وصهرهما معاً ثم سخّنهما إلى درجة حرارة معلومة بحيث نتج عن ذلك حديد يحتوي على نسبةٍ من الكربون تتراوح بين (0.5 و 1.5%) ومع الوقت، اكتشف الحدّادون أنّ الحديد المطاوع يمكن أن يتحوّل إلى منتجٍ أقوى بكثيرِ عن طريق تسخينه في وعاءِ يحتوي على الفحم النباتي لبعض الوقت، ومن ثمّ غمره في الماء أو الزيت حتى يخمد. وبذلك اخترع المسلمون أحد أشهر أنواع الفولاذ في العصور الوسطى وهو الفولاذ الدمشقي، واستخدموه في صناعة السيوف، في الفترة من سنة 900 إلى سنة 1750.[36] أُنتِجَ هذا الفولاذ باستخدام بواتقٍ بطريقة تشبه الطريقة الهندية، ولكنه يحتوي على الكربيدات ممّا يجعل السيوف أكثر كفاءةً في القطع.[37]
نتيجةً لنشاط الطُرُق التجارية ببن الشرق الأدنى والشرق الأقصى وصلت تقنيات إنتاج الفولاذ إلى الصين؛ ففي القرن الحادي عشر، صنع الصينيون الفولاذ عن طريق إزالة الكربون جزئياً بطَرْق الحديد بصورة متكرّرة مع نفخ الهواء البارد.[38] واستمرّت الصين بتطوير تقنيات إنتاج الحديد وبقيت مركزاً مهمّاً للصناعات المعدنية.[2] وصلت تقنيات الأفران اللافحة وإنتاج الفولاذ والحديد الصب إلى أوروبا في وقتٍ متأخّر، فتعود أقدم قطع الحديد الصبّ هناك والتي عثر عليها في السويد إلى الفترة الزمنية ما بين سنتي 1150 و1300 للميلاد؛[39] وفي القرن الخامس عشر ظهرت الحاجة إلى تطوير صناعة الحديد في أوروبا مع ازدياد الطلب على إنتاج المصبوبات الحديدية من الطلقات المستديرة للمدافع.[40]
كانت أفران الحديد الخالص هي الوسيلة الشائعة المنتشرة لتعدين الحديد، إلى حين ظهور الأفران اللافحة. بَلَغَ طول الأفران اللافحة في القرون الوسطى حوالي ثلاثة أمتار (عشرة أقدام)، وكانت مصنوعةً من طابوق مقاوم للنيران؛ أمّا الهواء اللازم لإيقاد النار فكان يُنفَخ يدوياً بالكير.[41] على الرغم من تطوّر تصميم الأفران اللافحة في العصور الحديثة، إلّا أنّها لا تزال تعمل على نفس المبدأ الذي كان مستخدماً في القرون الوسطى.[33]
العصور الحديثة

يعدّ أبراهام داربي الأول [ملاحظة 14] رائداً في التأسيس لفكرة استخدام الأفران اللافحة العاملة بفحم الكوك من أجل إنتاج حديد الصبّ، وذلك بدلاً من الفحم النباتي؛ ففي سنة 1709 تمكّن داربي من تطوير أوّل فرنٍ من هذا النوع في مدينة برمنغهام البريطانية.[42] أتاح تطوّر صناعة الحديد ووفرته وانخفاض ثمنه في انطلاق الثورة الصناعية؛ فقد أصبح الحديد مع تطوّر عمليات استخراجه متاحاً ورخيص الثمن، ممّا وفّر مادّة بناءٍ أوّلية أساسية، فقد استخدم في بناء أوّل جسرٍ حديديٍّ في سنة 1778، والذي لا يزال قائماً إلى حدّ الآن. بالإضافة إلى بناء الجسور فقد استخدم الحديد أيضاً في بناء خطوط السكك الحديدية، والتي ساهم تمديدها في سرعة انتشار التطوّر والحداثة.[43] استُخدِمَ الحديد أيضاً في بناء القوارب والسفن والأبنية والعمارات؛ بالإضافة إلى أسطوانات المحرّك البخاري.[33]
أثناء مطلع الثورة الصناعية في بريطانيا بدأ هنري كورت [ملاحظة 15] بتطوير عمليات تنقية الحديد وتحويله من حديد غفل إلى حديد مطاوع باستخدام طرائق مبتكرة؛ ففي سنة 1783 سجّل كورت براءة اختراع لعملية التَسْويط [ملاحظة 16] من أجل تنقية خام الحديد، والتي خضعت فيما بعد إلى عمليات تطوير لاحقة.[44] انتشرت الأفران اللافحة لاستخراج الحديد في أوروبا، ويعود أقدم فرنٍ من هذا النوع في ألمانيا إلى سنة 1796.[45] في خمسينيات القرن التاسع عشر اخترع هنري بِسِمِر [ملاحظة 17] طريقةً جديدةً لإنتاج الفولاذ، والتي سُمّيت باسمه «عمليّة بِسِمِر» [ملاحظة 18]، ممّا جعل في النهاية من عملية إنتاج الفولاذ أكثر اقتصادية، وانخفض بذلك إنتاج الحديد المطاوع بكمّيّات كبيرة.[46]
الوفرة الطبيعية
يأتي الحديد في المرتبة الأولى من حيث وفرة العناصر الكيميائية في الأرض (32.1%)؛[47] رغم وجود بعض المصادر التي تضعه في المرتبة الثانية بنسبة كتلية مقدارها 28.8%.[48] وهو يأتي في المرتبة الرابعة من حيث الوفرة في وشاح الأرض بنسبة 4.70%؛[49] وفي المرتبة الرابعة أيضاً من حيث الوفرة في القشرة الأرضية بنسبة 5.63%؛[50] أمّا في مياه البحار والمحيطات فتبلغ نسبة الحديد المنحلّ مجرّد 0.002 ميليغرام/الليتر.[51]
- الوفرة الكونية

يأتي الحديد في المرتبة السادسة وفقاً لوفرة العناصر الكيميائية الكلّية في الكون؛ أمّا بالنسبة للوفرة النسبية في الكون بالنسبة إلى السيليكون وبالنسبة لعدد الذرّات، فإنّ الحديد يأتي في المرتبة التاسعة.[52] يتخلّق الحديد في الكون أثناء الخطوة الأخيرة من عملية احتراق السيليكون في النجوم العملاقة.[53] يُظنّ أيضاً أنّ الكواكب الأرضية الأخرى، وهي عطارد والزهرة والمريخ بالإضافة إلى القمر، حاويةٌ أيضاً على نواةٍ فلزّيةٍ يتكوّن معظمها من الحديد؛ وكذلك الأمر مع الكويكبات من النوع-M. تعود وفرة الحديد في الكواكب الأرضية نتيجةً إلى الأصل الكوني المشترك، حيث ينتج الحديد بوفرة أثناء مرحلة اندماج الانفلات الحراري [ملاحظة 20] وانفجار المستعرات العظمى من النوع Ia [ملاحظة 21]، والذي يؤدّي إلى بعثرة عنصر الحديد في الكون.[54][55] يعود اللون الأحمر المسيطر على سطح كوكب المريخ إلى حطامٍ صخريٍّ غنيٍّ بأكاسيد الحديد.[56]
- عنصر الحديد في الأرض
يعدّ الحديد أكثر العناصر الكيميائية وفرةً في الأرض، ويتركّز معظمه، بالإضافة إلى النيكل في نواة الأرض، وذلك في اللبّ الداخلي والخارجي لها.[57][58] يساهم الحديد المنصهر في باطن الأرض في تشكّل المجال المغناطيسي الأرضي.[59]
تعدّ النيازك الحديدية الشكل الرئيسي للحديد الفلزّي الطبيعي على سطح الأرض؛ وتاريخياً توجد العديد من الأمثلة على المواقع الأثرية التي عثر فيها على أشياء مصنوعة بالتطريق البارد من الحديد النيزكي؛ وكان يستدلّ على ذلك بارتفاع محتوى النيكل فيها بالمقارنة مع الحديد المستخرَج من الخامات الأرضية. يتألّف حوالي 5% من الأحجار النيزكية من معدَنَين مميّزَين يتألّفَان من الحديد والنيكل، وهما التاينيت [ملاحظة 22] (35–80% حديد) والكاماسيت [ملاحظة 23] (90–95% حديد).[60]

يمثّل حديد السبخات إحدى الأشكال الطبيعية التي يمكن أن يعثر فيها على الحديد بشكله الطبيعي؛ كما يمكن أن يُعثَر عليه أيضاً بشكلٍّ نادرِ في صخور البازلت المتشكّلة من الصهارة الأرضية، والتي تلامست مع الصخور الرسوبية الغنيّة بالكربون، ممّا أدّى إلى التقليل من انفلاتية الأكسجين الغازي عن طريق الارتباط على شكل مركّبات مع العناصر المكوّنة لتلك الصخور، ممّا أتاح المجال للحديد أن يتبلور. يُعرَف الحديد المتشكّل حينها باسم «الحديد الأرضي» [ملاحظة 24]، وهو نادر الوفرة، إذ توجد فقط بضع مواقع جغرافية حاوية عليه، مثل جزيرة ديسكو [ملاحظة 25] غربي غرينلاند، أو كيان ساخا شمالي شرقي روسيا.[61] لذلك ومن الناحية التصنيفية الجيولوجية وفق الجمعية الدولية للمعادن فإنّ الحديد الأرضي يصنّف ضمن المعادن.[62]
- المعادن الباطنية في الوشاح

يشكّل محلول جامد من معدَني بيريكلاس [ملاحظة 27] (MgO) والفوستيت [ملاحظة 28] ما يدعى باسم «فروبيريكلاس» [ملاحظة 29]، وكذلك أيضاً باسم مغنيسيوفوستيت [ملاحظة 30]،[63] وهو مزيجٌ من أكسيدَي الحديد والمغنسيوم ويشكّل حوالي 20% من حجم وشاح الأرض السفلي، بالتالي فهو ثاني أكثر المعادن وفرةً في تلك الطبقة الباطنية من الأرض بعد بيروفسكيت السيليكات [ملاحظة 31] (سيليكات الحديد والمغنسيوم).[64] تحدث في أسفل المنطقة الانتقالية للوشاح الأرضي تفاعلات تحوّل، من ضمنها تفاعل تحوّل الرينغووديت [ملاحظة 32] (وهو قريب من بنية غاما-أوليفين) إلى مزيج من الفروبيريكلاس وبيروفسكيت السيليكات؛ يشكّل مزيج المعادن الحاوية على سيليكات المغنسيوم والحديد معظم التركيب المعدني للوشاح الأرضي.[65][66]
- القشرة الأرضية
على الرغم من وفرة الحديد في باطن الأرض، إلّا أنّ نسبته في تكوين القشرة الأرضية تبلغ مجرّد حوالي 5% من الكتلة الكلّية لها؛ وهو بالرغم من ذلك يأتي في المرتبة الرابعة، بعد الأكسجين والسيليكون والألومنيوم في ترتيب العناصر في تلك الطبقة.[67] يتّحد معظم الحديد في القشرة الأرضية مع عددٍ من العناصر الأخرى على هيئة معادن، والتي تشكّل خامات الحديد المختلفة. يعدّ الصنف الأكسيدي الحاوي على أشكال مختلفة من أكسيد الحديد من الأصناف المهمّة لتلك المعادن، ومن الأمثلة عليها كلّ من الهيماتيت [ملاحظة 33] (Fe2O3) والمغنيتيت [ملاحظة 34] (Fe3O4) والسيدريت [ملاحظة 35] (FeCO3)، بالإضافة أيضاً إلى الليمونيت [ملاحظة 36] (Fe2O3·n H2O) والغوتيت [ملاحظة 37] (FeO·OH)؛ وهي تمثّل أهمّ خامات الحديد.[68] اقتصادياً يُستخرَج الحديد بشكلٍ أساسيٍّ من معادن الهيماتيت والمغنيتيت والسيدريت.[69]

تحوي العديد من الصخور النارية على معادن كبريتيدية للحديد مثل البيروتيت [ملاحظة 38] والبنتلانديت [ملاحظة 39].[70][71] توجد أيضاً كمّيّات معتبرة من الحديد في معدن البيريت [ملاحظة 40]، ولكن من الصعب استخلاص الحديد منه. أثناء عمليات التجوية يميل الحديد إلى أن يَرْشُحَ من الرسوبيات الكبريتيدية على شكل أملاح كبريتات، ومن الرسوبيات السيليكاتية على شكل بيكربونات؛ ثم يخضع هذان الشكلان إلى تفاعل أكسدة لاحق في المحاليل المائية، ويترسّب الحديد حتّى في أوساط pH مرتفعة على شكل أكسيد الحديد الثلاثي.[72]
توجد هناك رسوبيات جيولوجية كبيرة من الحديد على هيئة تكوينات حِزامية، وهي نوع من أنواع الصخور الحاوية على طبقات رقيقة من أكاسيد الحديد المتناوبة مع طبقات فقيرة بالحديد ومكوّنة من الطَّفْل الصفحي والصخر الصوّاني. يعود تاريخ الحديد المتوضّع في تلك التشكيلات إلى فترة تاريخية تقع بين 3700-1800 مليون سنة خلت؛[73][74] والتي تشكّلت من تفاعل الحديد مع الأكسجين الناتج عن عمليات التركيب الضوئي من البكتيريا الزرقاء.[75] تحوي القشرة الأرضية أيضاً على معادن حاوية على مسحوق ناعم ودقيق من أكسيد أو أكسيد هيدروكسيد الحديد الثلاثي، مثل المُغْرَة [ملاحظة 41] والذي يستخدم بشكل واسع في تركيب الخُضُب منذ القدم.[69] تسهم تلك المعادن أيضاً في منح اللون إلى عددٍ من الصخور والغضار بشكلٍ مميّز مثلما هو الحال في طبقة الحجر الرملي الملوَّن [ملاحظة 42] المنتشرة في وسط وغربي أوروبا.[76]
الاستخراج والمعالجة الأولية
| البلد | خام الحديد | حديد غفل | حديد إسفنجي | فولاذ |
|---|---|---|---|---|
| 1,114.9 | 549.4 | 573.6 | ||
| 393.9 | 4.4 | 5.2 | ||
| 305.0 | 25.1 | 0.011 | 26.5 | |
| 66.9 | 87.5 | |||
| 257.4 | 38.2 | 23.4 | 63.5 | |
| 92.1 | 43.9 | 4.7 | 60.0 | |
| 65.8 | 25.7 | 29.9 | ||
| 0.1 | 27.3 | 48.6 | ||
| 0.4 | 20.1 | 0.38 | 32.7 | |
| العالم | 1,594.9 | 914.0 | 64.5 | 1,232.4 |
تعدّ الصين الدولة الرائدة في العالم في إنتاج الحديد الخام، حيث تُنتِج منذ بداية القرن الحادي والعشرين أكثر من 60% من الإنتاج العالمي من هذه الخامة. من الدول الرائدة أيضاً في إنتاج الحديد الخام كلُّ من اليابان والهند وروسيا وأستراليا والبرازيل وكوريا الجنوبية.[78] هناك ازديادٌ مستمرٌّ في الطلب العالمي على الحديد؛ ووفقاً لتقريرٍ دوليٍّ من الهيئة الدولية للموارد الطبيعية [ملاحظة 43] فإنّ الاستهلاك العالمي من الحديد في المجتمع هو 2.2 طنّ لكلّ نسمة؛ وهو يرتفع في الدول المتقدّمة ليصل إلى مجال بين 7-14 طنّ لكلّ نسمة.[79]
يُستخرَج خام الحديد بشكلٍ رئيسيٍّ وفق أساليب التعدين السطحي، كما هو الحال في منجم إل موتون [ملاحظة 44] في بوليفيا؛ بالمقابل، فمن النادر تعدين الحديد من باطن الأرض، مثلما هو الحال في منجم كيرونا [ملاحظة 45] في السويد. لأسبابٍ تقنيةٍ واقتصاديةٍ، فإنّه من المفضّل لخامات الحديد التي ستوضع في الفرن اللافح أن تكون ذا مواصفاتٍ فيزيائية وكيميائية متجانسة. قبل الإدخال إلى الفرن اللافح تخضع الخامات إلى عمليات تحضير من معالجات صناعيّة متعاقبة، تتضمّن التكسير ثم الطحن إلى كُرَيّات صغيرة ثمّ الغربلة. يشكّل مسحوق خام الحديد الدقيق الناتج من المعالجات على هيئة قطع صغيرة، وإلّا فإنّه سيتسبّب بمشاكل تقنية نتيجة إعاقته تشكيل تيارات هوائية لافحة في الفرن.[80] تتضمّن الطرائق المستخدمة في تشكيل القطع الصغيرة من المسحوق عمليّتا التلبيد [ملاحظة 46] والتحبيب [ملاحظة 47]، ويعتمد اختيار الطريقة على حجم الحُبَيبات؛ إذ تتطلّب عملية التلبيد أن يكون قطر الحُبَيبات أكبر من 2 ميليمتر، أمّا الحُبَيبات الأصغر فإنّها تخضع في العادة إلى عملية تحبيب.[81] يستخدم في عملية التحبيب مواد رابطة ضمن إضافات أخرى، والتي تُخلَط على هيئة مزيج ثم تقولَب على هيئة حُبَيبات تتراوح أقطارها بين 8 إلى 18 ميليمتر.[82] تُدخَل القطع الصغيرة من خامات الحديد على دفعات بكمّيّات صغيرة إلى الفرن.[81]
|
ازدياد الطلب العالمي على خام الحديد (مقدّراً بملايين الأطنان)  |
ازدياد الإنتاج العالمي من الحديد الخام (مقدّراً بملايين الأطنان) 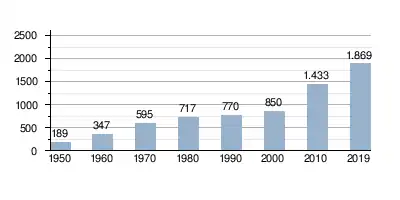 |
الإنتاج

في العصر الراهن يتطلّب إنتاج الحديد أو الفولاذ (الصلب) صناعياً عمليةً من مرحلتين؛ في المرحلة الأولى يُختزَل خام الحديد باستخدام فحم الكوك في فرن لافح؛ ثم يُفصَل الحديد المصهور عن الشوائب الكبرى الموجودة في المزيج مثل معادن السيليكات. تعطي هذه المرحلة سبيكةً من الحديد غنيّةً نسبياً بالكربون، وهي تسمّى «حديد غُفْل» [ملاحظة 50]. في المرحلة الثانية يُخفّض محتوى الكربون في الحديد الغُفْل ليعطي منتجاتٍ أخرى مثل «الحديد المطاوع» أو «الحديدالزهر» (أو حديد الصبّ) أو «الفولاذ» (أو الصُلْب).[85] يمكن إضافة فلزات أخرى في هذه المرحلة من أجل الحصول على سبائك فولاذ مختلفة.[86]
المعالجة بالفرن اللافح
الفرن اللافح [ملاحظة 51] هو نوعٌ من الأفران الصناعية لصهر الفلزّات عموماً والحديد خصوصاً. تُمزَج خامات الحديد الأكسيدية من الهيماتيت (Fe2O3) أو المغنيتيت (Fe3O4) مع فحم الكوك؛ ثم تُدخَل الشحنة إلى الفرن اللافح من الأعلى.[86]
تتعرّض الشحنة أثناء هبوطها إلى تيّارات ساخنة من غاز صناعي مكوّن من مزيج من أحادي أكسيد الكربون والنتروجين، ممّا يؤدّي إلى تسخينها إلى درجات حرارة تتراوح بين 1600 إلى 2200 °س. يُخصَّص ذلك الغاز الصناعي في مجال التعدين باسم «غاز الفرن اللافح» [ملاحظة 52]؛ وهو ينشأ من نفث تيّارات من الهواء المُسخّن مسبقاً أسفل الفرن إلى درجة حرارة مقدارها 900 °س إلى المزيج، وذلك بكمّيّات كافية لتلفح الكربون وتحوّله إلى أحادي أكسيد الكربون:[85]

في مجال من درجات الحرارة بين 500-900 °س يحدث ما يدعى باسم «الاختزال غير المباشر»؛ وهو تفاعل اختزال بين أكاسيد الحديد المختلفة وأحادي أكسيد الكربون، وهو يسير وفق ثلاث مراحل إلى الوصول إلى عنصر الحديد الفلزّي:[86]
أمّا في مجال من درجات الحرارة يقع بين 900-1600 °س فيحدث ما يدعى باسم «الاختزال المباشر»، إذ يختزل فحم الكوك أكاسيد الحديد مياشرةً إلى الحديد:[86]
كما يستطيع فحم الكوك أن يختزل خام الحديد الموجود على تماسٍ معه في المناطق السفلية من الفرن اللافح مباشرةً إلى الحديد الفلزّي:[85]

تضاف صهارة من الحجر الجيري (كربونات الكالسيوم) أو الدولوميت (كربونات المغنيسيوم والكالسيوم) إلى الوسط، وهو عامل يساعد على التنقية والتنظيف ويساهم في التسهيل من الجريان)، ويساهم في إزالة المعادن السيليكاتية من الخامة، وإلّا فإنّها قد تتسبّب في انسداد فتحات الفرن. يساعد ارتفاع درجة حرارة الفرن على التفكّك الحراري للكربونات إلى أكسيد الكالسيوم، والذي يتفاعل بدوره مع السيليكا الفائضة ليشكّل ما يعرف باسم «الخَبَث» [ملاحظة 53]، والذي يتألّف بشكلٍ كبيرٍ من سيليكات الكالسيوم، بالإضافة إلى مكوّنات أخرى.[87] تكون درجات الحرارة السائدة في الفرن مرتفعة، بحيث يكون كلٌ من الحديد والخبث في حالة منصهرة، واللذان يُجمعان أسفل الفرن، ولكنّهما يكونان غير ممتزجَين، إذ أنّ كثافة مصهور الخَبَث أقلّ من كثافة مصهور الحديد، لذا تبقى طبقة الخبث على السطح، ممّا يسهّل من فصلها فيما بعد.[85] تُروى طبقة الخبث بالماء، ممّا يؤدّي إلى تَزَجُّجِهَا على شكل حُبَيبات دقيقة مثل الرمل. يمكن أن يُستخدَم الخَبَث المُستَحصل في إنشاء الطرقات، كما يضاف إلى الخرسانة؛ بالإضافة إلى استخدامه في مجال الزراعة من أجل تحسين خواص التربة الفقيرة بالمعادن.[41]
يدعى الحديد الخام الناتج عن هذه المرحلة باسم «الحديد الغُفْل»؛ وهو يحوي وسطياً على 95% حديد، مع وجود كمَيَة مرتفعة نسبياً من الكربون تتراوح بين 4–5% وزناً، بالإضافة إلى وجود شوائب من عناصر مختلفة مثل الكبريت (0.01-0.05%) والمنغنيز (0.5-6%) والسيليكون (0.5-3%) والفوسفور (إلى 2%).[86]
صناعة الفولاذ
غالباً ما يُستخدَم الحديد الخام (الحديد الغُفْل) الناتج من الفرن اللافح في إنتاج الفولاذ في مصانع الحديد. عند إزالة الشوائب من الحديد الغُفْل والإبقاء على محتوى كربوني يتراوح بين 2–4% يُستحصَل على ما يسمّى «الحديد الزهر» (أو «الحديد الصبّ») [ملاحظة 54]؛ كما يمكن أن يُستحصَل على الحديد الزهر المرن؛[88] وتُصَبّ تلك الأنواع في المسابك [ملاحظة 55] إلى منتجاتٍ حديديةٍ مختلفةٍ.[85]
يؤدّي ارتفاع محتوى الكربون إلى خواص غير محمودة للحديد مثل الهشاشة والتقصّف، لذلك يُعمَد إلى تخفيض محتوى الكربون في الحديد إلى حدٍّ أعظميٍّ مقداره 2%، وبالتالي يُستحصَل على سبيكة الفولاذ (والتي تدعى سبيكة «الصُلْب» في بعض الدول العربية مثل جمهورية مصر العربية). في حين أنّ تخفيض محتوى الكربون دون 0.5% يؤدّي إلى الحصول على ما يعرف باسم «الحديد المطاوع».[89] يمكن أن يُستخدَم الفولاذ الناتج عن العملية في صناعة المشغولات الحديدية المعدنية المختلفة عبر خضوعه إلى طيفٍ واسعٍ من المعالجات الهندسية، مثل التشكيل على البارد [ملاحظة 56] أو الدَرْفَلة والتصفيح على الساخن [ملاحظة 57] أو التطريق [ملاحظة 58] أو التشغيل الآلي والمَكْنَنَة [ملاحظة 59] وغيرها. تخضع منتجات الفولاذ إلى معالجات حرارية مختلفة بعد تطريقها إلى الأشكال المرغوبة. يساهم التلدين (أو التخمير) [ملاحظة 60]، وهو عملية تسخين الفولاذ إلى درجات حرارة بين 700–800 °س ثم بالتبريد البطيء التدريجي، في جعل الفولاذ أكثر ليونة وأكثر قابلية للتشغيل.[90]
اختزال الحديد المباشر
يمكن إجراء عملية الاختزال المباشر لخامات الحديد من أجل الحصول على الحديد، والذي يدعى حينها باسم «الحديد الإسفنجي» [ملاحظة 61].[41] يسود وفق هذه العملية تفاعلان كيميائيان، يتضمّن الأوّل الأكسدة الجزئية الغاز الطبيعي عند درجات حرارة مرتفعة وبوجود حفّاز:[41]
ثم يعالج خام الحديد بالغازات الناتجة عن التفاعل الأول داخل الفرن، ممّا يؤدّي إلى الحصول على كتلة إسفنجية من الحديد الصلب.[41]
ووفق هذا الأسلوب تزال السيليكا من الوسط باستخدام صهارة من الحجر الجيري.[41]
عمليات أخرى

يمكن اختزال خام الحديد وفق تفاعل الثرميت بمزج مسحوق أكسيد الحديد مع مسحوق من فلز الألومنيوم، كما هو موضّح بالتفاعل الكيميائي التالي:
لا يمكن تطبيق هذه الطريقة من أجل استحصال الحديد من خاماته الأكسيدية، إذ لا يعدّ هذا الأسلوب اقتصادياً، لأنّ كمّيّة الألومنيوم اللازمة لإجراء هذا التفاعل ستكون كبيرة. ولكن يستخدم هذا التفاعل على نطاق صغير نسبياً من أجل لحام خطوط السكك الحديدية.
توجد هناك عمليّات تقليدية عديدة ومختلفة للحصول على الحديد والفولاذ، مثل ورشات حدادة الحديد الممتاز أو أفران التسويط أو أفران بسمر أو أفران المجمّرة المكشوفة [ملاحظة 62] أو وفق عملية توماس [ملاحظة 63]. كما توجد أيضاً عمليات حديثة بديلة عن الفرن اللافح مثل إنتاج الحديد ضمن الأفران الأكسجينية القاعدية [ملاحظة 64] أو أفران القوس الكهربائي.[85] يُستحصَل على الحديد أيضاً في الأفران القائمة [ملاحظة 65] وفق عملية كوريكس [ملاحظة 66] على سبيل المثال، والمطوّرة من شركة سيمنز.[91]
يمكن الحصول على الحديد النقي مخبرياً بكمّيّات صغيرة من اختزال الأكسيد أو الهيدروكسيد النقيّ باستخدام الهيدروجين؛ أو بتشكيل خماسي كربونيل الحديد ثم تسخينه إلى درجة حرارة مقدارها 250 °س ليتفكّك إلى مسحوق حديد نقيّ.[72] يمكن بأسلوب آخر الحصول على مسحوق الحديد النقي من إجراء تحليل كهربائي لمحلول كلوريد الحديد الثنائي.[92]
النظائر
للحديد أربع نظائر مستقرّة: حديد-54 54Fe (بوفرةٍ طبيعية 5.845%)؛ وحديد-56 56Fe (بوفرة طبيعية 91.754%)؛ وحديد-57 57Fe (بوفرةٍ طبيعية 2.119%)؛ وحديد-58 58Fe (بوفرةٍ طبيعية 0.282%). بالإضافة إلى وجود أربع وعشرون نظيراً مشعّاً للحديد مع وجود ستّة مُصَاوغات نووية، وجميعها لها أعمار نصف تقع بين 150 نانوثانية و8.275 ساعة.[93] يعدّ النظير حديد-54 من النظائر المستقرّة للحديد، وعلى الرغم من ذلك، فقد لوحظ له اضمحلال إشعاعي على هيئة اضمحلال بيتّا المضاعف، ولكن بعمر نصف طويل، وهو 3.1×1022 سنة، حيث يضمحلّ إلى نظير الكروم 54Cr.[94] يوجد هنالك نظيرٌ شبه مستقرٍّ للحديد وهو النظير حديد-60 60Fe، والذي يبلغ عمر النصف له حوالي 2.6×106 سنة.[95] لكنّه نادر الوجود في الكون، وهو نظير منقرض في الأرض؛ ولكن ناتج اضمحلاله الإشعاعي متوفّر في الأرض على هيئة نظير النيكل 60Ni.[94]
ركّزت الأبحاث الأوّلية المهتمّة بالتركيب النظائري للحديد على التخليق النووي للحديد-60 60Fe من خلال دراسة الأحجار النيزكية وتشكّل الخامات الأرضية.[96] ولكن التطوّر في مجال مطيافية الكتلة سمح في التحليل النوعي والكمّي الدقيق للتفاوت الطفيف في نسب النظائر المستقرّة للحديد.[97] تُستخدَم النسبة بين النظيرَين حديد-60 60Fe وناتج اضمحلاله نيكل-60 sup>60Ni في دراسة تشكّل وتطوّر المجموعة الشمسية. هناك اقتراحات تفترض أنّ الطاقة المتحرّرة عن اضمحلال النظيرَين حديد-60 60Fe وألومنيوم-26 26Al كانت قد ساهمت في إعادة صهر وتباين الكويكبات بعد تشكّلها قبل حوالي 4.6 بليون سنة.[98] في جانبٍ آخر، يهتمّ الباحثون أيضاً بدراسة أكثر نظائر الحديد وفرةً، وهو النظير حديد-56 56Fe، لأنّه يمثّل أكثر نواتج التخليق النووي شيوعاً.[99] يُنتَج النظير نيكل-56 56Ni بسهولةٍ من النوى الأخفّ بتفاعلات نووية وفق عملية ألفا؛ مثلما يحدث في عملية احتراق السيليكون ضمن المستعرات العظمى من النوع 2 [ملاحظة 67]. تتطلّب عملية إضافة جسيم ألفا إضافي إلى نواة النيكل-60 كي يتحوّل إلى نظير الزنك 60Zn طاقةً كبيرةً جدّاً، لذلك تقف تفاعلات عملية ألفا عند هذا النظير، والذي له عمر نصف يبلغ ستة أيام، لكنه سرعان ما يخضع ضمن بقايا المستعر الأعظم إلى تفاعلات انبعاث بوزيتروني، ليتحوّل أوّلاً إلى نظير الكوبالت المشعّ 56Co، ومنه إلى نظير الحديد المستقرّ 56Fe. لذلك فإنّ الحديد هو العنصر الأكثر شيوعاً داخل نواة النجوم الحمراء العملاقة، وفي تركيب النيازك الحديدية والكواكب مثل الأرض.[100] على الرغم من أنّه نظرباً قد يُستحصَل على جانب أكبر من الطاقة في حال تشكيل نظير النيكل 62Ni داخل النجوم، إلّا أنّ الظروف داخل تلك النجوم المستعرة تفضّل تشكيل الحديد على النيكل؛[101] كما يتطلّب تشكيل العناصر الأثقل من الحديد عمليات التقاط النيوترون سريعة؛[100] لذلك فإنّ الحديد يصنّف ضمن أكثر العناصر الكيميائية وفرةً في الكون.[102][103]
الخواص الفيزيائية

يوجد الحديد في الشروط القياسية من الضغط ودرجة الحرارة على هيئة فلزّ ذي لون رمادي فضّي؛ وهو في الحالة النقيّة فلز ليّن نسبياً وقابل للسحب والطرق. تبلغ كثافة الحديد 7.873 غ/سم3؛ وينصهر عند 1538 °س، ويغلي عند 3070 °س.[86] تعدّ نقطتا انصهار وغليان الحديد، بالإضافة إلى حرارة التَذْرير [ملاحظة 68]، ذات قيم أخفض من قيم أغلب عناصر الفلزّات الانتقالية الموجودة على يسار الحديد في الجدول الدوري ما عدا المنغنيز، وذلك من السكانديوم إلى الكروم؛ وذلك يعكس مساهمة أقلّ للإلكترونات في المستوى الفرعي 3d في تكوين الرابطة الفلزّية.[104]
تبدي نواة ذرّة نظير الحديد 56Fe مقداراً كبيراً نسبياً من نقص الكتلة، وبالتالي تكون قيمة طاقة الارتباط لكل نُوَيّة مرتفعة، ممّا يعكس الاستقرار النسبي له؛ ولذلك يمثّل هذا النظير نهاية سلسلة توليد الطاقة في النجوم أثناء التخليق النووي. يعدّ مقدار نقص الكتلة بالنسبة للنظير حديد-56 56Fe الثالث من حيث الترتيب بالنسبة لنظائر العناصر الكيميائية، وذلك بعد نظير النيكل 62Ni ونظير الحديد الآخر 58Fe.[94][105]
يعطي الحديد خطوط طيفية في مختلف مجالات قياس الضوء الطيفي؛[106] وللكشف عن تلك الخطوط أهميّة كبيرة في مجال علم فلك الأشعّة السينية، إذ أنّ الخطوط الطيفية القويّة للحديد تعطي دلائل كونية مثل وجود نواة مِِجَرّية نشطة أو ثنائي الأشعّة السينية أو مستعر أعظم أو ثقب أسود.[107]
التآصل في الحديد
.png.webp)
يظهر الحديد خاصّة التآصل، وهي ظاهرة تتمثّل بتشابه التركيب الكيميائي مع اختلاف الشكل البلّوري، نتيجةً لاختلاف توزيع الذرّات في البنية البلّورية. يوجد الحديد عند الضغوط العادية إلى المتوسّطة في ثلاثة أطوار تآصلية، وهي مُرَمّزة بالأحرف الإغريقية ألفا (α-Fe)، وغامّا (γ-Fe)، ودلتا (δ-Fe). عندما يتبرّد مصهور الحديد دون نقطة تجمّده (1538 °س) فإنّه يتبلور إلى المتآصل دلتا (δ-Fe)، والذي يمتلك بنية بلّورية ذات نمط مكعّب مركزي الجسم [ملاحظة 69]؛ وعندما يترك ليبرد لدرجات حرارة دون 1394 °س فإنه يغيّر من شكله البلّوري إلى المتآصل غامّا (γ-Fe)، والذي يمتلك بنية بلّورية ذات نمط مكعّب مركزي الوجه [ملاحظة 70] (تبلغ قيمة ثابت الشبكة البلّورية مقدار 364.7 بيكومتر)؛ ويعرف ذلك الطور أيضاً بالاسم «أوستنيت». [ملاحظة 71] عند درجات حرارة دون 910 °س تعود البنية البلّورية للحديد لتأخذ الشكل البلّوري المكعّب مركزي الجسم (تبلغ قيمة ثابت الشبكة البلّورية مقدار 286.6 بيكومتر)، ويُرمز للحديد حينها بالمتآصل ألفا (α-Fe)، ويُعرف ذلك الطور أيضاً بالاسم «فيريت».[ملاحظة 72].[108][109] يكون الحديد من النمط ألفا (α) طريّاً نسبياً، وهو قادر على إذابة كمّيّة صغيرة من الكربون فيه، بنسبة عظمى تصل إلى 0.021% وزناً عند درجة حرارة مقدارها 910 °س.[110] أمّا الأوستنيت (النمط غامّا (γ)) فهو طري أيضاً بشكلٍ مشابه، ولكنّه قادر على إذابة كمّيّة أكبر من الكربون تصل إلى 2.04% وزناً عند درجة حرارة مقدارها 1146 °س. يُستخدَم هذا النمط من الحديد في إنتاج الفولاذ المقاوم للصدأ المستخدم في صناعة الأواني وتجهيزات المطاعم والمشافي.[111]
تتغيّر الخواص الفيزيائية للحديد عند قيم مرتفعة جدّاً من الضغط ودرجة الحرارة،[112][113] وذلك بشكلٍ مُحَاكٍ للظروف في جوف الأرض.[114] عندها تتغيّر البنية البلّورية من المتآصل ألفا (α-Fe) إلى بنية ذات تعبئة متراصّة، يُرمَز لها بالحرف إبسلون (ε-Fe).[115] توجد بعض النظريات التي تشير إلى وجود طور مستقرّ يُرمَز له بيتّا (β)، والذي يسود عند ضغوط مرتفعة تفوق 50 غيغاباسكال وعند درجات حرارة تتجاوز 1500 كلفن، وتأخذ فيها البنية شكل نظام بلوري معيني قائم؛[116] إلا أن تلك النظريات خلافية، ولا يوجد إجماع علمي عليها، خاصّةً أنّ الرمز β يُستخدَم في بعض الأحيان للإشارة إلى تغيّر الخواص المغناطيسية للحديد فوق درجة حرارة كوري.[108]
الخواص المغناطيسية

في مجالٍ من درجات الحرارة دون درجة حرارة كوري [ملاحظة 73]، والتي تبلغ 770 °س، تتغيّر خواص الحديد ألفا (α-Fe) المغناطيسية من مغناطيسية مسايرة [ملاحظة 74] إلى مغناطيسية حديدية [ملاحظة 75]، وذلك يعود إلى تغيّر اللفّ المغزلي [ملاحظة 76] للإلكترونَين غير المتزَاوِجَين في كلّ ذرّة واصطفافه بشكلٍ مماثلٍ للفِّ المغزلي للجوار، ممّا يؤدّي إلى تشكّل حقل مغناطيسي سطحي.[118] وفي غياب حقل مغناطيسي خارجي يكون التوجّه في حيّزٍ مغناطيسي [ملاحظة 77] ذي سماكة مقدارها 10 ميكرومتر.[111] ما يدعم حدوث هذه الظاهرة أنّ هَذَين الإلكترونَين (dz2 و dx2 − y2) لا يتّجهان نحو باقي الذرّات المجاورة في الشبكة البلّورية، وبذلك فإنّهما غير مُنْخَرطان في تشكيل الرابطة الفلزّية.[108] إلّا أنّ تأثير ذلك الحقل المغناطيسي الداخلي يكون مقصوراً على الطبقة السطحية، إذ أنّ تنوّع التوجّهات يجعل المحصّلة الإجمالية للحقل المغناطيسي لقطعة الحديد بالكامل معدومةً. يؤدّي تطبيق حقلٍ مغناطيسيٍّ خارجيٍّ إلى التأثير على الحيّز المغناطيسي السطحي، ويوجّهه في نفس اتجاه الحقل المغناطيسي الخارجي، ممّا يؤدّي إلى تعزيزه على حساب الذرّات ذات التوجّه المختلف. تُستَغل هذه الظاهرة في الأجهزة التي تتطلّب نقل الحقل المغناطيسي من مؤثّرٍ خارجيٍّ، مثل المحوّلات الكهربائية وأجهزة التخزين المغناطيسي والمحرّكات الكهربائية. يؤدّي وجود شوائب أو عيوب بلّورية أو حدود حُبَيبيّة داخل البنية إلى التأثير على توجّه الذرّات داخل الحيّز المغناطيسي، ويجعله ثابتاً، ممّا يؤدّي إلى استمرار التوجّه المنتظم حتّى بعد زوال الحقل المغناطيسي الخارجي، وذلك بالتالي يمكّن من الحصول على مغناطيس دائم.[118]
يوجد سلوك مغناطيسي مشابه لبعض مركّبات الحديد ومعادنه، مثلما هو الحال في معادن الفرّيت، ومن ضمنها معدن المغنيتيت. كانت قطع من المغنيتيت مستخدمةً على هيئة حجر المغناطيس في تركيب الأشكال الأوّلية من البوصلة في مجال الملاحة البحرية؛ ثم استخدمت على نطاقٍ واسعٍ في وسائط تخزين البيانات المعتمدة على المغْنطة، مثل ذواكر الحاسوب والأشرطة المغناطيسية والأقراص المرنة والصلبة، وذلك قبل أن تحلّ محلّها مواد مصنّعة من الكوبالت.[119]
الخواص الهندسية
تُفيّّم الخواص الهندسية للحديد وسبائكه باستخدام مجموعةٍ متنوّعةٍ من الاختبارات، مثل اختبار برينل واختبار روكويل وكلاهما لقياس صلادة الحديد، واختبار قوة الشد وغيرها؛ نتائج هذه الاختبارات على الحديد دقيقةٌ للغاية، بما يسمح باستخدام الحديد لمعايرة أو الربط بين نتائج الاختبارات المختلفة.[120] تعتمد نتائج تلك الاختبارات على درجة نقاء الحديد: فبلّورات الحديد في صورته النقية أكثر ليونةً من الألومنيوم، ومع إضافة بعض أجزاء من المليون من وزن سبيكة الحديد من عنصر الكربون، فإنّها تضاعف من قوّة الحديد.[121] تزداد الصلادة ومقاومة الشد [ملاحظة 78] عند زيادة محتوى الكربون في سبيكة الحديد حتّى تصل نسبته إلى 0.2% من وزن السبيكة، وبعد ذلك يتزايد بمعدّلات أقلّ، ويصل إلى الذروة عندما يصل محتوى الكربون إلى 0.6% تقريبا من وزن السبيكة.[122] الحديد النقي المنتَج صناعياً (حوالي 99.99%) لديه صلادة تقدّر بـ 20-30 وفق اختبار برينل للصلادة.[123]
السبائك
هناك عدّة أشكال لسبائك الحديد الكربونية، أشهرها:

- الحديد الغُفْل؛ وهو يحوي على نسبةٍ من الكربون تتراوح بين 4-5%، مع وجود شوائبٍ من عناصر مثل الكبريت والفوسفور والسيليكون. وهو ناتج وسطي أثناء إنتاج الحديد الزهر (حديد الصبّ) والفولاذ.[86] لسبيكة حديد الغُفْل نقطة انصهار تقع في المجال بين 1420–1470 كلفن، وهي بذلك أخفض من المكوّنَين الرئيسيَّين لها، ممّا يجعلها المنتَج الأوّل القابل للصهر عند تسخين الحديد والكربون (الفحم) مع بعضهما.[108]
- حديد الزّهْر (أو حديد الصبّ)؛ ويحوي على نسبةٍ من الكربون تتجاوز 2.06%، مع وجود عناصر أخرى في السبيكة، مثل السيليكون والمنغنيز، والتي يؤدّي وجودها إلى تحسين قابلية السبك [ملاحظة 79]. إنّ حديد الزهر صلدٌ جدّاً وقابل للتقصّف؛ وهو ليس سهل التطريق، ولكنه سهل السبك والصبّ.[124] يحوي «الحديد الزهر الأبيض» [ملاحظة 80] على الكربون في هيئة «السمنتيت» [ملاحظة 81]، وهو كربيد الحديد Fe3C.[125] وهو مركّبٌ صلدٌ وهشٌّ في ذات الوقت، وهو يهيمن على الخواص الهندسية لهذه السبيكة. بالمقابل، يؤدّي التبريد البطيء لمزيجٍ من الحديد مع 0.8% كربون من درجات حرارة دون 723 °س إلى درجة حرارة الغرفة إلى الحصول على طبقاتٍ منفصلةٍ ومتناوبةٍ من السيمنتيت والحديد ألفا، وهو نمطٌ طريٌّ ومطواع، ويدعى «البرليت» [ملاحظة 82]. من جهةٍ أخرى، لا يتيح التبريد السريع المجال لحدوث ذلك النمط من الانفصال في الطبقات، بل يشكّل نمطاً يدعى باسم «مارتنسيت» [ملاحظة 83]، وهو نمطٌ صلبٌ وهشٌّ. يمكن معالجة الأنماط المذكورة بإعادة صهرها، وتغيير النسب بين البرليت والمارتنسيت من أجل الحصول على مزائج وفق الطلب.[125] أمّا «الحديد الزهر الرمادي» [ملاحظة 84] فيوجد فيه الكربون على هيئة ألواح دقيقة ومنفصلة من الغرافيت، ممّا يجعل هذه المادة هشّةً أيضاً، وذلك لأن الأطراف الصلبة والحادّة للغرافيت المسبّبة لوجود مواقع مرتفعة تركيز الإجهاد [ملاحظة 85] داخل بنية المادّة.[126] يمكن تحوير الحديد الزهر الرمادي إلى نمطٍ مستحدَثٍ يدعى «الحديد الزهر المرن» [ملاحظة 86]، والذي يعالَج بكمّيّات نزرة من المغنيسيوم من أجل تغيير شكل الغرافيت إلى عُقَيدات، ممّا يقلّل بذلك من تركيز الإجهاد، ويزيد بشكلٍ كبيرٍ من شدّة ومتانة السبيكة.[126]
- الحديد المطاوع؛ ويحوي على نسبةٍ ضئيلةٍ من الكربون أقلّ من 0.25%، ولكنّه بالمقابل يحوي على كمّيّةٍ كبيرةٍ من الخَبَث، الأمر الذي يمنحه بنيةً ليفيةً مميّزةً.[127] سبيكة الحديد المطاوع متينة وقابلة للسحب والطرق؛ وهو أكثر مقاومة للتآكل من الفولاذ العادي؛ ولكن بالرغم من ذلك فقد حلّ الفولاذ الكربوني [ملاحظة 87] مكان الحديد المطاوع في استخداماته النمطية؛ وهو يحوي على نسبةٍ من الكربون أقلّ من 2.0%؛ مع وجود نسبةٍ صغيرةٍ من الشوائب مثل المنغنيز والكبريت والفوسفور والسيليكون.[128]
- الفولاذ (أو الصُلْب)؛ وهو يحوي على نسبةٍ عظمى من الكربون تصل إلى 2.06%؛ وهو قابل بسهولة للتطريق على العكس من حديد الزهر. يعدّ الفولاذ أكثر سبائك الحديد تميّزاً من ناحية الخواص، وخاصّةً عند إجراء المعالجات الملائمة، الحرارية منها مثل التقسية [ملاحظة 88]، أو الآلية مثل الدَرْفلة [ملاحظة 89].[86] يحوي الفولاذ السبائكي [ملاحظة 90] على كمّيّات متفاوتةٍ من الكربون وكذلك من فلزّات أخرى مثل الكروم والفاناديوم والموليبدنوم والنيكل وغيرها. على الرغم من شيوع استخدام سبيكة الفولاذ المقاوم للصدأ، إلّا أنّ أغلب أنواع الفولاذ السبائكي الأخرى هي مرتفعة الكلفة، وغالباً ما تُستخدَم من أجل تطبيقات مخصّصة، مثلما هو الحال في سبائك «فولاذ HSLA» مرتفعة المتانة ومنخفضة محتوى العناصر في السبيكة.[ملاحظة 91].[129]
الخواص الكيميائية
| حالة الأكسدة | مثال على مركّب نمطي لحالة الأكسدة المذكورة |
|---|---|
| −2 (d10) | حديدات رباعي كربونيل ثنائي الصوديوم (كاشف كولمان) Na2[Fe(CO)4] |
| −1 (d9) | أنيون ثماني كربونيل ثنائي الحديد 2−[Fe2(CO)8] |
| 0 (d8) | خماسي كربونيل الحديد Fe(CO)5 |
| 1 (d7) | مضاعف ثنائي كربونيل حلقي بنتاديينيل الحديد 2[C5H5Fe(CO)2] |
| 2 (d6) | كبريتات الحديد الثنائي FeSO4؛ فروسين Fe(C5H5)2 |
| 3 (d5) | كلوريد الحديد الثلاثي FeCl3؛ أكسيد الحديد الثلاثي Fe2O3 |
| 4 (d4) | أوكسي رباعي فلوروبورات الحديد الرباعي FeO(BF4)2 |
| 5 (d3) | أنيون أكسيد الحديد الخماسي 3−FeO4 |
| 6 (d2) | حديدات البوتاسيوم K2FeO4 |
يبدي الحديد الخواص الكيميائية النمطية للفلزّات الانتقالية، مثل القدرة على الوجود بعدّة حالات أكسدة تختلف فيما بينها بمقدار درجة واحدة، بالإضافة إلى القدرة على تشكيل معقّدات تناسقية؛ ويتمثّل ذلك باكتشاف مركّب الفروسين، والذي أدّى إلى حصول ثورة في مجال الكيمياء العضوية الفلزّية منذ خمسينيات القرن العشرين.[130]
الحديد ذو تفاعلية كيميائية جيّدة، وهو الأنشط في مجموعته؛ وهو تلقائي الاشتعال عندما يكون على هيئة مسحوقٍ دقيقٍ جدّاً؛ كما يذوب بسهولة في الأحماض الممدّدة ليعطي أيونات الحديدوز 2+Fe وانطلاق غاز الهيدروجين:[86]
ولكنه لا يتفاعل مع حمض النتريك المركّز، وباقي الأحماض المؤكسدة، نتيجة لتشكل طبقة أكسيد حامية، ولكنّها بدورها تتفاعل مع حمض الهيدروكلوريك.[108] يتأكسد الحديد في الهواء الرطب وفي الماء بسهولة، ويشكّل طبقةً من أكسيد هيدروكسيد الحديد الثلاثي المُمَيَّهَة، والتي تعرف بالاسم الشائع «صدأ». إنّ طبقة الصَدَأ مسامية وطريّة، لذلك فإنّها قابلة للانتشار لتغطّي كافّة جسم الحديد المتأكسد؛ وخاصّةً في ماء البحر أو المياه الحاوية على ثنائي أكسيد الكبريت. عند تسخين الحديد في الهواء الجافّ تتشكّل طبقةٌ من أكسيد الحديد الثنائي والثلاثي Fe3O4. على العكس من باقي أغلب الفلزّات لا يستطيع الحديد أن يشكّل ملغمة مع الزئبق؛ ولذلك فإنّه من الشائع استخدام حاويات من الحديد لتخزين الزئبق.[131]
كيمياء المحاليل

يختلف جهد اختزال أيونات الحديد في المحاليل حسب حالة الأكسدة. فيما يلي قيم جهد الاختزال لأيونات الحديد الشائعة في الوسط الحمضي:[108]
| Fe2+ + 2 e− | E0 = −0.447 V | |
| Fe3+ + 3 e− | E0 = −0.037 V | |
| FeO42- + 8 H+ + 3 e− | E0 = +2.20 V |
يعدّ أنيون الحديدات (أو الفِرّات) مثالاً على وجود الحديد بحالة الأكسدة +6، ويوجد هذا الأنيون في المحلول بلون أحمر قرمزي، وهو ذو بنية رباعية السطوح، وينتمي إلى المؤكسدات القويّة، إذ يستطيع أن يؤكسد النتروجين والأمونيا عند درجة حرارة الغرفة، وحتى كذلك الماء في الأوساط المعتدلة أو الحمضية.[132]
عادةً ما يكون أيون الحديد الثلاثي 3+Fe في المحاليل على هيئة سداسي هيدرات 3+[Fe(H2O)6]، ويتغيّر موقع الرُبَيطات في كرة التناسق مع تغيّر pH الوسط مع تحرّر أيونات الهيدرونيوم، وذلك من الأيون 3+[Fe(H2O)6] إلى الأيون 2+[Fe(H2O)5(OH)]؛ ثم إلى الأيون +[Fe(H2O)4(OH)2]؛ كما يتشكّل الأيون 2+4[Fe(H2O)4(OH)] أيضاً في تفاعلات التوازن الكيميائي تلك.[133]
بالمقابل، لا يدخل أيون الحديد الثنائي سداسي الهيدرات 2+[Fe(H2O)6] ذو اللون الأخضر الشاحب في تفاعلاتٍ مماثلة، بالتالي لا يكون الوسط في أيونات الحديد الثنائي حمضياً، إذ عند إضافة أنيون الكربونات لا يتحرّر ثنائي أكسيد الكربون، ولكن تحدث عملية ترسيب لمركّب كربونات الحديد الثنائي FeCO3. بوجود زيادةٍ من ثنائي أكسيد الكربون يمكن لمركّب البيكربونات أن يتشكل، وتحدث هذه الظاهرة بشكلٍ شائعٍ في المياه الجوفية، ولكن سرعان ما يتأكسد الحديد الثنائي إلى الثلاثي ويترسّب أكسيد الحديد Fe2O3 من الوسط.[134]
المركبات الكيميائية
_oxide.jpg.webp)
-oxide-sample.jpg.webp)

تحوي ذرّة الحديد على 24 إلكتروناً، والتي تترتّب وفق التوزيع الإلكتروني Ar;3d64s2، وتكون طاقة الإلكترونات 3d و 4s متقاربة، ممّا يمكّن من حدوث تأيّن عددٍ مختلفٍ من الإلكترونات.[125] بالرغم من ذلك، فللحديد حالتا أكسدة مفضّلتان عن غيرهما، وهما +2 و+3؛ وهما السائدتان في مركّباته اللاعضوية، ففي حالة الأكسدة +2 يشكّل الحديد مركّبات الحديدوز، وفي حالة الأكسدة +3 يشكل مركّبات الحديديك. يعدّ الحديد الرباعي شائعاً في المركّبات الوسطية في عددٍ من تفاعلات الأكسدة الكيميائية الحيوية.[86][135] من جهةٍ أخرى، يستطيع الحديد أيضاً أن يشكّل مركّبات كيميائية بحالات أكسدة عليا، مثل حالة الأكسدة +6 في مركّب حديدات البوتاسيوم [ملاحظة 93] القرمزي K2FeO4؛ أمّا حالات الأكسدة الأعلى من ذلك فهناك خلافٌ على حقيقة وجودها.[136] هناك عددٌ من مركّبات الحديد العضوية، والتي تتراوح فيها حالة أكسدة الحديد بين +1 أو 0 أو −1 أو حتى −2. غالباً ما تُحدَّد حالة أكسدة الحديد والعدد التناسقي وخواص ارتباطه الكيميائي وفق تقنية مطيافية موسباور.[137] يوجد عددٌ من المركّبات مختلطة التكافؤ [ملاحظة 94] والحاوية على مراكز من الحديد الثنائي والثلاثي، مثلما هو الحال في المغنيتيت أو خضاب أزرق بروسيا Fe4[Fe(CN)6]3،[86] والذي كان شائع الاستخدام سابقاً في الطبعات الزرقاء.[138]
اللاعضوية
- الأكاسيد والهيدروكسيد
يشكّل الحديد عدداً من أكاسيد الحديد المختلفة، أكثرها شيوعاً أكسيد الحديد الثنائي FeO (أكسيد الحديدوز)، وأكسيد الحديد الثلاثي Fe2O3 (أكسيد الحديديك)، وأكسيد الحديد الثنائي والثلاثي Fe3O4 (أكسيد الحديد المغناطيسي)؛ مع وجود عددٍ من صيغ الأكاسيد غير المتكافئة.[139] من الممكن تحضير أكسيد الحديدوز؛ إذ يُستحصَل من التحلل الكيميائي لمركّب أكسالات الحديد الثنائي FeC2O4، وهو مركّب ذو لون أسود، لكنّه غير مستقرّ عند درجة حرارة الغرفة، إذ من السهل عليه أن يتأكسد. أمّا أكسيد الحديديك فهو مسحوقٌ بلّوريٌّ ذو لون أحمر إلى بنّي، ويتكوّن عند أكسدة الحديد بوجود كمّيّة كافية من الأكسجين، وهو يوجد طبيعياً على هيئة معدَني الهيماتيت والمغهيميت.[ملاحظة 95] يحوي أكسيد الحديد الثنائي والثلاثي على الحديد في حالتي الأكسدة +2 و +3، وهو يتكوّن طبيعياً من النشاط البركاني في الأرض، وذلك على هيئة معدن المغنيتيت. كما يمكن أن يتشكّل عند حرق الحديد بشكلٍ مباشر. تعدّ الأكاسيد المذكورة الأكاسيد الرئيسية في إنتاج الحديد، مثلما يحدث في أفران الحديد الخالص أو الأفران اللافحة؛ كما تُستخدَم في إنتاج مواد الفرّيت ووسائط التخزين المغناطيسي وفي مجال الخُضُب. يمكن الحصول أيضاً أكسيد الحديد الرباعي FeO2، وهو أكسيد غير شائع للحديد.[140] لا تعدّ طبقة الأكسيد في الحديد مُخَمّلةَ، وذلك على العكس من الألومنيوم أو الكروم، وذلك لكونها مسامية، وهي قادرةٌ على إبطاء عملية الأكسدة، ولكنها لا تمنع من تأكسد الحديد بالكامل؛ ولذلك فإنّ عملية تزريق الفولاذ [ملاحظة 96]، والتي تتضمّن تخميلاً جزئياً للفولاذ بتغطيته بطبقة من الأكسيد، لا تصون الحديد من التآكل.[141]
ينتمي أكسيد هيدروكسيد الحديد الثلاثي FeO(OH) إلى مجموعة الهيدروكسيدات، والذي يمكن أن يصنّف ضمن هيدرات أكسيد الحديد الثلاثي. يوجد هذا المركّب في الطبيعة على شكلَين، الأوّل هو الشكل ألفا في معدن الغوتيت؛ والثاني هو الشكل غامّا في معدن ليبيدوكروكيت [ملاحظة 97]. يمكن أن يتفاوت التركيب حسب درجة التَمَيُّه [ملاحظة 98] في أكسيد هيدروكسيد الحديد الثلاثي، والذي يتحوّل عند التسخين إلى أكسيد الحديد الثلاثي.[142]
- الكبريتيدات
يوجد مركب كبريتيد الحديد الثنائي في الطبيعة على هيئة معدن البيريت؛[ملاحظة 99]، والذي يعرف بالاسم الشائع الذهب الكاذب أو ذهب المغفّلين، وذلك بسبب بريقه ولمعانه الشبيه ببريق الذهب.[86] للمركّب الصيغة الكيميائية FeS2 وهو متعدّد كبريتيد يحوي على أيونات 2+Fe و2-S2 مرتّبة وفق بنية بلّورية مشوّهة على نمط بنية كلوريد الصوديوم.[139]
- الهاليدات
تعدّ هاليدات الحديد الثنائي والثلاثي من المركّبات الكيميائية المعروفة. يُستحصَل على هاليدات الحديدوز المميّهة FeX2 (FeF2 وFeCl2 وFeBr2 وFeI2) بشكلٍ نمطيٍّ من معالجة فلزّ الحديد مع أحماض هاليد الهيدروجين HX الموافقة:[86]
_chloride_hexahydrate.jpg.webp)
-sulfate-heptahydrate-sample.jpg.webp)
أمّا هاليدات الحديديك FeX3 (FeF3 وFeCl3 وFeBr3 وFeI3) فيُستحصَل عليها من التفاعل المباشر بين فلزّ الحديد والهالوجين الموافق:[143]
وأكثر هذه المركّبات شهرةً هو كلوريد الحديد الثلاثي FeCl3؛ والذي يمكن لمحاليله أن تؤكسد النحاس وتذيبه.
يعدّ مركّب يوديد الحديديك حالةً خاصّةً، فهو غير مستقرّ ثرموديناميكياً، وذلك بسبب القوّة المؤكسدة لأيون 3+Fe، وللقوّة الاختزالية المرتفعة لأيون اليوديد −I.[143]
بالرغم من ذلك يمكن تحضير هذا المركّب تحت شروطٍ خاصّةٍ، وذلك من تفاعل خماسي كربونيل الحديد مع اليود وأحادي أكسيد الكربون في وسط من الهكسان وبتحفيز ضوئي عند درجة حرارة تبلغ −20 °س، وبمعزل عن الأكسجين والماء.[143] بالمقابل، فإنّ معقّدات يوديد الحديديدك مع بعض القواعد الكيميائية هي مركّبات مستقرّة.[144][145]
- الكبريتات
عُرفَ مركّب كبريتات الحديد الثنائي FeSO4 قديماً باسم الزاج الأخضر، وذلك نظراً للونه الأخضر المميّز، وهو عامل مختزل جيّد. من جهةٍ أخرى، تكون محاليل مركّب كبريتات الحديد الثلاثي Fe2(SO4)3 ذات لون أصفر، ولذلك كان يعرف قديماً باسم الزاج الأصفر. لكبريتات الحديد الثلاثي تطبيقاتٍ عديدة، منها استخدامه مرسّخاً لونياً في عمليات الصباغة.
- أملاح أخرى
للحديد عددٌ كبيرٌ من الأملاح والمركّبات الكيميائية اللاعضوية، منها على سبيل المثال: النترات (نترات الحديد الثنائي Fe(NO3)2 ونترات الحديد الثلاثي Fe(NO3)3)؛ والفوسفات (فوسفات الحديد الثنائي Fe3(PO4)2 وفوسفات الحديد الثلاثي FePO4). كما يوجد للحديد ملح مزدوج على هيئة كبريتات الأمونيوم والحديد الثنائي NH4)2Fe(SO4)2.6H2O)، والمعروف باسم «ملح مور»، وهو كاشف كيميائي مهمّ في المعايرة؛ وكذلك على هيئة كبريتات الأمونيوم والحديد الثلاثي NH4Fe(SO4)2.12H2O. على العموم تميل أملاح الحديد الثنائي إلى الأكسدة بالهواء إلى أملاح الحديد الثلاثي.[86]
المعقدات التناسقية

نظراً للبنية الإلكترونية المميّزة للحديد فهو قادر على تشكيل عددٍ معتبرٍ من المعقّدات التناسقية؛ من الأمثلة النمطية على ذلك الأنيون سداسي كلورو الحديدات [ملاحظة 100] 3−[FeCl6]، حيث يكون الحديد الثلاثي فيه ذا عدد تناسقي مقداره 6؛ وهو متضمّن في بنية المعقّد كلوريد رباعي (ميثيل أمونيوم) سداسي كلورو الحديدات[ملاحظة 101].[146][147] تشبه معقّدات الحديد الثلاثي نظيراتها من الكروم الثلاثي، مع وجود استثناء بتفضيل الحديد الثلاثي للرُبَيطات المانحة لذرة أكسجين عوضاً عن تلك المانحة لذرة نتروجين. إذ لا تعدّ معقّدات الحديد الثلاثي مع الرُبَيطات النتروجينية ذات ثباتية مرتفعة بالمقارنة مع معقّدات الحديد الثنائي، وغالباً ما تتفكّك في المحاليل المائية. تبدي معقّدات الحديد الحاوية على الرابطة Fe–O ألواناً شديدة، وغالباً ما تستخدم في اختبارات الكشف عن الفينولات أو الإينولات، مثلما هو الحال في اختبار كلوريد الحديديك للكشف عن الفينول، إذ يتفاعل كلوريد الحديديك مع الفينول ليشكل معقّداً ذا لون بنفسجي غامق.[148]
من بين المعقّدات مع الهاليدات والهاليدات الزائفة تعدّ معقّدات الحديد الثلاثي الفلورية الأكثر استقراراً، وخاصة معقّد 2− [FeF5(H2O)] عديم اللون في الأوساط المائية. لا تتمتّع المعقّدات الكلورية بثباتية كبيرة، وتميل إلى تفضيل التناسق رباعي السطوح، كما هو الحال في معقّد − [FeCl4]؛ بالمقابل يُختزَل معقّدا − [FeBr4] و− [FeI4] بسهولة إلى الحديد الثنائي. كما هو الحال مع المنغنيز الثنائي تمتلك أغلب معقّدات الحديد الثلاثي قيم لفٍّ مغزليٍّ مرتفع، [ملاحظة 102] والاستثناءات تكون لتلك الحاوية على رُبَيطات واقعة في أعلى السلسلة الكيميائية الطيفية مثل السيانيد. من الأمثلة على معقّدات الحديد الثلاثي منخفضة اللفّ المغزلي معقّد 3− [Fe(CN)6]، والذي يمتاز بسهولة انفصام رُبَيطات السيانيد فيه، ولذلك فهو معقّد سام، وذلك على العكس من معقّد الحديد الثنائي 4−[Fe(CN)6] الداخل في تركيب خضاب أزرق بروسيا؛[148] والذي لا يحرّر سيانيد الهيدروجين إلّا عندما يُمزَج مع أحماضٍ ممدّدة.[149] يعدّ خضاب أزرق بروسيا (فِرّوسيانيد الحديديك) من الأمثلة على معقّدات الحديد التناسقية الحاوية على الحديد الثنائي والثلاثي في البنية؛ فهو معقّد له الصيغة Fe4 [Fe(CN)6]3، ويُحضّر من تفاعل ملح للحديد الثلاثي مع فروسيانيد البوتاسيوم K4 [Fe(CN)6].[86] على العموم فإن معقّدات الحديد الثنائي التناسقية أقلّ استقراراً وثباتية من نظيراتها من الحديد الثلاثي، إذ تميل إلى التأكسد إلى الحديد الثلاثي، ويمكن التقليل من ذلك بتخفيض قيمة pH الوسط وحسب نوعية الرُبَيطات الموجودة في المعقّد.[149]
تُظهِر معقّدات الحديد العضوية الحاوية على ربيطات ثنائية السن خاصّية التصاوغ الهندسي؛ فعلى سبيل المثال، يلزم المصاوغ المفروق [ملاحظة 103] في اصطناع تركيبات معقّدة [ملاحظة 104] حاوية على ربيطات 2،1-مضاعف (ثنائي فينيل فوسفينو) الإيثان (dppe) في بنيتها.[150][151] يحوي أيون فِرّي أكسالات [ملاحظة 105] على ثلاث ربيطات من الأكسالات، وهو يظهر خاصّية اليدوية المحورية.[ملاحظة 106][148]
المركبات العضوية الفلزية

.JPG.webp)
تهتمّ كيمياء الحديد العضوية بدراسة المركّبات العضوية لفلزّ الحديد الحاوية على رابطة كيميائية بين الحديد والكربون العضوي. من بينها المعقّدات الكربونيلية والشطيرية [ملاحظة 107] ونصف الشطيرية [ملاحظة 108] من الأمثلة المعروفة على مركّبات الحديد العضوية معقّد الفِرّوسين الشطيري Fe(C5H5)2 والذي يتمتّع بثباتية كبيرة، وله بنية تقع فيها ذرّة الحديد المركزية بين وحدتَين من أنيون حلقي البنتاديينيل. اكتشف هذا المركّب سنة 1951؛[152] وأدّى ذلك الاكتشاف إلى فتح الباب لعديدٍ من الدراسات عن هذا المركّب؛[153] وعن بنيته؛[154][155] وكذلك عن بنية المركّبات الشبيهة لفلزّات أخرى، والتي تُعرَف باسم الميتالوسينات.[ملاحظة 109][156]
من الأمثلة التاريخية أيضاً على مركّبات الحديد العضوية معقّد خماسي كربونيل الحديد Fe(CO)5، والذي ترتبط فيه ذرّة الحديد المركزية المعتدلة بخمس ذرّات كربون لخمس جزيئات من أحادي أكسيد الكربون. يُستخدَم المعقّد من أجل تحضير مسحوق الحديد الكربونيلي،[ملاحظة 110] وهو شكلٌ تجاريٌّ للحديد مرتفعُ النشاط والفعالية الكيميائية. يعطي التفكّك الحراري لمعقّد Fe(CO)5 معقّداً آخر، وهو اثنا عشري كربونيل ثلاثي الحديد [ملاحظة 111] Fe3(CO)12، وهو يحوي على ثلاث ذرّات حديد في نواته المركزية. يعدّ كاشف كولمان [ملاحظة 112] من الكواشف المهمّة في الكيمياء العضوية، وهو يتكوّن كيميائياً من حديدات رباعي كربونيل ثنائي الصوديوم Na2[Fe(CO)4]، وتكون فيه ذرّة الحديد بحالة الأكسدة (-2) النادرة؛ كما توجد أيضاً حالة الأكسدة (+1) النادرة أيضاً للحديد في معقّد مضاعف ثنائي كربونيل حلقي بنتاديينيل الحديد 2[C5H5Fe(CO)2].[157] تُستخدَم المركّبات الحاوية على ذرّة حديد مركزية في مجال التحفيز؛ مثلما هو الحال في معقّد كُنُولكَر،[ملاحظة 113] المستخدَم حفّازاً من أجل هدرجة الكيتونات.[158]
التحليل الكيميائي
يوجد عددٌ من أساليب التحليل النوعية الكيميائية التقليدية للكشف عن الحديد؛[159] منها:
- تفاعل الكشف باستخدام حمض الثيوغليكوليك
يتفاعل حمض الثيوغليكوليك بوجود أيونات الحديد الثنائي أو الثلاثي ليشكّل معقّداً ذا لون أحمر داكن:[160]
-Ionen_und_Thiocyanat.JPG.webp)
- تفاعل الكشف باستخدام الثيوسيانات
يمكن الكشف عن أيونات الحديد الثلاثي باستخدام أيون الثيوسيانات (المعروف أيضاً باسم الرودانيد [ملاحظة 114])، حيث يتشكّل مركّب ثيوسيانات الحديد الثلاثي، ذا اللون الأحمر القانئ:
يمكن أن يحصل تداخل في هذا التحليل في حال وجود أيونات من الكوبالت أو الموليبدنوم أو الزئبق.[161]
- تفاعل الكشف بتشكل أزرق بروسيا
يعطي تفاعل الحديد الثنائي مع مركّب فريسيانيد البوتاسيوم لوناً أزرق:
كما يقوم بذلك أيضاً تفاعل الحديد الثلاثي مع مركّب فروسيانيد البوتاسيوم:
وينشأ من كلا التفاعلَين لون أزرق، وهو خضاب أزرق بروسيا، إذ تحدث حالة توازن كيميائي بين الشكلَين:[162]
الصدأ
إنّ أكبر السلبيات التي تواجه الحديد النقي وأغلب سبائكه هو تشكّل طبقة الصدأ، والتي إن بقيت من غير معالجة، فإنها تسرّع من تآكل المنشآت، وتلك عملية تكلّف كثيراً في الاقتصاد العالمي.[108] تكون التفاعلات الكيميائية الكهربائية أثناء صدأ الحديد على الشكل التالي:[163]
المِصعَد:
المِهبَط:
التفاعل الإجمالي:
فيتشكّل بالتالي من أيونات الحديد الثلاثي وأيونات الهيدروكسيل الموجودة في الوسط مركّب هيدروكسيد الحديد الثلاثي Fe(OH)3، والذي يتحوّل إلى أكسيد هيدروكسيد الحديد الثلاثي FeO(OH) المميّهة:
والتي يمكن أن تتحوّل إلى أكاسيد الحديد الثنائي والثلاثي الموافقة:
بالنهاية تتشكّل طبقة من الصدأ وهي طبقة مشتركة من أكاسيد الحديد الثنائي والثلاثي لها الصيغة العامة:
لمعالجة مشكلة الصدأ هناك طرائق مختلفة تتمثل بالطلاء أو الغلفنة [ملاحظة 115] أو التخميل [ملاحظة 116] أو التغليف بطبقة من اللدائن أو من خلال عملية تزريق الفولاذ. تعمل تلك الطرائق على حماية الحديد من الصدأ إمّا من خلال حجب ماء الرطوبة أو الأكسجين، أو من خلال الحماية المهبطية.[163]

رائحة الحديد
إنّ الحديد النقي عديم الرائحة؛ إلّا أن الرائحة المميّزة لفلزّ الحديد تنشأ عند ملامسة الأشياء المصنوعة من الحديد، وذلك من التفاعل الكيميائي بين مكوّنات العَرَق والطبقة الدهنية على بشرة الجلد مع أيونات الحديد الثنائي على سطح الحديد.[164] أحد المركّبات المسؤولة عن رائحة الحديد النمطية هو 1-أوكتين-3-أون [ملاحظة 117]،[165] وهو مركّب كيتوني غير مشبع ذو رائحة حتّى في تراكيز منخفضة جدّاً.[166] توجد هناك مركّبات أخرى من الألدهيدات والكيتونات، والتي تنشأ من فوق أكسدة الليبيدات [ملاحظة 118].[167] تنشأ رائحة مشابهة عند دعك الدم على الجلد، لأن الدمّ يحوي أيضاً على أيونات الحديد الثنائي.[167]
الدور الحيوي
الحديد ضروريٌّ وأساسيٌّ لوجود الحياة.[168][169] إذ تنتشر العناقيد الكبريتية الحديديّة في عددٍ من الإنزيمات، من ضمنها النتروجيناز، وهو إنزيم مسؤولٌ عن عمليّات تثبيت النيتروجين الحيوية. كما تساهم البروتينات الحاوية على الحديد في عمليّات نقل وتخزين واستخدام الأكسجين؛[170] وكذلك في عمليّات انتقال الإلكترون البَينيّة.[171] يمكن للنمو الميكروبي أن يُعزّز عبر أكسدة الحديد الثنائي أو اختزال الحديد الثلاثي.[172]

تعدّ بروتينات الهيم [ملاحظة 119] أشهر الأمثلة على البروتينات الحاوية على الحديد في جسم الإنسان، كل من الهيموغلوبين [ملاحظة 120] (خضاب الدم) والمَيوغلوبين [ملاحظة 121] وسيتوكروم P450 [ملاحظة 122].[170] تساهم هذه البروتينات في نقل الغازات وبناء الإنزيمات ونقل الإلكترونات.[171] من الأمثلة على البروتينات الفلزّية [ملاحظة 123] الحاوية على الحديد كلّ من الفيرّيتين والروبردوكسين [ملاحظة 124]؛[171] كما يوجد هناك عددٌ من الإنزيمات المهمّة الحاوية على الحديد مثل الكاتالاز [ملاحظة 125]،[173][174] وليبوكسيجيناز [ملاحظة 126]،[175] بالإضافة إلى الإنزيم الرابط لعنصر الاستجابة للحديد[ملاحظة 127]؛[176] والفرّيدوكسين [ملاحظة 128].[171] على العموم يشكّل اكتساب الحديد تحدّياً بالنسبة للكائنات الهوائية، إذ أنّ الحديديك (أيون الحديد الثلاثي) ضعيف الانحلالية في الأوساط المعتدلة؛ بالتالي ينبغي لتلك الكائنات أن يكون الحديد فيها على شكل معقّد، وأحياناً يؤخذ الحديد على هيئة حديدوز قبل أن يؤكسَد إلى حديديك.[170] وخاصّةً عند البكتريا، الحاوية على عوامل حاجزة تدعى حاملات الحديد [ملاحظة 129].[177][178]
عند الإنسان
يحوي جسم إنسان بالغ وسطياً على 0.005% (خمسة بالألف) من وزنه حديداً، وذلك يعادل حوالي أربعة غرامات؛ ويكون حوالي ثلاث أرباع تلك الكمّيّة على هيئة هيموغلوبين، وهي سويّة تبقى ثابتة على الرغم أنّ حوالي ميليغرام واحد من الحديد يُمتصّ يومياً من الجسم؛[171] لأنّ الجسم يعيد تدوير الهيموغلوبين من أجل الحفاظ على محتوى الحديد فيه.[179]
بعد دخوله إلى الوسط الخلوي داخل جسم الإنسان، يُضبَط مستوى الحديد بشكلٍ دقيق؛[170][180] ويساهم بروتين الترانسفرّين [ملاحظة 130] بدورٍ أساسيِّ في ذلك، إذ يقوم بالارتباط مع أيونات الحديد الممتصّ في منطقة الاثنا عشري، وينقله في مجرى الدم إلى الخلايا.[170][181] يحوي بروتين ترانسفرّين على أيون الحديديك 3+Fe في مركز ثماني سطوح مشوّه الشكل [ملاحظة 131]، والذي يرتيط مع ذرّة نتروجين وثلاث ذرّات أكسجين، بالإضافة إلى وجود أنيون كربونات مُمَخْلِب [ملاحظة 132] قادرٍ على احتجاز أيونات الحديديك في الداخل. يُختزَل الحديد في الترانسفرّين في نخاع العظام من الحديديك إلى الحديدوز ليتحوّل الترانسفيرّين بذلك إلى فِرّيتين [ملاحظة 133].[171]
يساهم الهيموغلوبين (خضاب الدم) في نقل الأكسجين في كريات الدم الحمراء ويمنحها اللون الأحمر، ويقوم بنقل الأكسجين في الشرايين من الرئتين إلى العضلات، حيث يُحوّل هناك إلى ميوغلوبين، والذي يُخزّن إلى حين الحاجة إليه من أجل الأكسدة الاستقلابية للغلوكوز المولّدة للطاقة.[170] يرتبط الهيموغلوبين مع ثنائي أكسيد الكربون الناتج عن أكسدة الغلوكوز وينقله عبر الأوردة على هيئة أنيون بيكربونات عائداً إلى الرئتين، حيث يُطرَح مع الزفير.[171] يقع الحديد في الهيموغلوبين في واحد من أربع مراكز من الهيم، ويكون الحديد فيه سداسي التناسق، بحيث يكون الحديد قادراً على تشكيل ستّ روابط تناسقية: أربع روابط مع ذرّات نتروجين في حلقة البورفيرين، ورابطة خامسة مع ذرّة نتروجين في حلقة إيميدازول في الحمض الأميني الهستيدين الطرفي والمتوفّر من سلسلة جانبية من البروتين المرتبط بالهيم، ورابطة سادسة محجوزة ومخصّصة من أجل الارتباط مع جزيء الأكسجين.[171] عندما لا يرتبط الهيموغلوبين مع الأكسجين، والذي يدعى حينها هيموغلوبين منزوع الأكسجين (ديوكسي هيموغلوبين)[ملاحظة 134] تكون أيونات الحديدوز 2+Fe في مركز الهيم في حالة تشكيل إلكتروني مرتفع اللفّ المغزلي [ملاحظة 135]، ممّا يزيد من حجمها، بالتالي تصبح الفجوة في منتصف حلقة البورفيرين صغيرةً عليها، ممّا يؤدّي إلى نتوء أيونات الحديدوز بمسافةٍ مقدارها 55 بيكومتر، وبالتالي إلى تغيّر الشكل الهندسي للجزيء، ممّا يؤدّي إلى حجب الموقع السادس المخصّص للأكسجين عبر الارتباط مع نتروجين من هيستيدين طرفي آخر.[171]
عندما يلتقط الهيموغلوبين منزوع الأكسجين جزيء أكسجين، فإنّ الهيستيدين الطرفي يتنحّى جانباً ويعود إلى موضعه عند الارتباط الوثيق لجزيء الأكسجين، والذي يشكّل رابطة هيدروجينية معه. ممّا يجعل أيون الحديدوز 2+Fe في حالة تشكيل إلكتروني منخفض اللفّ المغزلي [ملاحظة 136]، وذلك يخفّض من الحجم الذي تشغله فراغياً بمقدار 20%، ممّا يمكّن من عودتها إلى الفجوة في منتصف حلقة البورفيرين، بالتالي يعود الشكل الهندسي للجزيء مستوياً مرّة أخرى.[171] بالإضافة إلى ذلك، فإنّ الرابطة الهيدروجينية المذكورة تساهم في إمالة جزيء الأكسجين، بحيث تصبح زاوية الرابطة Fe–O–O حوالي 120°، وذلك يجنّب تشكيل روابط جسرية مثل Fe–O–Fe أو Fe–O2–Fe، والذي قد يؤدّي وجودها إلى حدوث انتقال إلكتروني، أو إلى أكسدة الحديدوز إلى حديديك، أو إلى تَهَدّم سلسلة بروتين الهيموغلوبين، الأمر الذي يؤدّي إلى تغيّر شكل وحدات أخرى في الهيموغلوبين لتتشكّل بذلك ألفة كيميائية تجاه الأكسجين، بالتالي عندما يقوم الهيموغلوبين منزوع الأكسجين بالتقاط الأكسجين فإنّ ألفته تجاه الأكسجين ستزداد، والعكس صحيح.[171] من جهةٍ أخرى، فإنّ جزيء الميوغلوبين يحوي على مجموعة هيم واحدة، بالتالي لا تحدث ظاهرة تأثّر الألفة بمجموعات الهيم الأخرى. لذلك فإنّ الهيموغلوبين يكون شبه مشبعاً بالأكسجين في المناطق مرتفعة الضغط الجزئي من الأكسجين والموجودة في الرئتين، ولكن بالمقابل تكون ألفته تجاه الأكسجين أقلّ بكثير من تلك التي للميوغلوبين، والذي يتأكسج حتّى في ضغوط جزئية منخفضة من الأكسجين والموجودة في أنسجة العضلات.[171] يؤدّي وجود ثنائي أكسيد الكربون في المحيط إلى التقليل من ألفة الهيموغلوبين إلى الأكسجين، كما هو معروف في تأثير بور.[171] هناك بعض الجزيئات ذات التأثير السمّي على الإنسان، مثل أحادي أكسيد الكربون CO وثلاثي فلوريد الفوسفور PF3، والتي تعود سمّيتها إلى ارتباطها إلى الهيموغلوبين بشكل أوثق من ارتباط الأكسيجن، ممّا يؤدّي إلى تثبيط عمليات نقل الأكسجين إلى خلايا الجسم. يدعى جزيء الهيموغلوبين عند ارتباطه مع أحادي أكسيد الكربون باسم كربوكسي هيموغلوبين. [ملاحظة 137] تحوي بروتينات السيتوكروم على مجموعات هيم، وهي تدخل في عمليات الأكسدة الاستقلابية للغلوكوز بالأكسجين؛ ويرتبط حينها الموقع السادس إمّا بنتروجين إيميداوزل أو بذرّة كبريت من ميثيونين، ممّا يجعل من تلك البروتينات خاملةً بشكل كبير تجاه الأكسجين. يبقى الحديد عند الانتقال الإلكتروني في حالة لفٍّ مغزليٍّ منخفض، إلّا أنّ حالة الأكسدة للحديد تتغيّر بين +2 و+3.[171] تعدّ البروتينات الحديدية الكبريتية ذات أهمية كبيرة، فهي تساهم في عمليات الانتقال الإلكتروني البَينيّة. تحوي هذه البروتينات على تجمّعات عنقودية من ذرّات الحديد والكبريت، وذلك في بنىً معقّدة؛ وقد يصل عدد ذرّات الحديد فيها إلى ثمان ذرّات. أمّا أبسط تلك البروتينات فهو الروبردوكسين، والحاوي على ذرّة حديد واحدة متناسقة إلى أربع ذرّات من الكبريت.[171]
عند الكائنات الأخرى
تساهم بروتينات الهيم في نقل الأكسجين عند الثديّيات، كما هو الحال عند الإنسان. بالنسبة للنباتات يؤثّر الحديد على عملية التركيب الضوئي، وذلك من خلال التأثير على تشكّل الكلوروفيل (اليخضور) والكربوهيدرات (السكّريات)؛ لأنّ الحديد يدخل في تركيب عددٍ من الإنزيمات المهمّة لتلك العمليات، وذلك إلى جانب الموليبدنوم في تركيب إنزيم النتروجيناز على سبيل المثال، والمهمّ من أجل عملية تثبيت النتروجين الحيوية.[183] تساهم حاملات الحديد الموجودة في الكائنات الحيّة الدقيقة الهوائية بالقرب من جذور النباتات في التربة في حجز الحديديك 3+Fe، واختزاله إلى الحديدوز 2+Fe، ثم بتعقيده.[184] قد يتطلّب الأمر في بعض الأحيان إجراء تسميد بالحديد؛ إذ يؤدّي عوز الحديد في النبات إلى اصفرار الأوراق وشحوبها.[166] يعدّ الحديد مهمّاً أيضاً بالنسبة للفطريات (على شكل معقّد فِرّيكروم [ملاحظة 138] المهمّ لنموها)؛ وللبكتريا (مثل البكتريا المتسلسلة [ملاحظة 139])؛ وكذلك بالنسبة للديدان الحلقية [ملاحظة 140] (خاصّةً في بنية بروتين الهيم إرثرين [ملاحظة 141]).[166] توجد بكتريا مؤكسدة للحديد؛ إذ تقوم بعض أنواع البكتريا باستخدام الحديدوز مانحاً للإلكترونات من أجل اختزال ثنائي أكسيد الكربون.[185]
التغذية والصحة
الحديد واسع الانتشار في الغذاء؛ ومن المصادر الغذائية المعروفة بارتفاع محتواها من الحديد كلّ من اللحوم الحمراء ولحوم الدواجن والسمك والمحار والبقوليات والورقيات، وكذلك في التوفو ودبس السكر.[170] في بعض البلدان يُدعّم الخبز وحبوب الفطور بالحديد كما هو الحال في بريطانيا.[186] يمكن أن يُستحصَل على الحديد ضمن المكمّلات الغذائية على هيئة فومارات أو كبريتات الحديد الثنائي.[187][188] يتوافر الحديد حيوياً بشكل أكبر غالباً عندما يكون مُتَمَخْلِباً مع الأحماض الأمينية؛[189] مثل الغلايسين.[190]
التوصيات الغذائية
fumarate.svg.png.webp)
قَدّرَت الأكاديمية الوطنية للطب [ملاحظة 142] في الولايات المتّحدة الأمريكية (سابقاً تحت اسم المعهد الأمريكي للطبّ) [ملاحظة 143] معدّل الحاجة التقريبي [ملاحظة 144] من الحديد في سنة 2001؛[170] وذلك للنسوة بمقدار 7.9 مغ/اليوم بالنسبة للاتي أعمارهن بين 14-18 سنة؛ وبمقدار 8.1 مغ/اليوم للاتي أعمارهن بين 19-50؛ وبمقدار 5.0 مغ/اليوم للأسن من ذلك؛ أمّا الكمية المُوصى بتناولها [ملاحظة 145] للحوامل فهي مقدار 27 مغ/اليوم، وللمرضعات بمقدار 9 مغ/اليوم؛ وهي بالنسبة للأطفال الذين أعمارهم بين 1-3 سنة بمقدار 7 مغ/اليوم، وبين 4-8 سنة بمقدار 10 مغ/اليوم، وبين 9-13 سنة بمقدار 8 مغ/اليوم؛ أمّا بالنسبة للرجال فحُدِّد معدّل الحاجة التقريبي بمقدار 6.0 مغ/اليوم لمن تتجاوز أعمارهم 19 سنة، والكمّية الموصى بتناولها بمقدار 8.0 مغ/اليوم؛ مع العلم أنّ المستوى الأقصى المقبول [ملاحظة 146] بالنسبة للحديد هو مقدار 45 مغ/اليوم.[191] وضعت الهيئة الأوروبية لسلامة الأغذية [ملاحظة 147] مقادير ضابطة مقاربة لما هو متّبع في الولايات المتّحدة.[192][193]
قد يحتاج الأطفال الرضّع إلى مكمّلات الحديد، إن كان الإرضاع مصدره حليب البقر.[194] من جهةٍ أخرى، قد يحتاج المتبرّعون بالدم دورياً إلى تناول مكمّلات الحديد أيضاً.[195] تبلغ نسبة القيمة اليومية [ملاحظة 148] الكافية للحصول على المدخول الكافي من الحديد، والموضوعة على ملصقات المكمّلات الغذائية في الولايات المتّحدة مقدار 18 مغ.[196][197]
عوز الحديد
يعدّ عوز الحديد (أو نقص الحديد) [ملاحظة 149] أحد أكثر أشكال سوء التغذية شيوعاً في العالم.[198][199] يحدث هذا النقص عندما لا تُعوّض كمّيّة الحديد في الجسم عبر مصدر غذائي ملائم، ممّا يؤدّي مع مرور الوقت إلى حدوث عوز كامن [ملاحظة 150] في البداية، والذي قد يتطوّر في حال عدم المعالجة إلى فقر الدم الناجم عن عوز الحديد [ملاحظة 151]، والذي يُشخّص بعدم وجود عددٍ كافٍ من خلايا الدم الحمراء، وبكمّية غير كافية من الهيموغلوبين (خضاب الدم).[200] باتّباع حميةٍ مناسبةٍ يمكن الشفاء من هذا المرض؛ وتكون أعراض هذا العوز في العادة متوسّطة الشدة، وفي حال عدم المعالجة يمكن أن يتسبّب ذلك بظهور مشاكل مثل اضطراب النظم القلبي، وبمضاعفات أثناء الحمل، وبتأخر النموّ عند الأطفال.[201]
فرط الحديد
يُضبَط مستوى الحديد في الإنسان صحيح الجسم بشكلٍ دقيقٍ عند استقلابه، بحيث أنّ القسم الأكبر يعاد تدويره، ولا يُطرَح منه خارج الجسم إلا كمّيّات صغيرةٍ يومياً بسبب انسلاخ الخلايا الطلائية الظهارية والمخاطية الداخلية؛ بالتالي فإنّ ضبط مستوى الحديد في الجسم يحدث بضبط المأخوذ اليومي منه.[202] يحدث لدى البعض خللٌ في ضبط مستوى الحديد نتيجة اضطراب جيني في الصبغي السادس، والذي يؤدّي إلى انخفاضٍ غير طبيعيٍّ في مستوى بروتين الهيبسيدين [ملاحظة 152]، وهو عاملٌ أساسيٌّ مهمٌّ في ضبط دخول الحديد إلى جهاز الدوران عند الثدييات.[203] بالتالي فإّن تناول كمّيّات فائضة من الحديد يؤدّي إلى حدوث حالة فرط الحديد [ملاحظة 153]، والتي تدعى طبياً داء الاصطباغ الدموي الوراثي [ملاحظة 154]؛[170] وهو داءٌ غير واسع الانتشار، ويصيب أقلَّ من 1% من السكان؛ ولكن بالرغم من ذلك ينبغي استشارة الطبيب بخصوص تناول مكمّلات الحديد.[204]
التسمم بالحديد
يؤدّي أخذ جرعاتٍ فائضةٍ من الحديد إلى التسبّب بارتفاع مستويات الحديد الحرّ [ملاحظة 155] في الدمّ، وذلك يؤدّي إلى تفاعل الحديدوز مع البيروكسيدات، ممّا ينتج جذوراً كيميائيةً حرّةً، والتي يمكن أن تسبّب الضررَ داخل الجسم، ويحصل حينها ما يعرف باسم التسمّم بالحديد [ملاحظة 156]. يحدث هذا العارض عندما تفوق مستويات الحديد الكمّيّات المتوفّرة من الترانسفرّين المسؤول عن الارتباط بالحديد ونقله داخل الجسم؛ ممّا يسبّب الأذى لخلايا الأجهزة والأعضاء الداخلية في الكبد والقلب، وذلك عن طريق ظهور أعراض تتضمّن فشل الكبد والسُحَار الحديدي [ملاحظة 157]؛[166] وكذلك الحماض الاستقلابي [ملاحظة 158] والصدمة والاعتلال الخثري [ملاحظة 159] ومتلازمة الضائقة التنفسية الحادة [ملاحظة 160]، بالإضافة إلى الغيبوبة واحتمالية حدوث الوفاة.[205]
تحدث حالة التسمّم بالحديد عندما تتجاوز كمّيّة الحديد 20 ميليغرام لكل كيلوغرام من وزن الجسم؛ وتعدّ كمّيةٌ مقدارُها 60 ميليغرام لكل كيلوغرام من وزن الجسم جرعةً مُميتةً.[206] تزداد احتمالية الإصابة بالتسمّم خاصّةً لدى الأطفال تحت سنِّ السادسة من العمر؛[206] لذلك ينبغي أن لا يتجاوز المستوى الأقصى المقبول من مأخوذ الحديد مقدار 40 ميليغرام/اليوم.[207] عند حدوث حالة التسمّم بالحديد يوصى بتناول عامل مُمَخْلب مثل ديفيروكسامين [ملاحظة 161]، والذي يعمل على حجز الحديد الفائض في الجسم.[205][208]
العلاقة المرضية
هناك صلةُ وصلٍ بين مستويات الحديد في الجسم وبين ارتفاع احتمالية ظهور أعراض بعض الأمراض؛ مثل السلّ،[209] وداء السلمونيلات،[ملاحظة 162] وداء اليرسنيات [ملاحظة 163].[166] بيّنت بعض الأبحاث أنّ المستويات المتدنيّة من الحديد في منطقة المهاد يمكن أن تلعب دوراً في المسار العضوي المرضي لدى المصابين باضطراب نقص الانتباه مع فرط النشاط [ملاحظة 164]؛[210] لذلك قد يكون لأخذ كمّيّات مضبوطة من مكمّلات الحديد أثراً فعّالاً، خاصّةً في طور عدم الانتباه.[211]
بالنسبة للسرطان قد يكون دور الحديد سلاحاً ذو حدّين، وذلك بسبب حضوره البارز في العمليّات غير المرضية.[212] فمن جهة، وبالنسبة للأشخاص الذي يتلقَّون علاجاً كيميائياً فإنّ ذلك قد يطوّر حالة عوز الحديد وفقر الدم، وذلك قد يستلزم في بعض الأحيان اتباع علاج وريدي بالحديد؛[213] ومن جهةٍ أخرى، فإنّ فرط تناول الحديد يمكن أن يتسبّب بحدوث الأورام، ممّا يزيد من احتمالية الإصابة بالسرطان،[213] وخاصة سرطان القولون.[170]
الأثر البيئي
- على الغلاف الجوي
تساهم صناعة الحديد والفولاذ في حوالي 8% من انبعاثات غاز ثنائي أكسيد الكربون في الغلاف الجوّي على نطاق العالم؛[214] لذلك تجرى حالياً دراساتٌ من أجل الاستعاضة عن فحم الكوك في اختزال خامات الحديد في إنتاج الحديد والفولاذ باستخدام غاز الهيدروجين المُستحصَل من عمليّات التحليل الكهربائي للماء، والتي تستمدّ الطاقة اللازمة لذلك من مصادر متجدّدة.[215]
- على الغلاف المائي
يقوم الحديد بدورٍ مهمٍّ في التأثير على الحياة البحرية، إذ يعدّ من المغذّيات الضرورية لنشاط العوالق؛[216] وذلك يؤثّر على معدّلات النموّ لدى العوالق النباتية [ملاحظة 165] مثل الدياتوم [ملاحظة 166].[217] يمكن لبعض الكائنات الحيّة البحرية الدقيقة أيضاً أن تؤكسد الحديد عندما تكون ظروف الوسط المحيطة غنية بالحديد وفقيرة بالأكسجين.[218]
يمكن للحديد أن يدخل الغلاف المائي البحري من البرّ عن طريق مصبّات الأنهار، أو بشكلٍ مباشرٍ من الغلاف الجوّي. عند دخول الحديد إلى المحيطات فإنه يتوزّع عبر أعمدة الماء من خلال الخلط ومن خلال إعادة التدوير على المستوى الخلوي.[219] أمّا في البحار القريبة من المناطق المتجمّدة فإنّ الجليد البحري يقوم بدورٍ رئيسيٍّ في تخزين وتوزيع الحديد في المحيطات.[220] في دورة الحديد يتغيّر شكل هذا العنصر من الأشكال المائية المذابة إلى الجسيمات الصلبة المعلّقة، وذلك يغيّر من قابلية التوافر الحيوي للوصول إلى الحديد.[221] تساعد زيادة الضوء والحرارة على زيادة كمّيّة الحديد على هيئة أشكال قابلة للامتصاص من الكائنات البحرية.[222]
الاستخدامات

يعدّ فلزّ الحديد أكثر الفلزّات استخداماً في تطبيقات الحياة اليومية، وهو يمثّل 90% من إنتاج الفلزّات العالمي؛ ولكن من النادر استخدامه على شكله النقي في التطبيقات العمليّة التقنيّة، خاصّةً أنّ المواصفات الهندسية للحديد النقي ليست جيّدةً بالشكل الكافي.[223]
- صناعة السبائك
إنّ الاستخدام الأكبر والأوسع للحديد هو على شكل سبيكة مع الكربون، وذلك على هيئة سبيكة الفولاذ (أو الصلب) أو على هيئة حديد زهر (حديد الصب). يعود السبب في كثرة استخدام الحديد في المجال التطبيقي إلى وفرته الكبيرة نسبياً، ممّا يجعل من ثمنه رخيصاً نسبيّاً بالمقارنة مع الفلزّات الأخرى، بالإضافة إلى تميّز سبائك الحديد بمواصفاتٍ هندسيةٍ جيّدةٍ جدّاً من ناحية الصلادة والصلابة البنيوية والمتانة عند السبك مع فلزّات أخرى، مثل الكروم والموليبدنوم والنيكل على سبيل المثال، ممّا يجعلها الخيار الأوّل في العديد من التطبيقات العملية.[224]
- البناء والإنشاء وصناعة الهياكل
يمثّل الحديد الخَيَار الأوّل في مجال الإنشاء، وذلك في بناء الآلات وعِدَدِ الورشات وخطوطِ السِّكَك الحديدية والمَرْكبات وهياكل السفن، بالإضافة إلى بناء البيوت والعمارات، والكثير من تطبيقات الحياة اليومية.[82]
- الكهرومغناطيسية
يصنّف الحديد إلى جانب الكوبالت والنيكل ضمن الفلزّات ذات المغناطيسية الحديدية، ممّا يجعله الخيار الأول في بناء المولّدات الكهربائية والمحوّلات والملفّات الخانقة [ملاحظة 168] والمُرَحّلات [ملاحظة 169] والمحرّكات الكهربائية؛[160] وكذلك في صناعة نواة المغانط.[225][226]
- مركبات الحديد
تستخدم مركّبات الحديد في مجال التحفيز؛ وذلك مثل عملية هابر-بوش أو عملية فيشر-تروبش.[227][228] كما يُستخدَم مسحوق الحديد في وسط حمضي من أجل إجراء اختزال بيشامب لتحويل مركّب نترو البنزين إلى أنيلين.[229] تقوم الحفّازات المعتمدة على الحديد بدورٍ مهمٍّ في تحويل المواد الأوّلية العضوية إلى مواد نافعة الاستخدام في مجال الوقود الحيوي؛[230] وكذلك في تحضير الكيماويات النقيّة الدقيقة [ملاحظة 170]؛[231][232] وخلايا الوقود؛[233] بالإضافة إلى إزالة المواد الكيميائية الخطرة من الوسط.[234] تُستخدَم مركّبات الحديد اللاعضوية بشكلٍ كبيرٍ في مجال تنقية المياه ومعالجة الصرف الصحي، وفي مجال الصباغة والصناعات الإلكترونية.[187] كما تُستخدَم مركّبات معيّنة حاويةٌ على الحديد في معالجة فقر الدم، وخاصّةً فقر الدم الناجم عن عوز الحديد.[235]
في الحياة والثقافة العامة
في الأديان
وردت كلمة حديد في عدة مواضع في القرآن الكريم، وهناك سورة في القرآن هي سورة الحديد ورد فيها إنزال الحديد من السماء، قال تعالى: ﴿لَقَدْ أَرْسَلْنَا رُسُلَنَا بِالْبَيِّنَاتِ وَأَنْزَلْنَا مَعَهُمُ الْكِتَابَ وَالْمِيزَانَ لِيَقُومَ النَّاسُ بِالْقِسْطِ وَأَنْزَلْنَا الْحَدِيدَ فِيهِ بَأْسٌ شَدِيدٌ وَمَنَافِعُ لِلنَّاسِ وَلِيَعْلَمَ اللَّهُ مَنْ يَنْصُرُهُ وَرُسُلَهُ بِالْغَيْبِ إِنَّ اللَّهَ قَوِيٌّ عَزِيزٌ ![]() ٢٥﴾ [الحديد:25]
٢٥﴾ [الحديد:25]
في اللغة
.jpg.webp)
- اللغة العربية
أورد ابن منظور في معجم لسان العرب قوله: «الحديد: هذا الجوهر المعروف لأَنه منيع، القطعة منه حديدة، والجمع حدائد، وحَدائدات جمع الجمع».[ar 1]
- اللغات الأجنبية
يعود استخدام الرمز الكيميائي للحديد Fe من الكلمة اللاتينية ferrum. أمّا أصل كلمة Iron في اللغة الإنجليزية، فله ذات الأصل اللغوي الجرماني لكلمة Eisen الألمانية، وهو يعود إلى الجذر *isarn في اللغة الجرمانية البدائية؛[236] والذي قد يكون مستعاراً من اللغة القلطية [ملاحظة 172]؛ في حين أنّ صلة الوصل مع اللغة الإيليرية [ملاحظة 173] غير واردة.[237]
الرمز الثقافي
نظراً لكونه من المواد التي عاصرها الإنسان منذ القدم، فإنّ الحديد يدخل في كثيرٍ من أساطير الشعوب وفلكلورها. فالشاعر الإغريقي هسيودوس [ملاحظة 174] أورد في قصيدة الأعمال والأيام لائحةً من عصور الإنسان مسماةً نسبةً إلى فلزّات مثل الذهب والفضة والبروزنز والحديد، للإشارة إلى العصور المتعاقبة لتاريخ البشرية.[238]
تبرز أهمية الحديد خاصّةً في حالات النزاع العسكري، ومثالاً على ذلك الحملة الألمانية لعام 1813؛ إذ قام فريدرش فيلهلم الثالث ملك بروسيا [ملاحظة 175] بمنح أوّل قلادةٍ من الصليب الحديدي نيشاناً عسكرياً؛ وصيغَت المشغولات الحديدية والأوسمة بشكل مكثّف، كما جرى تحريض المدنيّين على التبرّع بالذهب والفضّة من أجل شراء الحديد للدعم العسكري.[239]
طالع أيضاً
الهوامش
- يسمى الصَلْب في بعض البلدان العربية
- يدعى أيضاً الحديد الزهر
- Meteoritic iron
- Cape York meteorite
- Cast iron
- Anitta
- Bloomery
- Termit Massif
- Taruga
- Atharvaveda
- Wootz steel
- Cupola furnace
- finery forge
- Abraham Darby I
- Henry Cort
- puddling
- Henry Bessemer
- Bessemer process
- Widmanstätten pattern
- runaway fusion
- Type Ia supernova
- Taenite
- kamacite
- Telluric iron
- Disko Island
- Roussillon
- periclase
- wüstite
- Ferropericlase
- magnesiowüstite
- Silicate perovskite
- ringwoodite
- hematite
- magnetite
- siderite
- Limonite
- Goethite
- pyrrhotite
- pentlandite
- pyrite
- ochre
- Buntsandstein
- International Resource Panel
- El Mutún
- Kiruna mine
- Sintering
- Pelletizing
- United States Geological Survey (USGS)
- World Steel Association
- pig iron والذي يسمّى أيضاً تماسيح الحديد أو الحديد الخام
- Blast furnace والذي يسمى أيضاً الفرن العالي
- Blast furnace gas (BFG)
- slag
- cast iron
- foundries
- cold working
- hot rolling
- forging
- machining
- Annealing
- sponge iron
- open hearth furnace
- Thomas Process
- basic oxygen furnace
- basic oxygen furnace
- Corex Process
- Type II supernova
- enthalpy of atomization
- body-centered cubic (bcc) crystal structure
- face-centered cubic (fcc) crystal structure
- Austenite
- Ferrite
- Curie point
- Paramagnetism
- Ferromagnetism
- spin
- Magnetic domain
- Tensile strength
- Castability
- white cast iron
- cementite
- pearlite
- martensite
- gray cast iron
- Stress concentration
- ductile cast iron
- Carbon steel
- Hardening
- Rolling
- Alloy steel
- High-strength low-alloy steel (HSLA)
- Pourbaix diagram
- Potassium ferrate(VI)
- mixed valence compound
- Maghemite
- Bluing
- Lepidocrocite
- Hydratation
- Pyrite
- hexachloroferrate(III)
- tetrakis(methylammonium) hexachloroferrate(III) chloride
- high-spin
- trans
- chlorohydridobis(bis-1,2-(diphenylphosphino)ethane)iron(II)
- ferrioxalate
- Axial chirality
- Sandwich compound
- Half sandwich compound
- Metallocene
- carbonyl iron
- triiron dodecacarbonyl
- Collman's reagent
- Knölker complex
- rhodanide
- galvanization
- Passivation
- Oct-1-en-3-one
- Lipid peroxidation
- ferritin
- hemoglobin
- myoglobin
- cytochrome P450
- Metalloproteins
- Rubredoxin
- Catalase
- Lipoxygenase
- Iron-responsive element-binding protein
- ferredoxins
- Siderophore
- transferrin
- distorted octahedron
- chelating
- ferritin
- deoxyhemoglobin
- high-spin configuration
- low-spin configuration
- carboxyhemoglobin
- Ferrichrome
- Streptomyces
- Annelid
- Hemerythrin
- National Academy of Medicine
- Institute of Medicine (IoM)
- Estimated Average Requirements (EARs)
- Recommended Dietary Allowance (RDA)
- Tolerable upper intake levels (ULs)
- European Food Safety Authority (EFSA)
- Daily Value (%DV)
- Iron deficiency
- latent iron deficiency
- iron-deficiency anemia
- hepcidin
- iron overload disorder
- Hereditary haemochromatosis
- free iron
- Iron poisoning
- Siderosis
- metabolic acidosis
- coagulopathy
- Acute respiratory distress syndrome
- deferoxamine
- Salmonellosis
- Yersiniosis
- Attention deficit hyperactivity disorder (ADHD)
- Phytoplankton
- diatoms
- The Iron Bridge
- Choke
- Relay
- fine chemicals
- Gold gab ich für Eisen
- Celtic language
- Illyrian language
- Hesiod
- Friedrich Wilhelm III.
المراجع
فهرس المراجع
- باللغة العربية
- بلغات أجنبية
- Weeks, Mary Elvira؛ Leichester (1968)، "Elements known to the ancients"، Discovery of the elements، Easton, PA: Journal of Chemical Education، ص. 29–40، ISBN 0-7661-3872-0، LCCN 68-15217، مؤرشف من الأصل في 6 يونيو 2021.
- Florian Neukirchen (2016)، Von der Kupfersteinzeit zu den Seltenen Erden – Eine kurze Geschichte der Metalle، Springer-Verlag، ص. 65، ISBN 978-3-662-49347-2.
- E. Photos, 'The Question of Meteoritic versus Smelted Nickel-Rich Iron: Archaeological Evidence and Experimental Results' World Archaeology Vol. 20, No. 3, Archaeometallurgy (Feb., 1989), pp. 403-421. Online version accessed on 2010-02-08. نسخة محفوظة 31 ديسمبر 2016 على موقع واي باك مشين.
- Otto Johannsen: Geschichte des Eisens. 3. Auflage. Verlag Stahleisen, Düsseldorf 1953, S. 6-45.
- Wolfgang Helck: Eisen. In: Wolfgang Helck, Eberhard Otto (Hrsg.): Lexikon der Ägyptologie. Band 1, Harrassowitz, Wiesbaden 1975, Spalte 1209–1210.
- Thilo Rehren, Tamas Belgya, Albert Jambon, György Káli, Zs Kasztovszky, Zoltan Kis, Imre Kovács, Boglarka Maróti, Marcos Martinon-Torres, Gianluca Miniaci, Vincent Pigott, Miljana Radivojević, L. Rosta, László Szentmiklósi, Z. Szőkefalvi-Nagy: 5,000 years old Egyptian iron beads made from hammered meteoritic iron. In: Journal of Archaeological Science. Band 40, 2013, S. 4785–4792. doi:10.1016/j.jas.2013.06.002.
- Bjorkman, Judith Kingston (1973)، "Meteors and Meteorites in the ancient Near East"، Meteoritics، 8 (2): 91–132، Bibcode:1973Metic...8...91B، doi:10.1111/j.1945-5100.1973.tb00146.x.
- Comelli؛ d'Orazio؛ Folco؛ El-Halwagy؛ Frizzi؛ Alberti؛ Capogrosso؛ Elnaggar؛ Hassan؛ Nevin, Austin؛ Porcelli, Franco؛ Rashed, Mohamed G؛ Valentini, Gianluca (2016)، "The meteoritic origin of Tutankhamun's iron dagger blade"، Meteoritics & Planetary Science، 51 (7): 1301–09، Bibcode:2016M&PS...51.1301C، doi:10.1111/maps.12664.
- Walsh, Declan (02 يونيو 2016)، "King Tut's Dagger Made of 'Iron From the Sky,' Researchers Say"، The New York Times، مؤرشف من الأصل في 12 نوفمبر 2020، اطلع عليه بتاريخ 04 يونيو 2016،
the blade's composition of iron, nickel and cobalt was an approximate match for a meteorite that landed in northern Egypt. The result "strongly suggests an extraterrestrial origin"
- R. F. Tylecote, A History of Metallurgy (2nd edn, 1992), 3
- Ure, Andrew (1843)، Technisches wörterbuch oder Handbuch der Gewerbskunde ... : Bearb. nach Dr. Andrew Ure's Dictionary of arts, manufactures and mines (باللغة الألمانية)، G. Haase، ص. 492.
- Photos, E. (1989)، "The Question of Meteoritic versus Smelted Nickel-Rich Iron: Archaeological Evidence and Experimental Results"، World Archaeology، Taylor & Francis, Ltd.، 20 (3): 403–21، doi:10.1080/00438243.1989.9980081، JSTOR 124562.
- Muhly, James D. (2003)، "Metalworking/Mining in the Levant"، في Lake, Richard Winona (المحرر)، Near Eastern Archaeology IN: Eisenbrauns، ج. 180، ص. 174–83.
- "Excavation in Turkey Set to Rewrite History of Iron Age," Asahi Shimbun, 27 March 2009.
- Charles Burney: Historical Dictionary of the Hittites. Historical Dictionaries of Ancient Civilizations and Historical Eras. Scarecrow Press, 2004, ISBN 0-8108-6564-5, S. 135–136.
- Muhly, James D. 'Metalworking/Mining in the Levant' pp. 174-183 in Near Eastern Archaeology ed. Suzanne Richard (2003), pp. 179-180.
- Richard A. Gabriel: The Great Armies of Antiquity. Greenwood Publishing Group, 2002, ISBN 0-275-97809-5, S. 75.
- Collins, Rober O. and Burns, James M. The History of Sub-Saharan Africa. New York:Cambridge University Press, p. 37. ISBN 978-0-521-68708-9.
- Duncan E. Miller and N.J. Van Der Merwe, 'Early Metal Working in Sub Saharan Africa' Journal of African History 35 (1994) 1-36; Minze Stuiver and N.J. Van Der Merwe, 'Radiocarbon Chronology of the Iron Age in Sub-Saharan Africa' Current Anthropology 1968.
- Tewari, Rakesh، "The origins of Iron Working in India: New evidence from the Central Ganga plain and the Eastern Vindhyas" (PDF)، State Archaeological Department، مؤرشف من الأصل (PDF) في 5 ديسمبر 2021، اطلع عليه بتاريخ 23 مايو 2010.
- Witzel, Michael (2001), "Autochthonous Aryans? The Evidence from Old Indian and Iranian Texts", in Electronic Journal of Vedic Studies (EJVS) 7-3, pp. 1–93 نسخة محفوظة 12 فبراير 2021 على موقع واي باك مشين.
- G. Juleff (1996)، "An ancient wind powered iron smelting technology in Sri Lanka"، Nature، 379 (3): 60–63، doi:10.1038/379060a0.
- Sawyer, Ralph D. and Sawyer, Mei-chün (1993). The Seven Military Classics of Ancient China. Boulder: Westview. (ردمك 0-465-00304-4). p. 10.
- Pigott, Vincent C. (1999). The Archaeometallurgy of the Asian Old World. Philadelphia: University of Pennsylvania Museum of Archaeology and Anthropology. (ردمك 0-924171-34-0), p. 8.
- Wagner, Donald B. (2003)، "Chinese blast furnaces from the 10th to the 14th century" (PDF)، Historical Metallurgy، 37 (1): 25–37، مؤرشف من الأصل (PDF) في 07 يناير 2018، اطلع عليه بتاريخ 07 يناير 2018. originally published in Wagner, Donald B. (2001)، "Chinese blast furnaces from the 10th to the 14th century"، West Asian Science, Technology, and Medicine، 18: 41–74، doi:10.1163/26669323-01801008.
- Wagner, Donald B. (1993)، Iron and Steel in Ancient China، Brill، ص. 335–340، ISBN 978-90-04-09632-5.
- Pigott, Vincent C. (1999). The Archaeometallurgy of the Asian Old World. Philadelphia: University of Pennsylvania Museum of Archaeology and Anthropology. (ردمك 0-924171-34-0), p. 191.
- The Coming of the Ages of Steel، Brill Archive، 1961، ص. 54.
- Golas, Peter J. (1999)، Science and Civilisation in China: Volume 5, Chemistry and Chemical Technology, Part 13, Mining، Cambridge University Press، ص. 152، ISBN 978-0-521-58000-7،
earliest blast furnace discovered in China from about the first century AD
- Riederer, Josef; Wartke, Ralf-B. (2009) "Iron", Cancik, Hubert; Schneider, Helmuth (eds.): Brill's New Pauly, Brill.
- Sophus Müller: Eisenzeit. Walter de Gruyter GmbH & Co KG, 2019, ISBN 978-3-11-144101-6, S. 9
- Song Yingxing (1637): The Tiangong Kaiwu encyclopedia.
- Greenwood & Earnshaw 1997، صفحات 1072.
- Adam Robert Lucas (2005), "Industrial Milling in the Ancient and Medieval Worlds: A Survey of the Evidence for an Industrial Revolution in Medieval Europe", Technology and Culture 46 (1): 1-30 [10-1 & 27]
- R. L. Miller (أكتوبر 1988)، "Ahmad Y. Al-Hassan and Donald R. Hill, Islamic technology: an illustrated history"، Medical History، 32 (4): 466–7.
- Spoerl, Joseph S. A Brief History of Iron and Steel Production نسخة محفوظة 2 June 2010 على موقع واي باك مشين.. Saint Anselm College
- Kochmann, W. (2004)، "Nanowires in ancient Damascus steel"، Journal of Alloys and Compounds، 372: L15–L19، doi:10.1016/j.jallcom.2003.10.005، ISSN 0925-8388.
{{استشهاد بدورية محكمة}}: يحتوي الاستشهاد على وسيط غير معروف وفارغ:|quotes=(مساعدة)، الوسيط|ref=harvغير صالح (مساعدة)، الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة)
Levin, A. A. (2005)، "Microstructure of a genuine Damascus sabre" (PDF)، Crystal Research and Technology، 40 (9): 905–916، doi:10.1002/crat.200410456، مؤرشف من الأصل (PDF) في 19 مارس 2009.{{استشهاد بدورية محكمة}}: الوسيط|ref=harvغير صالح (مساعدة)، الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Robert Hartwell, 'Markets, Technology and the Structure of Enterprise in the Development of the Eleventh Century Chinese Iron and Steel Industry' Journal of Economic History 26 (1966). pp. 53-54
- Erik Myrstener, William Lidberg, Ulf Segerström, Harald Biester, David Damell, Richard Bindler: Was Moshyttan the earliest iron blast furnace in Sweden? The sediment record as an archeological toolbox. In: Journal of Archaeological Science: Reports. Band 5, 2016, S. 35–44. doi:10.1016/j.jasrep.2015.10.040.
- Hans Berns, Werner Theisen: Eisenwerkstoffe – Stahl und Gusseisen. Springer-Verlag, 2008, ISBN 978-3-540-79957-3, S. 396
- Biddle؛ Parker، Chemistry, Precision and Design، A Beka Book, Inc..
- Weissenbacher, Manfred (2009)، Sources of Power: How Energy Forges Human History، Santa Barbara, CA: Praeger، ص. 194، ISBN 978-0-313-35626-1، مؤرشف من الأصل في 29 ديسمبر 2021.
- Schivelbusch, G. (1986) The Railway Journey: Industrialization and Perception of Time and Space in the 19th Century. Oxford: Berg.
- Mott (2014)، "Dry and Wet Puddling"، Transactions of the Newcomen Society، 49: 156–57، doi:10.1179/tns.1977.011.
- Klaus Urban: Materialwissenschaft und Werkstofftechnik Ein Ritt auf der Rasierklinge. Springer-Verlag, 2015, ISBN 978-3-662-46237-9, S. 28
- Enghag (08 يناير 2008)، Encyclopedia of the Elements: Technical Data – History – Processing – Applications، ص. 190–91، ISBN 978-3-527-61234-5.
- Morgan, J. W.؛ Anders, E. (1980)، "Chemical composition of Earth, Venus, and Mercury"، Proceedings of the National Academy of Sciences، 77 (12): 6973–6977، Bibcode:1980PNAS...77.6973M، doi:10.1073/pnas.77.12.6973، PMC 350422، PMID 16592930.
- Claude Allègre, Gérard Manhès, Éric Lewin: Chemical composition of the Earth and the volatility control on planetary genetics. In: Earth and Planetary Science Letters. Band 185, 2001, S. 49–69; doi:10.1016/S0012-821X(00)00359-9.
- Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 85. Auflage. CRC Press, Boca Raton, Florida, 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea.
- William M. Haynes: CRC Handbook of Chemistry and Physics. 92. Auflage. Taylor & Francis, 2011, ISBN 978-1-4398-5511-9
- Katharina Lodders: Solar System Abundances of the Elements. In: Principles and Perspectives in Cosmochemistry. 2010, S. 379–417. Crossref. Web. نسخة محفوظة 2021-12-19 على موقع واي باك مشين.
- Mathias Scholz: Die Physik der Sterne Aufbau, Entwicklung und Eigenschaften. Springer-Verlag, 2018, ISBN 978-3-662-57801-8, S. 500
- Aron, Jacob، "Supernova space bullets could have seeded Earth's iron core"، New Scientist (باللغة الإنجليزية)، مؤرشف من الأصل في 19 ديسمبر 2021، اطلع عليه بتاريخ 02 أكتوبر 2020.
- Croswell, Ken، "Iron in the Fire: The Little-Star Supernovae That Could"، Scientific American (باللغة الإنجليزية)، مؤرشف من الأصل في 19 ديسمبر 2021، اطلع عليه بتاريخ 03 يناير 2021.
- Klingelhöfer؛ Morris؛ Souza؛ Rodionov؛ Schröder (2007)، "Two earth years of Mössbauer studies of the surface of Mars with MIMOS II"، Hyperfine Interactions، 170 (1–3): 169–77، Bibcode:2006HyInt.170..169K، doi:10.1007/s10751-007-9508-5، S2CID 98227499.
- Kong؛ Li؛ Shi؛ Huang؛ Zhao (06 مارس 2012)، "Dynamical stability of iron under high-temperature and high-pressure conditions"، EPL، 97 (5): 56004p1–56004p5، Bibcode:2012EL.....9756004K، doi:10.1209/0295-5075/97/56004.
- Gaminchev؛ Chamati (03 ديسمبر 2014)، "Dynamic stability of Fe under high pressure"، J. Phys.، 558 (1): 012013(1–7)، Bibcode:2014JPhCS.558a2013G، doi:10.1088/1742-6596/558/1/012013.
- John Grotzinger, Thomas Jordan: Press/Siever Allgemeine Geologie. Springer-Verlag, 2016, ISBN 978-3-662-48342-8, S. 11
- Emiliani, Cesare (1992)، Planet earth: cosmology, geology, and the evolution of life and environment، Cambridge University Press، ص. 152، Bibcode:1992pecg.book.....E، ISBN 978-0-521-40949-0.
- Pernet-Fisher؛ Day؛ Howarth؛ Ryabov؛ Taylor (2017)، "Atmospheric outgassing and native-iron formation during carbonaceous sediment–basalt melt interactions"، Earth and Planetary Science Letters، 460: 201–212، Bibcode:2017E&PSL.460..201P، doi:10.1016/j.epsl.2016.12.022، مؤرشف من الأصل في 19 ديسمبر 2021.
- IMA/CNMNC List of Mineral Names – Iron نسخة محفوظة 2012-09-11 at WebCite.
- Ferropericlase. Mindat.org نسخة محفوظة 2021-06-27 على موقع واي باك مشين.
- Stark, Anne M. (2007-09-20) Researchers locate mantle's spin transition zone, leading to clues about earth's structure. Lawrence Livermore National Laboratory
- Murakami, M.؛ Ohishi Y.؛ Hirao N.؛ Hirose K. (2012)، "A perovskitic lower mantle inferred from high-pressure, high-temperature sound velocity data"، Nature، 485 (7396): 90–94، Bibcode:2012Natur.485...90M، doi:10.1038/nature11004، PMID 22552097، S2CID 4387193.
- Sharp (27 نوفمبر 2014)، "Bridgmanite – named at last"، Science، 346 (6213): 1057–58، Bibcode:2014Sci...346.1057S، doi:10.1126/science.1261887، PMID 25430755، S2CID 206563252.
- Morgan & Anders (1980)، "Chemical composition of Earth, Venus, and Mercury"، Proc. Natl. Acad. Sci.، 77 (12): 6973–77، Bibcode:1980PNAS...77.6973M، doi:10.1073/pnas.77.12.6973، PMC 350422، PMID 16592930.
- Slobodan Jankovic: Wirtschaftsgeologie der Erze. Springer-Verlag, 2013, ISBN 978-3-7091-5100-6, S. 96
- Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg: Industrielle Anorganische Chemie. John Wiley & Sons, 2013, ISBN 978-3-527-33019-5, S. 696, 252
- "Pyrrhotite"، Mindat.org، مؤرشف من الأصل في 26 يناير 2022، اطلع عليه بتاريخ 07 يوليو 2009.
- Klein, Cornelis and Cornelius S. Hurlbut, Jr. (1985) Manual of Mineralogy, Wiley, 20th ed, pp. 278–79 (ردمك 0-471-80580-7)
- Greenwood & Earnshaw 1997، صفحات 1071.
- Lyons؛ Reinhard (2009)، "Early Earth: Oxygen for heavy-metal fans"، Nature، 461 (7261): 179–181، Bibcode:2009Natur.461..179L، doi:10.1038/461179a، PMID 19741692، S2CID 205049360.
- Cloud (1973)، "Paleoecological Significance of the Banded Iron-Formation"، Economic Geology، 68 (7): 1135–43، doi:10.2113/gsecongeo.68.7.1135.
- Lexikon der Geowissenschaften: Banded Iron Formation, abgerufen am 5. Oktober 2019. نسخة محفوظة 19 ديسمبر 2021 على موقع واي باك مشين.
- Dickinson, Robert E. (1964). Germany: A regional and economic geography (2nd ed.). London: Methuen.
- Steel Statistical Yearbook 2010. World Steel Association
- Iron and Steel Statistics and Information: Iron and Steel 2019 Statistics and Information, abgerufen am 8. Oktober 2019. نسخة محفوظة 2021-11-27 على موقع واي باك مشين.
- Metal Stocks in Society: Scientific synthesis, 2010, International Resource Panel, UNEP نسخة محفوظة 2021-10-30 على موقع واي باك مشين.
- H. Berns, L. Scheer (2013)، Was ist Stahl – Eine Stahlkunde für jedermann، Springer-Verlag، ص. 100، ISBN 978-3-642-61846-8.
- Heinz Max Hiersig (2013)، VDI-Lexikon Maschinenbau، Springer-Verlag، ص. 520، ISBN 978-3-642-57850-2.
- Wolfgang Bleck, Elvira Moeller (2017)، Handbuch Stahl Auswahl, Verarbeitung, Anwendung، Carl Hanser Verlag GmbH Co KG، ص. 78,386، ISBN 978-3-446-44962-6.
- United States Geological Survey: World Production (PDF; 298 kB). نسخة محفوظة 2017-02-24 على موقع واي باك مشين.
- Worldsteel، "World Steel in Figures 2020" (PDF)، World Steel Association، مؤرشف من الأصل (PDF) في 03 يوليو 2020.
- Greenwood & Earnshaw 1997، صفحات 1073.
- Holleman؛ Wiberg؛ Wiberg (1985)، "Iron"، Lehrbuch der Anorganischen Chemie (باللغة الألمانية) (ط. 91–100)، Walter de Gruyter، ص. 1125–46، ISBN 3-11-007511-3.
- Ludwig von Bogdandy, H.-J. Engell (2013)، Die Reduktion der Eisenerze Wissenschaftliche Grundlagen und technische Durchführung، Springer-Verlag، ص. 33، ISBN 978-3-642-92935-9.
- Simone Franke (2019)، Giesserei-Lexikon 2019، Schiele & Schoen، ص. 181، ISBN 978-3-7949-0916-2.
- Martin Bertau, Armin Müller, Peter Fröhlich, Michael Katzberg, Karl Heinz Büchel, Hans-Heinrich Moretto, Dietmar Werner (2013)، Industrielle Anorganische Chemie، John Wiley & Sons، ص. 252، ISBN 978-3-527-64958-7.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Verhoeven, J.D. (1975) Fundamentals of Physical Metallurgy, Wiley, New York, p. 326
- SIEMENS VAI، "SIMETAL Corex technology" (PDF)، SIEMENS VAI، مؤرشف من الأصل (PDF) في 26 يونيو 2013، اطلع عليه بتاريخ 16 أكتوبر 2013.
- Lux, H. (1963) "Metallic Iron" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. G. Brauer (ed.), Academic Press, NY. Vol. 2. pp. 1490–91.
- Anna Schuh-Renner, Adam Fritsch, M. Heim, A. Shore, M. Thoennessen: Discovery of the Iron Isotopes. In: Atomic Data and Nuclear Data Tables. Band 96, 2010, S. 817–823. doi:10.1016/j.adt.2010.06.003.
- Audi؛ Bersillon؛ Blachot؛ Wapstra (2003)، "The NUBASE evaluation of nuclear and decay properties"، Nuclear Physics A، ج. 729، ص. 3–128، Bibcode:2003NuPhA.729....3A، doi:10.1016/j.nuclphysa.2003.11.001
- Rugel؛ Faestermann؛ Knie؛ Korschinek؛ Poutivtsev؛ Schumann؛ Kivel؛ Günther-Leopold؛ Weinreich؛ Wohlmuther, M. (2009)، "New Measurement of the 60Fe Half-Life"، Physical Review Letters، 103 (7): 072502، Bibcode:2009PhRvL.103g2502R، doi:10.1103/PhysRevLett.103.072502، PMID 19792637، مؤرشف من الأصل في 15 يناير 2022.
- Alan P. Dickin: Radiogenic Isotope Geology. Cambridge University Press, 2018, ISBN 978-1-107-09944-9, S. 422
- Dauphas؛ Rouxel (2006)، "Mass spectrometry and natural variations of iron isotopes" (PDF)، Mass Spectrometry Reviews، 25 (4): 515–50، Bibcode:2006MSRv...25..515D، doi:10.1002/mas.20078، PMID 16463281، مؤرشف من الأصل (PDF) في 10 يونيو 2010.
- Mostefaoui؛ Lugmair؛ Hoppe؛ El Goresy (2004)، "Evidence for live 60Fe in meteorites"، New Astronomy Reviews، 48 (1–4): 155–59، Bibcode:2004NewAR..48..155M، doi:10.1016/j.newar.2003.11.022.
- Fewell (1995)، "The atomic nuclide with the highest mean binding energy"، American Journal of Physics، 63 (7): 653، Bibcode:1995AmJPh..63..653F، doi:10.1119/1.17828.
- Greenwood & Earnshaw 1997، صفحات 12.
- Bautista؛ Pradhan (1995)، "Iron and Nickel Abundances in H~II Regions and Supernova Remnants"، Bulletin of the American Astronomical Society، 27: 865، Bibcode:1995AAS...186.3707B.
- Woosley؛ Janka (2006)، "The physics of core collapse supernovae"، Nature Physics، 1 (3): 147–54، arXiv:astro-ph/0601261، Bibcode:2005NatPh...1..147W، doi:10.1038/nphys172، S2CID 118974639.
- McDonald؛ Sloan؛ Zijlstra؛ Matsunaga؛ Matsuura؛ Kraemer؛ Bernard-Salas؛ Markwick (2010)، "Rusty Old Stars: A Source of the Missing Interstellar Iron?"، The Astrophysical Journal Letters، 717 (2): L92–L97، arXiv:1005.3489، Bibcode:2010ApJ...717L..92M، doi:10.1088/2041-8205/717/2/L92، S2CID 14437704.
- Greenwood & Earnshaw 1997، صفحات 116.
- M. P. Fewell (1995)، "The atomic nuclide with the highest mean binding energy"، American Journal of Physics، 63 (7): 653–658، doi:10.1119/1.17828.
- (in German) [، صفحة. 32, في كتب جوجل Die chemische Zusammensetzung unentwickelter Sterne der Spektraltypen A und F], pp. 32, 55, ، صفحة. 32, في كتب جوجل
- Lexikon der Astronomie: Eisenlinie – Lexikon der Astronomie, abgerufen am 11. Februar 2018. نسخة محفوظة 2022-01-19 على موقع واي باك مشين.
- Greenwood & Earnshaw 1997، صفحات 1075.
- François Cardarelli (in German), [، صفحة. 65, في كتب جوجل Materials Handbook A Concise Desktop Reference], Springer Science & Business Media, pp. 65, ISBN 978-1-84628-669-8, ، صفحة. 65, في كتب جوجل
- Martin, John Wilson (2007)، Concise encyclopedia of the structure of materials، Elsevier، ص. 183، ISBN 978-0-08-045127-5.
- Bramfitt؛ Benscoter (2002)، "The Iron Carbon Phase Diagram"، Metallographer's guide: practice and procedures for irons and steels، ASM International، ص. 24–28، ISBN 978-0-87170-748-2.
- Boehler؛ Ross (2007)، "Properties of Rocks and Minerals_High-Pressure Melting"، Mineral Physics، Treatise on Geophysics، Elsevier، ج. 2، ص. 527–41، doi:10.1016/B978-044452748-6.00047-X، ISBN 9780444527486.
- Chamati, Gaminchev (2014)، "Dynamic stability of Fe under high pressure"، Journal of Physics، IOP Publishing، 558 (1): 012013، Bibcode:2014JPhCS.558a2013G، doi:10.1088/1742-6596/558/1/012013.
- Stixrude؛ Wasserman؛ Cohen (10 نوفمبر 1997)، "Composition and temperature of Earth's inner core"، Journal of Geophysical Research: Solid Earth، 102 (B11): 24729–39، Bibcode:1997JGR...10224729S، doi:10.1029/97JB02125.
- Hirose, K., Tateno, S. (2010)، "The Structure of Iron in Earth's Inner Core"، Science، American Association for the Advancement of Science، 330 (6002): 359–361، Bibcode:2010Sci...330..359T، doi:10.1126/science.1194662، PMID 20947762، S2CID 206528628، مؤرشف من الأصل في 7 أغسطس 2021.
- Boehler, Reinhard (2000)، "High-pressure experiments and the phase diagram of lower mantle and core materials"، Reviews of Geophysics، American Geophysical Union، 38 (2): 221–45، Bibcode:2000RvGeo..38..221B، doi:10.1029/1998RG000053، S2CID 33458168، مؤرشف من الأصل في 12 فبراير 2022.
- Steinmetz, Charles (1917)، "fig. 42"، Theory and Calculation of Electric Circuits، McGraw-Hill، مؤرشف من الأصل في 21 ديسمبر 2021.
- Cullity؛ C. D. Graham (2008)، Introduction to Magnetic Materials, 2nd، New York: Wiley–IEEE، ص. 116، ISBN 978-0-471-47741-9، مؤرشف من الأصل في 4 نوفمبر 2021.
- Kanellos, Michael (24 أغسطس 2006)، "A divide over the future of hard drives"، CNETNews.com، مؤرشف من الأصل في 21 أكتوبر 2014، اطلع عليه بتاريخ 24 يونيو 2010.
- Kuhn, Howard and Medlin, Dana (prepared under the direction of the ASM International Handbook Committee), المحرر (2000)، ASM Handbook – Mechanical Testing and Evaluation (PDF)، ASM International، ج. 8، ص. 275، ISBN 0871703890، مؤرشف من الأصل (PDF) في 9 فبراير 2019.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المحررون (link) - Kohl, Walter H. (1995)، Handbook of materials and techniques for vacuum devices، Springer، ص. 164–167، ISBN 1563963876، مؤرشف من الأصل في 25 مارس 2017.
- Raghavan, V. (2004)، Materials Science and Engineering، PHI Learning Pvt. Ltd.، ص. 218، ISBN 8120324552، مؤرشف من الأصل في 17 يناير 2020.
- Takaji؛ Toshikatsu، "Properties of Various Pure Irons : Study on pure iron I"، Tetsu-to-Hagane، 50 (1): 42–47، مؤرشف من الأصل في 6 أبريل 2019.
- Stephan Hasse (in German), [، صفحة. 55, في كتب جوجل Gefüge der Gusseisenlegierungen], Fachverlag Schiele & Schoen, pp. 55, ، صفحة. 55, في كتب جوجل
- Greenwood & Earnshaw 1997، صفحات 1074.
- Smith؛ Hashemi (2006)، Foundations of Materials Science and Engineering (ط. 4th)، McGraw-Hill، ص. 431، ISBN 0-07-295358-6.
- Camp؛ Francis (1920)، The Making, Shaping and Treating of Steel، Pittsburgh: Carnegie Steel Company، ص. 173–74، ISBN 1-147-64423-3.
- "Classification of Carbon and Low-Alloy Steels"، مؤرشف من الأصل في 3 أبريل 2015، اطلع عليه بتاريخ 05 يناير 2008.
- Oberg, E.؛ وآخرون (1996)، "Machinery's Handbook"، New York: Industrial Press (ط. 25th)، Industrial Press Inc، ص. 440–42، Bibcode:1984msh..book.....R
- Greenwood & Earnshaw 1997، صفحات 905.
- Gmelin, Leopold (1852)، "Mercury and Iron"، Hand-book of chemistry، Cavendish Society، ج. 6، ص. 128–29.
- Greenwood & Earnshaw 1997، صفحات 1082–1084.
- Greenwood & Earnshaw 1997، صفحات 1088–1091.
- Greenwood & Earnshaw 1997، صفحات 1091–1097.
- Nam (2007)، "High-Valent Iron(IV)–Oxo Complexes of Heme and Non-Heme Ligands in Oxygenation Reactions" (PDF)، Accounts of Chemical Research، 40 (7): 522–531، doi:10.1021/ar700027f، PMID 17469792، مؤرشف من الأصل (PDF) في 3 أكتوبر 2020.
- Huang؛ Xu؛ Schwarz؛ Li (02 مايو 2016)، "On the Highest Oxidation States of Metal Elements in MO4 Molecules (M = Fe, Ru, Os, Hs, Sm, and Pu)"، Inorganic Chemistry، 55 (9): 4616–25، doi:10.1021/acs.inorgchem.6b00442، PMID 27074099.
- Reiff؛ Long (1984)، "Mössbauer Spectroscopy and the Coordination Chemistry of Iron"، Mössbauer spectroscopy applied to inorganic chemistry، Springer، ص. 245–83، ISBN 978-0-306-41647-7.
- Ware, Mike (1999)، "An introduction in monochrome"، Cyanotype: the history, science and art of photographic printing in Prussian blue، NMSI Trading Ltd، ص. 11–19، ISBN 978-1-900747-07-3.
- Greenwood & Earnshaw 1997، صفحات 1079.
- Detlef Schroeder, Andreas Fiedler u. a.: Generation and Characterization of the Anionic, Neutral, and Cationic Iron-Dioxygen Adducts [FeO2] in the Gas Phase. In: Inorganic Chemistry. Band 33, 1994, S. 5094, doi:10.1021/ic00100a039.
- Chemie für Ingenieure. Pearson Deutschland, 2008, ISBN 978-3-8273-7267-3, S. 256.
- Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1648.
- Greenwood & Earnshaw 1997، صفحات 1082.
- Siegfried Pohl, Ulrich Bierbach, Wolfgang Saak; "FeI3SC(NMe2)2, a Neutral Thiourea Complex of Iron(III) Iodide", Angewandte Chemie International Edition in English (1989) 28 (6), 776-777. https://doi.org/10.1002/anie.198907761 نسخة محفوظة 22 يناير 2022 على موقع واي باك مشين.
- Nicholas A. Barnes, Stephen M.Godfrey, Nicholas Ho, Charles A.McAuliffe, Robin G.Pritchard; "Facile synthesis of a rare example of an iron(III) iodide complex, [FeI3(AsMe3)2], from the reaction of Me3AsI2 with unactivated iron powder", Polyhedron (2013) 55, 67-72. https://doi.org/10.1016/j.poly.2013.02.066 نسخة محفوظة 12 فبراير 2022 على موقع واي باك مشين.
- Clausen؛ Good (1968)، "Stabilization of the hexachloroferrate(III) anion by the methylammonium cation"، Inorganic Chemistry، 7 (12): 2662–63، doi:10.1021/ic50070a047.
- James؛ Bakalova؛ Lieseganga؛ Reiff؛ Hockless؛ Skelton؛ White (1996)، "The hexachloroferrate(III) anion stabilized in hydrogen bonded packing arrangements. A comparison of the X-ray crystal structures and low temperature magnetism of tetrakis(methylammonium) hexachloroferrate(III) chloride (I) and tetrakis(hexamethylenediammonium) hexachloroferrate(III) tetrachloroferrate(III) tetrachloride (II)"، Inorganica Chimica Acta، 247 (2): 169–74، doi:10.1016/0020-1693(95)04955-X.
- Greenwood & Earnshaw 1997، صفحات 1088.
- Greenwood & Earnshaw 1997، صفحات 1091.
- Giannoccaro؛ Sacco (1977)، Bis[ethylenebis(diphenylphosphine)]-Hydridoiron Complexes، Inorg. Synth.، Inorganic Syntheses، ج. 17، ص. 69–72، doi:10.1002/9780470132487.ch19، ISBN 978-0-470-13248-7.
- Lee؛ Jung؛ Lee (1998)، "Structure of trans-chlorohydridobis(diphenylphosphinoethane)iron(II)"، Bull. Korean Chem. Soc.، 19 (2): 267–69، doi:10.1007/BF02698412، S2CID 35665289، مؤرشف من الأصل في 23 يناير 2022.
- Kealy؛ Pauson (1951)، "A New Type of Organo-Iron Compound"، Nature، 168 (4285): 1039–40، Bibcode:1951Natur.168.1039K، doi:10.1038/1681039b0، S2CID 4181383.
- Miller؛ Tebboth؛ Tremaine (1952)، "114. Dicyclopentadienyliron"، Journal of the Chemical Society: 632–635، doi:10.1039/JR9520000632.
- Wilkinson؛ Rosenblum؛ Whiting؛ Woodward (1952)، "The Structure of Iron Bis-Cyclopentadienyl"، Journal of the American Chemical Society، 74 (8): 2125–2126، doi:10.1021/ja01128a527.
- Okuda, Jun (28 ديسمبر 2016)، "Ferrocene - 65 Years After"، European Journal of Inorganic Chemistry، 2017 (2): 217–219، doi:10.1002/ejic.201601323، ISSN 1434-1948.
- Greenwood & Earnshaw 1997، صفحات 1104.
- Greenwood & Earnshaw 1997، صفحات 1282–1286.
- Bullock, R.M. (11 سبتمبر 2007)، "An Iron Catalyst for Ketone Hydrogenations under Mild Conditions"، Angew. Chem. Int. Ed.، 46 (39): 7360–63، doi:10.1002/anie.200703053، PMID 17847139.
- Barbara Grüttner, Wilhelm Fresenius, H. Hahn, Gerhart Jander (in German), [، صفحة. 128, في كتب جوجل Elemente der Achten Nebengruppe Eisen · Kobalt · Nickel], Springer-Verlag, pp. 128, ISBN 978-3-662-36753-7, ، صفحة. 128, في كتب جوجل
- Hermann Sicius (in German), [، صفحة. 20, في كتب جوجل Eisengruppe: Elemente der achten Nebengruppe Eine Reise durch das Periodensystem], Springer-Verlag, pp. 20,22, ISBN 978-3-658-15561-2, ، صفحة. 20, في كتب جوجل
- E. Schweda: Jander/Blasius: Anorganische Chemie I – Einführung & Qualitative Analyse. 17. Auflage. Hirzel, Stuttgart 2012, ISBN 978-3-7776-2134-0, S. 337.
- Gerhart Jander, Ewald Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. 12. Auflage. S. Hirzel Verlag, Stuttgart 1983, ISBN 3-7776-0379-1, S. 221.
- Greenwood & Earnshaw 1997، صفحات 1076.
- D. Glindemann, A. Dietrich, H.-J. Staerk, P. Kuschk: Die zwei Gerüche des Eisens bei Berührung und unter Säureeinwirkung – (Haut)Carbonylverbindungen und Organophosphine. In: Angewandte Chemie. Band 118, Nr. 42, 2006, S. 7163–7166 (doi:10.1002/ange.200602100).
- D. Glindemann, A. Dietrich, H. Staerk, P. Kuschk (2006)، "The Two Odors of Iron when Touched or Pickled: (Skin) Carbonyl Compounds and Organophosphines"، Angewandte Chemie International Edition، 45 (42): 7006–7009، doi:10.1002/anie.200602100، PMID 17009284.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - W. Ternes (in German), [، صفحة. 108, في كتب جوجل Biochemie der Elemente: Anorganische Chemie biologischer Prozesse], Springer-Verlag, pp. 108,127, ISBN 978-3-8274-3020-5, ، صفحة. 108, في كتب جوجل
- Wolfgang Mücke, Christa Lemmen (in German), [، صفحة. 76, في كتب جوجل Duft und Geruch Wirkungen und gesundheitliche Bedeutung von Geruchsstoffen], ecomed-Storck GmbH, pp. 76, ISBN 978-3-609-16436-6, ، صفحة. 76, في كتب جوجل
- Dlouhy؛ Outten (2013)، Banci, Lucia (المحرر)، Metallomics and the Cell، Metal Ions in Life Sciences، Springer، ج. 12، ص. 241–78، doi:10.1007/978-94-007-5561-1_8، ISBN 978-94-007-5560-4، PMC 3924584، PMID 23595675. electronic-book (ردمك 978-94-007-5561-1)
- Yee؛ Tolman (2015)، Peter M.H. Kroneck؛ Martha E. Sosa Torres (المحررون)، Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases، Metal Ions in Life Sciences، Springer، ج. 15، ص. 131–204، doi:10.1007/978-3-319-12415-5_5، PMID 25707468.
- "Iron"، Micronutrient Information Center, Linus Pauling Institute, Oregon State University, Corvallis, Oregon، أبريل 2016، مؤرشف من الأصل في 12 فبراير 2022، اطلع عليه بتاريخ 06 مارس 2018.
- Greenwood & Earnshaw 1997، صفحات 1098–1104.
- Uebe, René; Schüler, Dirk; "The Formation of Iron Biominerals ", pp 159-184 in "Metals, Microbes and Minerals: The Biogeochemical Side of Life" (2021) pp xiv + 341. Walter de Gruyter, Berlin. Editors Kroneck, Peter M.H. and Sosa Torres, Martha. DOI 10.1515/9783110589771-006 نسخة محفوظة 31 ديسمبر 2021 على موقع واي باك مشين.
- Lippard؛ Berg (1994)، Principles of Bioinorganic Chemistry، Mill Valley: University Science Books، ISBN 0-935702-73-3، مؤرشف من الأصل في 15 يناير 2013.
- "Proposed Mechanism of Catalase"، Catalase: H2O2: H2O2 Oxidoreductase: Catalase Structural Tutorial، مؤرشف من الأصل في 29 يناير 2022، اطلع عليه بتاريخ 11 فبراير 2007.
- "The three-dimensional structure of an arachidonic acid 15-lipoxygenase"، Science، 260 (5113): 1482–86، 1993، Bibcode:1993Sci...260.1482B، doi:10.1126/science.8502991، PMID 8502991.
- Gray؛ Hentze (أغسطس 1994)، "Iron regulatory protein prevents binding of the 43S translation pre-initiation complex to ferritin and eALAS mRNAs"، EMBO J.، 13 (16): 3882–91، doi:10.1002/j.1460-2075.1994.tb06699.x، PMC 395301، PMID 8070415.
- Neilands (1995)، "Siderophores: structure and function of microbial iron transport compounds"، The Journal of Biological Chemistry، 270 (45): 26723–26، doi:10.1074/jbc.270.45.26723، PMID 7592901.
- Neilands (1981)، "Microbial Iron Compounds"، Annual Review of Biochemistry، 50 (1): 715–31، doi:10.1146/annurev.bi.50.070181.003435، PMID 6455965.
- Kikuchi؛ Yoshida؛ Noguchi (2005)، "Heme oxygenase and heme degradation"، Biochemical and Biophysical Research Communications، 338 (1): 558–67، doi:10.1016/j.bbrc.2005.08.020، PMID 16115609.
- Nanami؛ Ookawara؛ Otaki؛ Ito؛ Moriguchi؛ Miyagawa؛ Hasuike؛ Izumi؛ Eguchi؛ Suzuki, K.؛ Nakanishi, T. (2005)، "Tumor necrosis factor-α-induced iron sequestration and oxidative stress in human endothelial cells"، Arteriosclerosis, Thrombosis, and Vascular Biology، 25 (12): 2495–501، doi:10.1161/01.ATV.0000190610.63878.20، PMID 16224057.
- Rouault, Tracey A. (2003)، "How Mammals Acquire and Distribute Iron Needed for Oxygen-Based Metabolism"، PLOS Biology، 1 (3): e9، doi:10.1371/journal.pbio.0000079، PMC 300689، PMID 14691550.
- Gregory B. Vásquez؛ Xinhua Ji؛ Clara Fronticelli؛ Gary L. Gilliland (1998)، "Human Carboxyhemoglobin at 2.2 Å Resolution: Structure and Solvent Comparisons of R-State, R2-State and T-State Hemoglobins"، Acta Crystallogr. D، 54 (3): 355–66، doi:10.1107/S0907444997012250، PMID 9761903.
- "Molybdenum L-Edge XAS Spectra of MoFe Nitrogenase"، Z Anorg Allg Chem، 641 (1): 65–71، 2015، doi:10.1002/zaac.201400446، PMC 4510703، PMID 26213424.
- Boukhalfa؛ Crumbliss (2002)، "Chemical aspects of siderophore mediated iron transport"، BioMetals، 15 (4): 325–39، doi:10.1023/A:1020218608266، PMID 12405526، S2CID 19697776.
- F. Widdel, S. Schnell, S. Heising, A. Ehrenreich, B. Assmus, B. Schink: Ferrous iron oxidation by anoxygenic phototrophic bacteria. In: Nature. Vol. 362, 1993, S. 834–836; Abstract. نسخة محفوظة 30 يناير 2022 على موقع واي باك مشين.
- Food Standards Agency – Eat well, be well – Iron deficiency نسخة محفوظة 8 August 2006 على موقع واي باك مشين.. Eatwell.gov.uk (5 March 2012). Retrieved on 27 June 2012.
- Wildermuth؛ Stark؛ Friedrich؛ Ebenhöch؛ Kühborth؛ Silver؛ Rituper (2000)، "Iron Compounds"، Ullmann's Encyclopedia of Industrial Chemistry، doi:10.1002/14356007.a14_591، ISBN 3-527-30673-0.
- Hoppe؛ Hulthén؛ Hallberg (2005)، "The relative bioavailability in humans of elemental iron powders for use in food fortification"، European Journal of Nutrition، 45 (1): 37–44، doi:10.1007/s00394-005-0560-0، PMID 15864409، S2CID 42983904.
- Pineda؛ Ashmead (2001)، "Effectiveness of treatment of iron-deficiency anemia in infants and young children with ferrous bis-glycinate chelate"، Nutrition، 17 (5): 381–4، doi:10.1016/S0899-9007(01)00519-6، PMID 11377130، مؤرشف من الأصل في 5 أبريل 2022.
- Ashmead, H. DeWayne (1989)، Conversations on Chelation and Mineral Nutrition، Keats Publishing، ISBN 0-87983-501-X.
- Institute of Medicine (US) Panel on Micronutrients (2001)، "Iron" (PDF)، Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Iron، National Academy Press، ص. 290–393، ISBN 0-309-07279-4، PMID 25057538.
- "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF)، European Food Safety Authority، 2017، مؤرشف من الأصل (PDF) في 17 سبتمبر 2021.
- "Tolerable Upper Intake Levels For Vitamins And Minerals" (PDF)، European Food Safety Authority، 2006، مؤرشف من الأصل (PDF) في 28 يناير 2022.
- "Iron Deficiency Anemia"، MediResource، مؤرشف من الأصل في 30 يناير 2022، اطلع عليه بتاريخ 17 ديسمبر 2008.
- Milman (1996)، "Serum ferritin in Danes: studies of iron status from infancy to old age, during blood donation and pregnancy"، International Journal of Hematology، 63 (2): 103–35، doi:10.1016/0925-5710(95)00426-2، PMID 8867722.
- "Federal Register May 27, 2016 Food Labeling: Revision of the Nutrition and Supplement Facts Labels. FR page 33982." (PDF)، مؤرشف من الأصل (PDF) في 7 أكتوبر 2021.
- "Daily Value Reference of the Dietary Supplement Label Database (DSLD)"، Dietary Supplement Label Database (DSLD)، مؤرشف من الأصل في 07 أبريل 2020، اطلع عليه بتاريخ 16 مايو 2020.
- Hider؛ Kong (2013)، "Chapter 8. Iron: Effect of Overload and Deficiency"، في Astrid Sigel, Helmut Sigel and Roland K.O. Sigel (المحرر)، Interrelations between Essential Metal Ions and Human Diseases، Metal Ions in Life Sciences، Springer، ج. 13، ص. 229–94، doi:10.1007/978-94-007-7500-8_8، PMID 24470094.
- Dlouhy؛ Outten (2013)، "Chapter 8.4 Iron Uptake, Trafficking and Storage"، في Banci, Lucia (المحرر)، Metallomics and the Cell، Metal Ions in Life Sciences، Springer، ج. 12، ص. 241–78، doi:10.1007/978-94-007-5561-1_8، ISBN 978-94-007-5560-4، PMC 3924584، PMID 23595675. electronic-book (ردمك 978-94-007-5561-1)
- CDC Centers for Disease Control and Prevention (03 أبريل 1998)، "Recommendations to Prevent and Control Iron Deficiency in the United States"، Morbidity and Mortality Weekly Report، 47 (RR3): 1، مؤرشف من الأصل في 1 فبراير 2022، اطلع عليه بتاريخ 12 أغسطس 2014.
- Centers for Disease Control and Prevention، "Iron and Iron Deficiency"، مؤرشف من الأصل في 29 سبتمبر 2018، اطلع عليه بتاريخ 12 أغسطس 2014.
- Ramzi S. Cotran؛ Vinay Kumar؛ Tucker Collins؛ Stanley Leonard Robbins (1999)، Robbins pathologic basis of disease، Saunders، ISBN 978-0-7216-7335-6، اطلع عليه بتاريخ 27 يونيو 2012.
- Ganz T (أغسطس 2003)، "Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation"، Blood، 102 (3): 783–8، doi:10.1182/blood-2003-03-0672، PMID 12663437، S2CID 28909635.
- Durupt؛ Durieu؛ Nové-Josserand؛ Bencharif؛ Rousset؛ Vital Durand (2000)، "Hereditary hemochromatosis"، Rev Méd Interne، 21 (11): 961–71، doi:10.1016/S0248-8663(00)00252-6، PMID 11109593.
- Cheney؛ Gumbiner؛ Benson؛ Tenenbein (1995)، "Survival after a severe iron poisoning treated with intermittent infusions of deferoxamine"، J Toxicol Clin Toxicol، 33 (1): 61–66، doi:10.3109/15563659509020217، PMID 7837315.
- "Toxicity, Iron"، Medscape، مؤرشف من الأصل في 12 يناير 2022، اطلع عليه بتاريخ 23 مايو 2010.
- Dietary Reference Intakes (DRIs): Recommended Intakes for Individuals (PDF)، Food and Nutrition Board, Institute of Medicine, National Academies، 2004، مؤرشف من الأصل (PDF) في 14 مارس 2013، اطلع عليه بتاريخ 09 يونيو 2009
- Tenenbein, M. (1996)، "Benefits of parenteral deferoxamine for acute iron poisoning"، J Toxicol Clin Toxicol، 34 (5): 485–89، doi:10.3109/15563659609028005، PMID 8800185.
- U. E. Schaible, S. H. Kaufmann, "Iron and microbial infection" (in German), Nat. Rev. Microbiol. 2 (12): pp. 946–953, doi:10.1038/nrmicro1046
- Robberecht؛ وآخرون (2020)، "Magnesium, Iron, Zinc, Copper and Selenium Status in Attention-Deficit/Hyperactivity Disorder (ADHD)"، Molecules، 25 (19): 4440، doi:10.3390/molecules25194440، PMC 7583976، PMID 32992575.
- Soto-Insuga؛ وآخرون (2013)، "[Role of iron in the treatment of attention deficit-hyperactivity disorder]"، An Pediatr (Barc)، 79 (4): 230–235، doi:10.1016/j.anpedi.2013.02.008، PMID 23582950.
- Thévenod (2018)، "Chapter 15. Iron and Its Role in Cancer Defense: A Double-Edged Sword"، في Sigel, Astrid؛ Sigel, Helmut؛ Freisinger, Eva؛ Sigel, Roland K. O. (المحررون)، Metallo-Drugs: Development and Action of Anticancer Agents، Metal Ions in Life Sciences، Berlin: de Gruyter GmbH، ج. 18، ص. 437–67، doi:10.1515/9783110470734-021، PMID 29394034.
- Beguin؛ Aapro؛ Ludwig؛ Mizzen؛ Osterborg (2014)، "Epidemiological and nonclinical studies investigating effects of iron in carcinogenesis--a critical review"، Critical Reviews in Oncology/Hematology، 89 (1): 1–15، doi:10.1016/j.critrevonc.2013.10.008، PMID 24275533.
- Timo Gerres, Johanna Lehne, Gökce Mete, Suzanne Schenk, Caitlin Swalec (10.06.2021)، "Green steel production: How G7 countries can help change the global landscape."، The Leadership Group for Industry Transition (LeadIT)، مؤرشف من الأصل في 5 فبراير 2022.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "Abschied vom Hochofen"، Süddeutsche Zeitung، 02.01.2019، مؤرشف من الأصل في 5 فبراير 2022.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Morel, F.M.M., Hudson, R.J.M., & Price, N.M. (1991). Limitation of productivity by trace metals in the sea. Limnology and Oceanography, 36(8), 1742-1755. دُوِي:10.4319/lo.1991.36.8.1742
- Brezezinski, M.A., Baines, S.B., Balch, W.M., Beucher, C.P., Chai, F., Dugdale, R.C., Krause, J.W., Landry, M.R., Marchi, A., Measures, C.I., Nelson, D.M., Parker, A.E., Poulton, A.J., Selph, K.E., Strutton, P.G., Taylor, A.G., & Twining, B.S.(2011). Co-limitation of diatoms by iron and silicic acid in the equatorial Pacific. Deep-Sea Research Part II: Topical Studies in Oceanography, 58(3-4), 493-511. دُوِي:10.1016/j.dsr2.2010.08.005
- Field, E. K., Kato, S., Findlay, A. J., MacDonald, D. J., Chiu, B. K., Luther, G. W., & Chan, C. S. (2016). Planktonic marine iron oxidizers drive iron mineralization under low-oxygen conditions. Geobiology, 14(5), 499-508. دُوِي:10.1111/gbi.12189
- Wells, M.L., Price, N.M., & Bruland, K.W. (1995). Iron chemistry in seawater and its relationship to phytoplankton: a workshop report. Marine Chemistry, 48(2), 157-182. دُوِي:10.1016/0304-4203(94)00055-I
- Lannuzel, D., Vancoppenolle, M., van der Merwe, P., de Jong, J., Meiners, K.M., Grotti, M., Nishioska, J., & Schoemann. (2016). Iron in sea ice: Review and new insights. Elementa: Science of the Anthropocene, 4 000130. دُوِي:10.12952/journal.elementa.000130
- Raiswell, R. 2011. Iron Transport from the Continents to the Open Ocean: The Aging–Rejuvenation Cycle. Elements, 7(2), 101–106. دُوِي:10.2113/gselements.7.2.101
- Tagliabue, A., Bopp, L., Aumont,O., & Arrigo, K.R. (2009). Influence of light and temperature on the marine iron cycle: From theoretical to global modeling. Global Biogeochemical Cycles, 23.دُوِي:10.1029/2008GB003214
- Greenwood & Earnshaw 1997، صفحات 1070–1071.
- Karl H. Koch (in German), [، صفحة. 102, في كتب جوجل Industrielle Prozeßanalytik], Springer-Verlag, pp. 102, ISBN 978-3-662-01083-9, ، صفحة. 102, في كتب جوجل
- Erhard Hornbogen, Hans Warlimont (in German), [، صفحة. 292, في كتب جوجل Metallkunde Aufbau und Eigenschaften von Metallen und Legierungen], Springer-Verlag, pp. 292, ISBN 978-3-662-08697-1, ، صفحة. 292, في كتب جوجل
- Franz Zach (in German), [، صفحة. 1828, في كتب جوجل Leistungselektronik Ein Handbuch Band 1 /], Springer-Verlag, pp. 1828, ISBN 978-3-658-04899-0, ، صفحة. 1828, في كتب جوجل
- Karl A. Hofmann (in German), [، صفحة. 667, في كتب جوجل Anorganische Chemie], Springer-Verlag, pp. 667, ISBN 978-3-663-14240-9, ، صفحة. 667, في كتب جوجل
- Kolasinski, Kurt W. (2002)، "Where are Heterogenous Reactions Important"، Surface science: foundations of catalysis and nanoscience، John Wiley and Sons، ص. 15–16، ISBN 978-0-471-49244-3.
- McKetta, John J. (1989)، "Nitrobenzene and Nitrotoluene"، Encyclopedia of Chemical Processing and Design: Volume 31 – Natural Gas Liquids and Natural Gasoline to Offshore Process Piping: High Performance Alloys، CRC Press، ص. 166–67، ISBN 978-0-8247-2481-8.
- Raso؛ García؛ Ruiz؛ Oliva؛ Arauzo (01 أبريل 2021)، "Aqueous phase hydrogenolysis of glycerol over Ni/Al-Fe catalysts without external hydrogen addition"، Applied Catalysis B: Environmental (باللغة الإنجليزية)، 283: 119598، doi:10.1016/j.apcatb.2020.119598، ISSN 0926-3373، S2CID 225148435، مؤرشف من الأصل في 15 ديسمبر 2021.
- da Silva؛ de Andrade Leles؛ Teixeira (01 ديسمبر 2020)، "Lewis acid metal cations exchanged heteropoly salts as catalysts in β-pinene etherification"، Reaction Kinetics, Mechanisms and Catalysis (باللغة الإنجليزية)، 131 (2): 875–887، doi:10.1007/s11144-020-01888-4، ISSN 1878-5204، S2CID 224783194، مؤرشف من الأصل في 15 ديسمبر 2021.
- Rydel-Ciszek (01 أغسطس 2021)، "The most reactive iron and manganese complexes with N-pentadentate ligands for dioxygen activation—synthesis, characteristics, applications"، Reaction Kinetics, Mechanisms and Catalysis (باللغة الإنجليزية)، 133 (2): 579–600، doi:10.1007/s11144-021-02008-6، ISSN 1878-5204، S2CID 235442316، مؤرشف من الأصل في 15 ديسمبر 2021.
- Mazzucato؛ Daniel؛ Mehmood؛ Kosmala؛ Granozzi؛ Kucernak؛ Durante (15 أغسطس 2021)، "Effects of the induced micro- and meso-porosity on the single site density and turn over frequency of Fe-N-C carbon electrodes for the oxygen reduction reaction"، Applied Catalysis B: Environmental (باللغة الإنجليزية)، 291: 120068، doi:10.1016/j.apcatb.2021.120068، ISSN 0926-3373، S2CID 233831901، مؤرشف من الأصل في 15 ديسمبر 2021.
- Besegatto؛ da Silva؛ Campos؛ de Souza؛ de Souza؛ González (05 مايو 2021)، "Perovskite-based Ca-Ni-Fe oxides for azo pollutants fast abatement through dark catalysis"، Applied Catalysis B: Environmental (باللغة الإنجليزية)، 284: 119747، doi:10.1016/j.apcatb.2020.119747، ISSN 0926-3373، S2CID 229444245، مؤرشف من الأصل في 15 ديسمبر 2021.
- Ulrich Schwabe, Dieter Paffrath (in German), [، صفحة. 265, في كتب جوجل Arzneiverordnungs-Report 2016], Springer-Verlag, pp. 265, ISBN 978-3-662-50351-5, ، صفحة. 265, في كتب جوجل
- "iron"، etymonline.com، 06.02.2022، مؤرشف من الأصل في 6 فبراير 2022.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Wolfgang Pfeifer: Etymologisches Wörterbuch des Deutschen. 212. Auflage. 1993.
- Fontenrose (1974)، "Work, Justice, and Hesiod's Five Ages"، Classical Philology، 69 (1): 1–16، doi:10.1086/366027، JSTOR 268960، S2CID 161808359، مؤرشف من الأصل في 5 أبريل 2022.
- Schmidt, Eva (1981) Der preußische Eisenkunstguss. (Art of Prussian cast iron) Technik, Geschichte, Werke, Künstler. Verlag Mann, Berlin, (ردمك 3-7861-1130-8)
المعلومات الكاملة للمصادر
- Greenwood, Norman N.؛ Earnshaw, Alan (1997)، Chemistry of the Elements (ط. الثانية)، Butterworth-Heinemann، ISBN 0-08-037941-9.
- بوابة صيدلة
- بوابة العناصر الكيميائية
- بوابة علم المواد
- بوابة الكيمياء

