بنزين (مركب كيميائي)
البنزين (أو البنزول) (البنزين الحلقي) هو سائل عديم اللون وأحد مركبات البنزين (الوقود) متطاير وأبخرته شديدة الاشتعال هو من المواد المسرطنة وله رائحة قوية ونفاذة وذو رائحة معسولة تشم بمحطات الوقود، تركيبته الكيميائية تتشكل من حلقة سداسية من الكربون والهيدروجين (C6H6) الحلقة السداسية للبنزين هي أبسط جزيء في الكيمياء العضوية العطرية هو أحد المكونات الطبيعية للزيت الخام ومن المذيبات الصناعية المهمة، ويستخدم في صناعة الأدوية واللدائن والمطاط الصناعي والأصبغة والنابالم .ويمكن صناعته من مكونات أخرى غير النفط. والبنزين من الهيدروكربونات الأروماتية وأبسطها على الإطلاق.
| بنزين | |
|---|---|
 بنزين (مركب كيميائي) |
 بنزين (مركب كيميائي) |
 بنزين (مركب كيميائي) | |
| الاسم النظامي (IUPAC) | |
Benzene | |
| تسمية الاتحاد الدولي للكيمياء | |
Cyclohexa-1,3,5-triene | |
| أسماء أخرى | |
Benzene, 1,3,5-Cyclohexatriene, Benzol, Phene | |
| المعرفات | |
| رقم CAS | 71-43-2 |
| بوب كيم (PubChem) | 241 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| |
| الخواص | |
| صيغة كيميائية | C6H6 |
| كتلة مولية | 78.11 غ.مول−1 |
| المظهر | سائل عديم اللون |
| الرائحة | عطري، شبيه بوقود السيارات |
| الكثافة | 0.8765(20) غ/سم3[1] |
| نقطة الانصهار | 5.53 °س، 279 °ك، 42 °ف |
| نقطة الغليان | 80.1 °س، 353 °ك، 176 °ف |
| الذوبانية في الماء | 1.53 غ/ل (0 °س) 1.81 غ/ل (9 °س) 1.79 غ/ل (15 °س)[2][3][4] 1.84 غ/ل (30 °س) 2.26 غ/ل (61 °س) 3.94 غ/ل (100 °س) 21.7 غ/كغم (200 °س, 6.5 ميغاباسكال) 17.8 غ/كغم (200 °س, 40 ميغاباسكال)[5] |
| الذوبانية | قابل للذوبان في كحول، كلوروفورم، رباعي كلوريد الكربون، ثنائي إيثيل الإيثر، أسيتون، حمض الخليك[5] |
| الذوبانية في إيثيلين غليكول | 5.83 غ/100 غ (20 °س) 6.61 غ/100 غ (40 °س) 7.61 غ/100 غ (60 °س)[5] |
| الذوبانية في إيثانول | 20 °س, محلول في الماء: 1.2 مل/ل (20% حجمي)[6] |
| الذوبانية في أسيتون | 20 °س, محلول في الماء: 7.69 مل/ل (38.46% حجمي) 49.4 مل/ل (62.5% حجمي)[6] |
| الذوبانية في غلايكول ثنائي الايثيلين | 52 غ/100 غ (20 °س)[5] |
| log P | 2.13 |
| ضغط البخار | 12.7 كيلوباسكال (25 °س) 24.4 كيلوباسكال (40 °س) 181 كيلوباسكال (100 °س)[7] |
| λmax | 255 نانومتر |
| معامل الانكسار (nD) | 1.5011 (20 °س) 1.4948 (30 °س)[5] |
| اللزوجة | 0.7528 سنتيبواز (10 °س) 0.6076 سنتيبواز (25 °س) 0.4965 سنتيبواز (40 °س) 0.3075 سنتيبواز (80 °س) |
| البنية | |
| البنية الجزيئية | رباعي الأسطح |
| عزم جزيئي ثنائي القطب | 0 ديباي |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
48.7 كيلوجول/مول |
| تغير الإنتالبي القياسي للاحتراق ΔcH |
3267.6 كيلوجول/مول[7] |
| إنتروبيا مولية قياسية S |
173.26 جول·مول-1·ك[7] |
| الحرارة النوعية، C | 134.8 جول·مول-1·ك |
| المخاطر | |
| صحيفة بيانات سلامة المادة | HMDB |
| رمز الخطر وفق GHS |    [8] [8] |
| بيانات الخطر وفق GHS | H225, H304, H315, H319, H340, H350, H372[8] |
| بيانات وقائية وفق GHS | P201, P210, P301+310, P305+351+338, P308+313, P331[8] |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| NFPA 704 |
3
2
0
|
| حدود الاشتعال | 1.2–7.8% |
| LD50 | 930 مغ/كغم (فأر, فموي) |
| مركبات متعلقة | |
| مركبات ذات علاقة | تولوين بورازين |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
تاريخ البنزين
اكتشفت حلقة البنزين عام 1825 بواسطة العالم الإنجليزي مايكل فاراداي والذي قام بعزله من الزيت الغازي وأعطاه الاسم بيكربوريت الهيدروجين. وفي عام 1833 قام الكيميائي الألماني إلهارد ميتشيرليتش بإنتاجه عن طريق تقطير حمض البنزويك (من صمغ البنزوين) والجير. وقام ميتشيرليتش بتسمية المركب بنزين. ثم قام الكيميائي الإنجليزي تشارلز مانسفيلد في عام 1845 الذي كان يعمل تحت رئاسة أجوست ويليام فون هوفمان بعزل البنزين من قطران الفحم. ثم بعد أربع سنوات بدأ مانسفيلد في أول إنتاج تجاري للبنزين، بطريقة قطران الفحم.
تركيب البنزين
الصيغة الكيميائية للبنزين هي (C6H6)، أوجدت نوعاً من التعجب عند بداية اكتشافه، حيث كانت الاقتراحات البنائية وقتها تدور حول أن ذرة الكربون غالبا ما ترتبط بأربعة روابط فردية مع الهيدروجين.
وكان الكيميائي أوغست كيكولة أول من اقترح البناء الحلقي للبنزين. وتوجد حكاية تتكرر عن أنه من كثرة دراسة الترابط في الكربون، شاهد أثناء نومه حلم يدور حول حية تأكل ذيلها، مما ألهمه الشكل الحلقي لجزيء البنزين. وعموما فقد ظهرت هذه الحكاية في (مجلة جمعية التعطش للكيمياء) والتي كانت تطبع سنويا في القرن التاسع عشر في مناسبة اجتماع الجمعية الكيميائية الألمانية.
وفي أوائل العشرينيات من القرن التاسع عشر كان لتفهم كيكول للطبيعة رباعية التكافؤ لذرة الكربون اعتمادا على أبحاث أرشيبالد سكوت كوبر، بالإضافة إلى العالم النمساوي جوزيف لوشميدت الذي قام بنشر البناء الحلقي للبنزين. تمت الموافقة أخيرا على الشكل الحلقى للبنزين بواسطة العالم المشهور كاثلين لونسدال.
وحتى يمكن للبنزين أن يكون به كل الروابط يجب أن يكون له روابط ثنائية معينة.
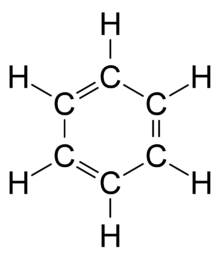
وكان باستخدام تجارب حيود الأشعة السينية في الأبحاث دورا في اكتشاف أن الروابط كربون-كربون في البنزين لها نفس الطول، برغم أن الروابط الأحادية مفترض ان تكون أطول من الروابط الثنائية. وأيضا وجد أن طول الرابطة (المسافة بين ذرتين مرتبطتين من الكربون ) في البنزين أطول في الرابطة الأحادية من طول الرابطة في الرابطة الثنائية.
وهذا يمكن تفسيره بسبب عدم تمركز الإلكترونات. وحتى يمكن تصور ذلك، يجب الأخذ في الاعتبار مكان الإلكترونات في روابط حلقة البنزين.
أحد التمثيلات لبنية البنزين يوجد في الشكلين القادمين بالتبادل، ويسمى هذا التركيب الرنين المترافق.

ومعنى ذلك أن الروابط بين ذرات الكربون هنا ليست مستقرة وإنما يحدث تبادل مستمر بين ارتباطات أحادية وارتباطات ثنائية، ولكن هذا «الرنين» لا يؤثر على خواص البنزين الكيميائية .
تتكون الروابط الأحادية من الإلكترونات الموجودة بين ذرات الكربون – ويطلق عليها سيجما σ. وتتكون الروابط الثنائية من رابطة سيجما، ورابطة أخرى تسمى رابطة باي. وهذه الرابطة الثانية لها إلكترونات تدور في مدارات أعلى وأسفل مستوى الحلقة عند كل ذرة كربون مرتبطة. وتتكون الروابط باي من مدار p الذري أسفل وأعلى مستوى الحلقة. والشكل القادم يوضح مكان هذه المدارات.
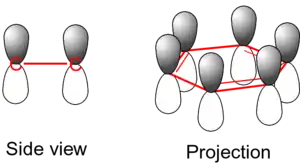
وحيث أنهم خارج مستوى الذرات، فإن هذه المدارات يمكن أن تتفاعل مع بعضها بحرية، وتصبح غير متمركزة. ويعنى هذا أنه بدلا من أن تكون مرتبطة مع ذرة كربون معينة، فإن كل إلكترون تتم مشاركته بكل ذرات الكربون الستة في الحلقة، وتقوم هذه الإلكترونات بتقوية كل الروابط الموجودة في الحلقة. ويكون للمدار الجزيئي الناتج تماثل باي.
ويعرف عدم تمركز الألكترونات بالأروماتية ، وهذا يعطى للبنزين ثباتاً عالياً. وهذه هي الخاصية الأساسية للمركبات الأروماتية والتي تفرقها عن المركبات غير الأروماتية.
ولتوضيح الطبيعة غير المتمركزة للروابط في البنزين، يمكن أن يتم رسم حلقة البنزين بوضع دائرة داخل الشكل السداسي لحلقة البنزين.

ومثل الطريقة العادية لتمثيل البناء الجزيئي، فإن ذرات الكربون لا يتم توضيحها على الرسم.
ويوجد البنزين بصورة كافية كمكون للجزيئات العضوية والتي لها رمز معين بالكود 232C ⌬.
ملحوظة: لا تستطيع عديد من المستكشفات عرض هذا الرمز.
مستبدلات البنزين
يوجد عديد من المواد الكيماوية ذات الأصل البنزيني، باستبدال ذرة أو أكثر من ذرات الهيدروجين بمجموعة فعالة.
مستبدلات أخرى
- فينول C6H5-OH
- أنيلين C6H5-NH2
- كلورو بنزين C6H5-Cl
- نيترو بنزين C6H5-NO2
- حمض بكريك C6H2(-OH)(-NO2)3
- تراينيترو طولوين C6H2(-CH3)(-NO2)3
- حمض بنزويك C6H5-COOH
- حمض سالسيليك C6H4(-OH)(-COOH)
- حمض أسيتايل سالسيليك C6H4(-O-C(=O)-CH3)(-COOH)
- باراسيتامول C6H4(-NH-C(=O)-CH3)(-OH)
- فيناسيتين C6H4(-NH-C(=O)-CH3)(-O-CH2-CH3)
الحلقات الأروماتية المتعددة
- نفثالين
- أنثراسين
- فينانثرين
- إندول
- بنزوفيوران
- كينولين
- أيزوكينولين
- هيدروكربون أروماتي متعدد الحلقات (PAH)
الحلقات غير المتجانسة المشابهة
في الحلقات غير المتجانسة, يتم استبدال ذرات الكربون في البنزين بعناصر أخرى:
شاهد حلقة أروماتية بسيطة لمشابهات البنزين.
إنتاج البنزين
ينتج البنزين بصفة عامة من الاحتراق الغير كامل للمواد الغنية بالكربون. وينتج طبيعيا من البراكين وحرائق الغابات, كما أنه أحد مكونات دخان السجائر.
وحتى الحرب العالمية الثانية, معظم البنزين كان يتم الحصول عليه كمنتج ثانوي من فحم الكوك أثناء إنتاج الصلب. وعموما, فإنه في فترة الخمسينيات من القرن العشرين زاد الطلب على البنزين, وخاصة في صناعات اللدائن الناشئة في ذلك الوقت, مما استتبع ذلك بداية إنتاج البنزين من البترول. وحاليا يتم إنتاج معظم البنزين من الصناعات البتروكيماوية, وكميات ضئيلة تنتج من الفحم.
وهناك ثلاث عمليات صناعية تتشارك بالتساوي في إنتاج البنزين: إعادة التكوين الحفزي, الألكلة الهيدروجينية للطولوين، تكسير البخار.
إعادة التكوين الحفزي
في عملية إعادة التكوين الحفزي, يتم خلط مخلوط من الهيدروكربونات التي لها نقطة غليان من 60 إلى 200 C ° مع غاز الهيدروجين, ثم تعريضها إلى كلوريد البلاتين أو كلوريد الرينيوم كعامل حفاز في درجة حرارة من 500 إلى 525 C °, وضغط يتراوح من 8 إلى 50 atm. وتحت هذه الظروف, تكون الهيدروكربونات الأليفاتية حلقات بفقد هيدروجين لتصبح هيدروكربونات أروماتية. ثم يتم فصل هذه المكونات الأروماتية من التفاعل باستخلاصها باى مذيب, مثل داي إيثيلين جيليكول أو سلفولان, ثم يتم فصل البنزين بعد ذلك من المركبات الأروماتية الأخرى بالتقطير.
الألكلة الهيدروجينية للطولوين
الألكلة الهيدروجينية تقوم بتحويل الطولوين إلى بنزين. وفي هذه العملية يتم خلط الطولوين بالهيدروجين, ثم يتم إمراره على عامل حفاز مثل الكروم أو الموليبيدنيوم, أو أكسيد البلاتين في درجة حرارة من 500 إلى 600 C ° ى ف ضغط من 40 إلى 60 atm. وأحيانا تستخدم درجات الحرارة العالية بدلا من عامل الحفاز. وتحت هذه الظروف يحدث نزع ألكلة للطولوين طبقا للمعادلة الآتية:
وينتج التفاعل المثالي تقريبا 95 % بنزين من النواتج. وأحيانا يستخدم الزيلين والأروماتيات الأعلى محل الطولوين, ويكون لها نفس فاعلية الطولوين.
التكسير بالبخار
التكسير بالبخار هي الطريقة المستخدمة الإيثيلين والأولفينات الأخرى من الهيدروكربونات الأليفاتية. واعتمادا على نوعية المواد الخام المستخدمة فإن عملية التكسير بالبخار يمكن أن تنتج سائلاً غنياً بالبنزين كمنتج ثانوي يُطلق عليه بنزين الانحلال الحراري. ويمكن خلط بنزين الانحلال الحراري يمكن أن يكون مخلوطاً من الهيدروكربونات، ويمكن تقطيره لمكوناته ومنها البنزين.
استخدامات البنزين
قبل عام 1920 كان البنزين يستخدم كمذيب صناعي لإزالة الشحوم من المواد. ونظرا لسميته العالية، فقد تم استبداله بأنواع أخرى من المذيبات في الاستخدامات التي فيها تعرض للبنزين.
وكمادة تضاف للوقود السائل (البنزين المستخدم كوقود)، فإن حلقة البنزين تزيد من رقم الأوكتان، وتسبب تقليل في طرقات المحرك. وبالتالى فإن البنزين كوقود غالبا ما يحتوى على نسب مختلفة من البنزين الحلقي، وذلك قبل فترة الخمسينيات من القرن العشرين، حيث تم استبدال البنزين الحلقي بالتيترا إيثيل رصاص والذي يعتبر من العوامل المضادة لطرقات المحرك. وعموما فإنه نظرا للإتجاه العالمي لتقليل مركبات الرصاص في الوقود، أصبح البنزين الحلقي من المركبات التي تستخدم في بعض الدول لزيادة رقم الأوكتان. وهناك قلق في الولايات المتحدة من الوقود المحتوى على البنزين الحلقي، نظرا لإمكانية تسربه للمياه الجوفية، وبالتالى فإن هناك قيود صارمة حول استخدام البنزين كوقود بنسبة لا تزيد عن 1% من الوقود الحلقي.
وعموما فإن البنزين يعتبر من المواد الوسيطة لإنتاج كيماويات أخرى. وأكثر المشتقات المنتجة من البنزين الستيرين, والذي يستخدم في تصنيع البوليمرات واللدائن. الفينول أيضا من مشتقات البنزين ويستخدم في تصنيع الراتينجات والمواد اللاصقة. ويستخدم الهكسان الحلقي في إنتاج النايلون. وتستخدم كميات قليلة من البنزين لإنتاج المطاط والمزيتات والصبغات والمنظفات والأدوية والمفرقعات ومبيد الحشرات.
تفاعلات البنزين
استبدال أروماتي محب للإلكترونات (إلكتروفيلي)
الاستبدال الأروماتي المحب للإلكترونات هو طريقة عامة للاستبدال في الحلقات الأروماتية مثل البنزين. فالبنزين محب للنواة بطريقة كافية لأن يتم استبدال عند تواجد محب للإلكترونات مثل أيونات الأسيليوم أو ألكيل كاتيونات الكربون، ويتم التفاعل ليعطي في النهاية مستبدل للبنزين.

أسيلة فريدل كرافتس
أسيلة فريدل كرافتس هي مثال محدد للاستبدال الأروماتي المحب للإلكترونات. يتضمن التفاعل أسيلة حلقة أروماتية (مثل البنزين) بواسطة أسيل كلوريد, باستخدام عامل حفاز قوي مثل حمض لويس.
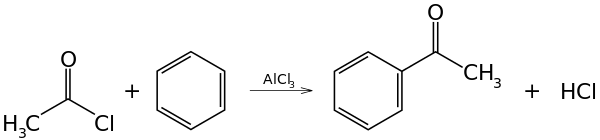
ألكلة فريدل كرافتس
ألكلة فريدل كرافتس هي مثال محدد للاستبدال الأروماتي المحب للإلكترونات. يتضمن التفاعل ألكلة حلقة أروماتية (مثل البنزين) بواسطة هالو ألكان, باستخدامها كعامل حفاز قوي مثل حمض لويس.

تفاعلات الإضافة
يتفاعل البنزين بالإضافة في بعض الحالات وذلك في ظروف خاصة حيث تحتاج هذه التفاعلات إلى طاقة كبيرة. في ضوء الشمس المباشر يتفاعل البنزين مع الكلور فيتكون سداسي كلورو الهكسان الحلقي (الجامكسان) والذي يستخدم كمبيد حشري، وهذا التفاعل يجري على خطوات عديدة. يتفاعل البنزين مع الهيدروجين بالإضافة تحت ظروف خاصة (بوجود عامل مساعد مثل البلاتين المجزأ عند 150°م) ويتكون الهكسان الحلقي.
التأثير على الصحة
يمكن أن يؤدي استنشاق كميات كبيرة من البنزين إلى الموت, بينما التعرض للبنزين بكميات أقل يسبب النعاس والدوار وزيادة معدل ضربات القلب والصداع والرعشة وعدم الإتزان وفقد الوعي. كما أن تناول طعام به نسبة عالية من البنزين يؤدى لحدوث قيء كما يسبب تآكل جدار المعدة والدوار والرغبة في النوم والرعشة وزيادة معدل ضربات القلب والموت. هناك إعتقاد بأن البنزين مادة مخدرة وربما حدث هذا لأن تعرض الإنسان لكميات محددة قد يسبب فقدان الوعي لكن هذه الكميات كبيرة نسبيًّا مقارنة بكميات المواد المخدرة المطلوبة لتخدير الإنسان ولذلك فهذا إعتقاد غير صحيح. كما أن التعرض الطويل للبنزين يسبب الضرر للب العظام, كما يسبب حدوث قلة في خلايا الدم الحمراء مما يؤدى لحدوث أنيميا. كما يمكن أن يؤدى ذلك لنزيف وإضعاف المناعة بالجسم.
وقد لوحظ أن السيدات اللائي تعرضن للبنزين لفترات طويلة يحدث لهم اختلال في الدورة الشهرية, كما يقل حجم المبايض. ولا يعرف حتى الآن بالتحديد ما إذا كان البنزين يؤثر على تطور الحمل في النساء أو على الخصوبة في النساء.
وأظهرت التجارب أن هناك نقصاً في أوزان مواليد حيوانات التجارب وتأخر في تكون العظام وتآكل لب العظام عند تعريض الأنثى الحامل للبنزين.
وقد صنفت إدارة الصحة والخدمات الإنسانية الأمريكية (DHHS) البنزين على أنه من المواد المسرطنة. والتعرض الطويل للبنزين في الهواء يمكن أن يسبب اللوكيميا أي سرطان الدم.
وهناك عديد من الاختبارات التي يمكن عملها لقياس معدلات البنزين في الجسم, فمثلا يمكن قياس معدل البنزين في النفس, وإن كان لابد من عمل هذا الاختبار في فترة قليلة من زمن النعرض للبنزين. كما يمكن قياس نسبة البنزين في الدم, وإن كان البنزين يختفى سريعاً من الدم, فيجب إجراء اختبار الدم بسرعة للحصول على نتائج دقيقة.
ويتعرض البنزين لعملية الأيض في الجسم. ويمكن قياس بعض نواتج الأيض في البول. ولكن يجب أن يتم ذلك بعد فترة قصيرة من التعرض للبنزين, وإن كانت هذه الطريقة ليست بالدقة الكافية للتعرف على كمية البنزين التي تعرض لها الجسم, حيث أن البنزين الموجود في البول يمكن أن يكون من مصدر أخر.
وقامت وكالة حماية البيئة الأمريكية بتحديد أقصى مستوى للبنزين في مياه الشرب بكمية 0.005 ملليجرام لكل لتر (0.005 mg/L). كما طالبت أيضا بالإبلاغ عن أي كمية تسرب للبنزين تزيد عن 5,4 كيلو جرام نتيجة الحوادث أو الخطأ.
وقامت إدارة الدفاع المدني والصحة الأمريكية (OSHA) بوضع حدود مسموحة للتعرض للبنزين وهي جزء واحد من البنزين في مليون جزء من الهواء في بيئة العمل خلال يوم عمل يبلغ 8 ساعات, وعدد ساعات أسبوعى يصل 40 ساعة.
التعرض للبنزين
العمال الذين تتطلب وظائفهم التعرض للبنزين, يمكن أن يكونوا في خطر التعرض لمادة مسرطنة. ومنها الصناعات التي تتضمن صناعة المطاط ومصافي الزيت ومصانع الكيماويات ومصانع الأحذية والصناعات المتعلقة بالبنزين (وقود). وفي عام 1987, قدرت OSHA أن حوالي 237,000 من العمال في الولايات المتحدة يتعرضون للبنزين, ولا يمكن تأكيد ما إذا كان هذا الرقم قد تغير أم لا.
وصلات خارجية
اقرأ أيضا
المراجع
- أرتشيبالد سكوت كوبر، نظرية جديدة، المجلة الفلسفية، (16 ،104-116 (1858)
- جوزيف لوشميدت، تشميش شتودين أي.، الدريتش كيميكال كو.,ميلووكي (1989).
- جوزيف لوشميدت، تشميش شتودين أي.، الدريتش كيميكال كو.، ميلووكي (1989)، لائحة رقم Z-18576-0، و(1913) لائحة رقم Z-18577-9.
- كاثلين لونسادال، «بناء حلقة البنزين في هيكسا ميثيل بنزين»، «تجارب المجتمع الملكي» 123A: 494 – 1929
- كاثلين لونسادال، «تحليل باستخدام الأشعة السينية لبناء هيكسا كلورو بنزين، باستخدام طريقة فورير»، «تجارب المجتمع الملكي» 133A: 536 -1931
- Lide, D. R., المحرر (2005)، CRC Handbook of Chemistry and Physics (ط. 86th)، Boca Raton (FL): CRC Press، ISBN 0-8493-0486-5
- Arnold, D.؛ Plank, C.؛ Erickson, E.؛ Pike, F. (1958)، "Solubility of Benzene in Water"، Industrial & Engineering Chemistry Chemical & Engineering Data Series، 3 (2): 253، doi:10.1021/i460004a016.
- Breslow, R.؛ Guo, T. (1990)، "Surface tension measurements show that chaotropic salting-in denaturants are not just water-structure breakers"، Proceedings of the National Academy of Sciences of the United States of America، 87 (1): 167–9، Bibcode:1990PNAS...87..167B، doi:10.1073/pnas.87.1.167، PMC 53221، PMID 2153285.
- Coker, A. Kayode؛ Ludwig, Ernest E. (2007)، Ludwig's Applied Process Design for Chemical And Petrochemical Plants، Elsevier، ج. 1، ص. 114، ISBN 0-7506-7766-X، مؤرشف من الأصل في 16 فبراير 2020، اطلع عليه بتاريخ 31 مايو 2012.
- benzene نسخة محفوظة 19 أكتوبر 2016 على موقع واي باك مشين.
- Seidell, Atherton؛ Linke, William F. (1952)، Solubilities of Inorganic and Organic Compounds، Van Nostrand، مؤرشف من الأصل في 10 مارس 2016، اطلع عليه بتاريخ 29 مايو 2014.
- Benzene in Linstrom, P.J.; Mallard, W.G. (eds.) NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD. http://webbook.nist.gov (retrieved 2014-05-29)
- سيغما-ألدريتش , Benzene. Retrieved on 2014-05-29. نسخة محفوظة 01 ديسمبر 2016 على موقع واي باك مشين.
- بوابة طبيعة
- بوابة الكيمياء
- بوابة طب
- بوابة علم البيئة
- بوابة علوم



