تاريخ الكيمياء الحيوية
يمكن القول أن تاريخ الكيمياء الحيوية قد بدأ مع الإغريق الذين كانوا مهتمين بالحياة والمواد المكونة لها، على الرغم من أن الكيمياء الحيوية باعتبارها علم محدد كانت بدايتها في جميع أنحاء العالم في أوائل القرن التاسع عشر.[1] وذهب البعض إلى أن بداية الكيمياء الحيوية كانت مع اكتشاف أول إنزيم، وهو دياستيز (يسمى اليوم الأميلاز)، في عام 1833 من قِبَل أنسيلم باين.[2] في حين اعتبر البعض الآخر أن وصف إدوارد بوخنر لأول عملية كيميائية حيوية معقدة لتخمر الإيثانول خارج الخلية هو ميلاد علم الكيمياء الحيوية.[3][4] وقد يشير البعض أيضًا إلى العمل المؤثر الذي قام به يوستوس فون ليبيغ عام 1842 في الكيمياء الحيوانية أو الكيمياء العضوية في تطبيقاته لعلم وظائف الأعضاء وعلم الأمراض، والذي قدم نظرية كيميائية لعملية التمثيل الغذائي.[1] كما أن البعض يُرجِع بدايتها إلى دراسات القرن الثامن عشر على التخمير والتنفس من قِبَل أنطوان لافوازييه.[5][6]
| جزء من سلسلة حول |
| كيمياء حيوية |
|---|
 |
| المكونات الرئيسية |
|
| التاريخ والموضوعات |
|
|
| بوابات: كيمياء حيوية |
مصطلح «الكيمياء الحيوية» «بالإنجليزية: biochemistry» مشتق من bio بمعنى «الحياة»، وchemistry بمعنى الكيمياء. وتم تسجيل الكلمة لأول مرة في اللغة الإنجليزية في عام 1848،[7] في حين في عام 1877، استخدم فيليكس هوب-سيلر مصطلح (بيوشيمي، Biochemie باللغة الألمانية) في مقدمة العدد الأول من مجلة الكيمياء الفسيولوجية (Zeitschrift für Physiologische Chemie) كمرادف للكيمياء الفسيولوجية، ودعا إلى إنشاء معاهد لدراستها.[8][9] ومع ذلك، نوهت العديد من المصادر إلى أن الكيميائي الألماني كارل نيوبيرغ صاغ مصطلح النظام الجديد في عام 1903،[10][11] وبعضها نسبه إلى فرانز هوفمايستر.[12]
موضوع الدراسة في الكيمياء الحيوية هو العمليات الكيميائية في الكائنات الحية، وينطوي تاريخها على اكتشاف وفهم المكونات المعقدة للحياة وتوضيح مسارات العمليات الكيميائية الحيوية. والكثير من الكيمياء الحيوية يتعامل مع تراكيب ووظائف المكونات الخلوية مثل البروتينات، والكربوهيدرات، والدهون، والأحماض النووية، وغيرها من الجزيئات الحيوية من حيث مساراتها الأيضية، وتدفق الطاقة الكيميائية خلال عملية التمثيل الغذائي، وكيف تؤدي الجزيئات البيولوجية إلى العمليات التي تحدث داخل الخلايا الحية. كما أنه يركز أيضًا على العمليات الكيميائية الحيوية المشاركة في السيطرة على تدفق المعلومات من خلال الإشارات الكيميائية الحيوية، وكيفية ارتباطها بعمل الكائنات الحية كلها. ولقد نجح هذا المجال على مدى السنوات الأربعين الماضية في تفسير العمليات الحية.وبذلك تشارك تقريبا جميع مجالات علوم الحياة من علم النبات إلى الطب في البحوث الكيميائية الحيوية.
من بين العدد الضخم للجزيئات الحيوية المختلفة، العديد منها يكون جزيئات معقدة وكبيرة (تسمى بوليمرات) تتكون من وحدات فرعية متكررة ومتماثلة (تسمى مونومرات). ولكل فئة من جزيء البوليمر مجموعة مختلفة من أنواع الوحدات الفرعية. على سبيل المثال، البروتين هو البوليمر التي يتم تحديد وحداته الفرعية من مجموعة من عشرين أو أكثر من الأحماض الأمينية، بينما تتكون الكربوهيدرات من السكريات المعروفة باسم السكريات الأحادية، وقليل السكاريد، وعديد السكاريد، وتتكون الدهون من الأحماض الدهنية والجليسرول، ويتم تشكيل الأحماض النووية من النيوكليوتيدات. تدرس الكيمياء الحيوية الخصائص الكيميائية للجزيئات البيولوجية الهامة، مثل البروتينات، وعلى وجه الخصوص كيمياء التفاعلات المحفَزة بالانزيم. وقد تم وصف الكيمياء الحيوية لأيض الخلية ونظام الغدد الصماء على نطاق واسع. وتشمل مجالات أخرى من الكيمياء الحيوية: الشفرة الوراثية (DNA, RNA)، وتخليق البروتين، النقل عبر غشاء الخلية، وتوصيل الإشارة.
بداية الكيمياء الحيوية
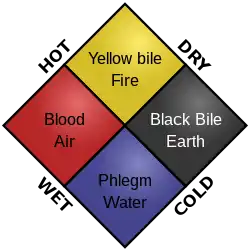
في هذا الصدد، بدأت دراسة الكيمياء الحيوية عندما بدأ علم الأحياء أولا يهتم بالمجتمع، كما طور الصينيون القدامى نظام للطب على أساس اليين واليانغ، وكذلك نظرية العناصر الخمسة،[13] والتي نتج كل منهما عن اهتمامات خيميائية وبيولوجية. وقد بدأت في الثقافة الهندية القديمة أيضًا مع الاهتمام بالطب، كما أنها وضعت مفهوم الأخلاط الثلاثة الذي كان مماثل للأخلاط اليونانية الأربعة (انظر مذهب الأخلاط). كما أنهم بحثوا في شئون الأجسام كونها مكونة من أنسجة. وكما هو الحال في معظم العلوم المبكرة، ساهم العالم الإسلامي بشكل كبير في التقدم البيولوجي المبكر وكذلك التقدم الكيميائي. خاصة مع إدخال التجارب السريرية وعلم الصيدلة السريرية المقدمة في كتاب القانون في الطب لابن سينا.[14] وعلى جانب الكيمياء، كانت التطورات المبكرة تُعزى بشكل كبير إلى استكشاف الشئون الخيميائية وشملت أيضا: علم الفلزات، والمنهج العلمي، والنظريات المبكرة للذرية. في الآونة الأخيرة، تميزت دراسة الكيمياء بعدة أشياء مثل تطوير الجدول الدوري لمندليف، والنموذج الذري لدالتون، وقانون حفظ الكتلة. ولقانون حفظ الكتلة الأهمية الأكبر بين الثلاثة لأن هذا القانون يساعد على تداخل الكيمياء مع الديناميكا الحرارية.
الإنزيمات
في وقت مبكر من أواخر القرن الثامن عشر وأوائل القرن التاسع عشر، كان من المعروف أن هضم اللحوم يتم عن طريق إفرازات المعدة،[15] وتحويل النشا إلى السكريات بواسطة المستخلصات النباتية واللعاب. ومع ذلك، لم يتم تحديد الآلية التي يحدث بها ذلك.[16]
في القرن التاسع عشر، عند دراسة تخمر السكر إلى الكحول عن طريق الخميرة، خلص لويس باستور إلى أن هذا التخمر كان يحفزه قوة حيوية داخل خلايا الخميرة تسمى الخمائر، والتي كان يعتقد أنها تعمل فقط داخل الكائنات الحية. وكتب أن «التخمر الكحولي هو عمل مرتبط بحياة وتنظيم خلايا الخميرة، وليس مع موت أو تعفن الخلايا».[17]
اكتشف أنسيلم باين في عام 1833 أول إنزيم يدعى الدياستيز،[18] وفي عام 1878 قام عالم الفيزياء الألماني فيلهلم كون (1837-1900) بصياغة مصطلح الإنزيم الذي يأتي من اليونانية ενζυμον لوصف هذه العملية. وقد استُخدمت كلمة إنزيم في وقت لاحق للإشارة إلى المواد غير الحية مثل البيبسين، واستُخدمت كلمة التخمر للإشارة إلى النشاط الكيميائي الذي تنتجه الكائنات الحية.
في عام 1897، بدأ إدوارد بوخنر دراسة قدرة خلاصة الخميرة على تخمر السكر على الرغم من غياب خلايا الخميرة الحية. وفي سلسلة من التجارب في جامعة برلين، وجد أن السكر يتخمر حتى في غياب خلايا الخميرة الحية من الخليط.[19] وقام بتسمية الإنزيم الذي أدى إلى تخمر السكروز «زيماس».[20] وفي عام 1907، حصل على جائزة نوبل في الكيمياء![]() «لبحوثه في الكيمياء الحيوية واكتشافه التخمر في الخلايا الخالية». بعد مثال بوخنر، عادة ما تسمى الإنزيمات وفقا للتفاعل الذي تقوم به. وعادة ما يضاف مقطع -ase إلى اسم الركيزة (على سبيل المثال، اللاكتاز هو الانزيم الذي يقسم اللاكتوز) أو لنوع التفاعل (على سبيل المثال، بوليميراز الدي إن إيه يكوّن بوليمرات الحمض النووي).
«لبحوثه في الكيمياء الحيوية واكتشافه التخمر في الخلايا الخالية». بعد مثال بوخنر، عادة ما تسمى الإنزيمات وفقا للتفاعل الذي تقوم به. وعادة ما يضاف مقطع -ase إلى اسم الركيزة (على سبيل المثال، اللاكتاز هو الانزيم الذي يقسم اللاكتوز) أو لنوع التفاعل (على سبيل المثال، بوليميراز الدي إن إيه يكوّن بوليمرات الحمض النووي).
بعد أن تبين أن إنزيم يمكن أن تعمل خارج الخلية الحية، كانت الخطوة التالية هي تحديد طبيعتها الكيميائية الحيوية. وأشار العديد من العاملين في وقت مبكر إلى أن النشاط الأنزيمي مرتبط بالبروتينات، ولكن العديد من العلماء (مثل ريشارد فيلشتيتر الحائز على جائزة نوبل)![]() قالوا إن البروتينات كانت مجرد ناقلات للإنزيمات الحقيقية وأن البروتينات في حد ذاتها غير قادرة على التحفيز. ومع ذلك، في عام 1926، وضّح جيمس سومنر أن إنزيم اليورياز كان بروتين نقي وتبلور؛ وقد فعل سومنر بالمثل لانزيم الكاتالاز في عام 1937. وتم إثبات الاستنتاج نهائيا بأن البروتينات النقية يمكن أن تكون إنزيمات من قِبَل نورثروب وستانلي، اللذان عملا على الانزيمات الهضمية البيبسين (1930)، والتربسين، والكيموتريبسين. وقد مُنِح هؤلاء العلماء الثلاثة جائزة نوبل
قالوا إن البروتينات كانت مجرد ناقلات للإنزيمات الحقيقية وأن البروتينات في حد ذاتها غير قادرة على التحفيز. ومع ذلك، في عام 1926، وضّح جيمس سومنر أن إنزيم اليورياز كان بروتين نقي وتبلور؛ وقد فعل سومنر بالمثل لانزيم الكاتالاز في عام 1937. وتم إثبات الاستنتاج نهائيا بأن البروتينات النقية يمكن أن تكون إنزيمات من قِبَل نورثروب وستانلي، اللذان عملا على الانزيمات الهضمية البيبسين (1930)، والتربسين، والكيموتريبسين. وقد مُنِح هؤلاء العلماء الثلاثة جائزة نوبل![]() في الكيمياء لعام 1946.[21]
في الكيمياء لعام 1946.[21]
مكّن اكتشاف أن الإنزيمات يمكن أن تتبلور العلماء من تفسير تركيبها عن طريق دراسة البلورات بالأشعة السينية. وقد تم ذلك لأول مرة على الليزوزيم، وهو انزيم يوجد في الدموع، واللعاب، وبياض البيض، يهضم غلاف بعض البكتيريا. وتم حل تركيبه من قِبَل مجموعة بقيادة ديفيد تشيلتون فيليبس ونشرت في عام 1965.[22] وميّز هذا التركيب عالي الدقة للليزوزيم بداية مجال البيولوجيا الهيكلية والجهد لفهم كيفية عمل الإنزيمات على مستوى التفاصيل الذرية.
أيض
الاهتمام بالأيض في وقت مبكر

يُشتَق مصطلح أيض (metabolism) من اليونانية: Μεταβολισμός، بمعنى «تغيير».[23] يمتد تاريخ الدراسة العلمية لعملية الأيض 800 سنة. بدأت أقدم الدراسات الأيضية في أوائل القرن الثالث عشر (1213-1288) من قِبَل عالم مسلم من دمشق يدعى ابن النفيس. وقال ابن النفيس في عمله الأكثر شهرة ثيولوغوس أوتوديداكتوس أن «هذا الجسم بجميع أجزائه في حالة مستمرة من الذوبان والتغذية، لذلك فهو حتما يمر بتغيير دائم».[24] وعلى الرغم من أن النفيس كان أول طبيب اهتم بمفاهيم الكيميائية الحيوية، إلا أن التجارب الأولى التي تم التحكم بها في عملية الأيض البشري نُشرت من قِبَل سانتوريو سانتوري في 1614 في كتابه فن إحصائيات الطب (Ars de statica medecina).[25] يصف هذا الكتاب كيف كان يزن نفسه قبل وبعد الأكل، والنوم، والعمل، والجنس، والصيام، والشرب، والإخراج. ووجد أن معظم المواد الغذائية التي تناولها قد فُقِدَت من خلال ما أسماه «تعرق غير محسوس».
الأيض: القرن العشرين - الحاضر
كان هانز كريبس واحدا من أكثر علماء الكيمياء الحيوية الحديثة إسهامًا في تقديم مساهمات ضخمة في دراسة الأيض.[26] وكان طالبًا لأوتو واربورغ. اكتشف كريبس دورة اليوريا، وبعد ذلك اكتشف دورة حمض الستريك ودورة غليوكسيلات بالتعاون مع هانز كورنبرغ.[27][28][29] وأدت هذه الاكتشافات إلى منح كريبس جائزة نوبل![]() في علم وظائف الأعضاء في عام 1953،[30] والتي تقاسمها مع عالم الكيمياء الحيوية الألماني فريتس ألبرت ليبمان الذي قام أيضا ساعد في اكتشاف مرافق الإنزيم-أ.
في علم وظائف الأعضاء في عام 1953،[30] والتي تقاسمها مع عالم الكيمياء الحيوية الألماني فريتس ألبرت ليبمان الذي قام أيضا ساعد في اكتشاف مرافق الإنزيم-أ.

امتصاص الجلوكوز
في عام 1960، كشف عالم الكيمياء الحيوية روبرت كرين عن اكتشافه للانتقال المقترن بين الصوديوم والجلوكوز كآلية لامتصاص الجلوكوز المعوي.[31] كان هذا هو أول اقتراح للاقتران بين تدفق أيون وركيزة، والذي يعتبر أنه أثار ثورة في علم الأحياء. كان يمكن لهذا الاكتشاف ألا يكون ممكنا إذا لم يتم اكتشاف تركيب جزيء الجلوكوز وتصنيعه الكيميائي. وتعزى هذه الاكتشافات إلى حد كبير إلى الكيميائي الألماني إميل فيشر الذي حصل على جائزة نوبل في الكيمياء![]() منذ ما يقرب من 60 عاما.[32]
منذ ما يقرب من 60 عاما.[32]
تحلل السكر
منذ أن تمركز الأيض على تكسير الجزيئات (عمليات الهدم) وبناء جزيئات أكبر من هذه الجسيمات (عمليات البناء)، أصبح استخدام الجلوكوز ومشاركته في تشكيل أدينوسين ثلاثي الفوسفات (ATP) أمر أساسي لفهم ذلك. النوع الأكثر تكرارا من انحلال الجلوكوز الموجود في الجسم هو النوع الذي يتبع مسار إمبد-مايرهوف-بارناس (EMP)، الذي اكتشفه غوستاف إمبدن، وأوتو مايرهوف، وجاكوب كارول برناس. اكتشف هؤلاء الرجال الثلاثة أن تحلل السكر هو عملية محددة بشدة من أجل كفاءة وإنتاج الجسم البشري. أهمية ذلك المسار الذي يظهر في الصورة المجاورة هو أنه من خلال تحديد الخطوات الفردية في هذه العملية، أصبح الأطباء والباحثون قادرين على تحديد مواقع الأعطال الأيضية مثل نقص البيروفات كيناز الذي يمكن أن تؤدي إلى فقر الدم الشديد. وهذا هو الأكثر أهمية لأن الخلايا، وبالتالي الكائنات الحية، ليست قادرة على البقاء على قيد الحياة دون المسارات الأيضية السليمة.
تطور الأدوات (القرن العشرين)

ومنذ ذلك الحين، تقدمت الكيمياء الحيوية، وخاصة منذ منتصف القرن العشرين، مع تطوير تقنيات جديدة مثل التفريق اللوني، وحيود الأشعة السينية، ومطيافية الرنين المغناطيسي النووي للبروتين، والوسم النظيري، والمجهر الإلكتروني، والمحاكاة الديناميكية الجزيئية. سمحت هذه التقنيات لاكتشاف والتحليل المفصل للعديد من الجزيئات والمسارات الأيضية للخلية، مثل تحلل السكر ودورة كريبس (دورة حمض الستريك). ويُظهِر مثال مطيافية الرنين المغناطيسي النووي للبروتين أن بعض هذه الأدوات، مثل HWB-NMR، يمكن أن تكون كبيرة جدا من حيث الحجم، ويمكن أن تتكلف في أي مكان من بضع مئات من الدولارات إلى الملايين من الدولارات (16 مليون دولار للأداة الموضحة هنا).
تفاعل البوليميراز المتسلسل

تفاعل البوليميراز المتسلسل (PCR) هو تقنية تضخيم الجينات الأولية التي أحدثت ثورة في الكيمياء الحيوية الحديثة. وتم تطوير تفاعل البوليميراز المتسلسل من قِبَل كاري موليس في عام 1983.[33] وهناك أربع خطوات لسلسلة تفاعل البوليميراز السليم:
- المسخ أو التفكك
- التمديد
- الإدراج (للجين ليتم التعبير عنه)
- وأخيرا تضخيم الجين المدرج
تسمح هذه التقنية لنسخة الجين الواحد بأن يتم تضخيمها إلى مئات أو حتى الملايين من النسخ، وأصبحت حجر الزاوية في بروتوكول أي عالِم في الكيمياء الحيوية يرغب في العمل بالبكتيريا والتعبير الجيني. لا يُستخدم PCR فقط لبحوث التعبير الجيني، ولكنه قادر أيضًا على مساعدة المختبرات في تشخيص أمراض معينة مثل الأورام اللمفاوية، وبعض أنواع سرطان الدم، وغيرها من الأمراض الخبيثة التي يمكن في بعض الأحيان أن تحيّر الأطباء. دون تطور تفاعل البوليميراز المتسلسل، لكان هناك العديد من التطورات في مجال الدراسة البكتيرية ودراسة التعبير البروتيني التي لم تكن لتحقق ثمارها.[34]
تطور نظرية وعملية تفاعل البوليميرازالمتسلسل ضروري، ولكن اختراع المدور الحراري بنفس القدر من الأهمية؛ لأن العملية لن تكون ممكنة من دون هذه الأداة. وهذا دليل آخر على حقيقة أن تقدم التكنولوجيا لا يقل أهمية عن العلوم مثل الكيمياء الحيوية كما هو الحال في البحث المضني الذي يؤدي إلى تطوير المفاهيم النظرية.
انظر أيضًا
مراجع
- Ton van Helvoort (2000)، Arne Hessenbruch (المحرر)، Reader's Guide to the History of Science، Fitzroy Dearborn Publishing، ص. 81، مؤرشف من الأصل في 24 يناير 2020.
- Hunter (2000), p. 75.
- Jacob Darwin Hamblin، Science in the Early Twentieth Century: An Encyclopedia، ABC-CLIO، ص. 26، ISBN 978-1-85109-665-7، مؤرشف من الأصل في 24 يناير 2020.
- Hunter (2000), pp. 96–98.
- Clarence Peter Berg (1980)، "The University of Iowa and Biochemistry from Their Beginnings": 1–2، ISBN 9780874140149، مؤرشف من الأصل في 24 يناير 2020، اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة)، تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - University of Wisconsin Press (1987)، Lavoisier and the Chemistry of Life: An Exploration of Scientific Creativity، ص. xv، ISBN 978-0299099848، مؤرشف من الأصل في 24 يناير 2020.
- "biochemistry, n."، OED Online، Oxford University Press، مؤرشف من الأصل في 14 ديسمبر 2019، اطلع عليه بتاريخ 8 أبريل 2015.
- Anne-Katrin Ziesak؛ Hans-Robert Cram (18 أكتوبر 1999)، Walter de Gruyter Publishers, 1749-1999، Walter de Gruyter & Co، ص. 169، ISBN 978-3110167412، مؤرشف من الأصل في 24 يناير 2020.
- Horst Kleinkauf, Hans von Döhren, Lothar Jaenicke (1988)، The Roots of Modern Biochemistry: Fritz Lippmann's Squiggle and its Consequences، Walter de Gruyter & Co، ص. 116، ISBN 9783110852455، مؤرشف من الأصل في 24 يناير 2020.
{{استشهاد بكتاب}}: صيانة CS1: يستخدم وسيط المؤلفون (link) - Mark Amsler (1986)، The Languages of Creativity: Models, Problem-solving, Discourse، University of Delaware Press، ص. 55، ISBN 978-0874132809، مؤرشف من الأصل في 24 يناير 2020.
- Advances in Carbohydrate Chemistry and Biochemistry, Volume 70، Academic Press، 28 نوفمبر 2013، ص. 36، ASIN B00H7E78BG، مؤرشف من الأصل في 24 يناير 2020.
- Koscak Maruyama (1988)، The Roots of Modern Biochemistry: Fritz Lippmann's Squiggle and its Consequences، Walter de Gruyter & Co، ص. 43، ISBN 9783110852455، مؤرشف من الأصل في 24 يناير 2020.
- Magner، A History of Life Sciences، ص. 4.
- Brater, D. Craig؛ Walter J. Daly (2000)، "Clinical pharmacology in the Middle Ages: Principles that presage the 21st century"، Clinical Pharmacology and Therapeutics، 5 (67): 447–450.
- de Réaumur, RAF (1752)، "Observations sur la digestion des oiseaux"، Histoire de l'academie royale des sciences، 1752: 266, 461.
- Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York) نسخة محفوظة 09 مايو 2012 على موقع واي باك مشين.
- Dubos J. (1951)، "Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)--chance and the prepared mind."، Trends Biotechnol، 13 (12): 511–515، doi:10.1016/S0167-7799(00)89014-9، PMID 8595136.
- A. Payen and J.-F. Persoz (1833) "Mémoire sur la diastase, les principaux produits de ses réactions et leurs applications aux arts industriels" (Memoir on diastase, the principal products of its reactions, and their applications to the industrial arts), Annales de chimie et de physique, 2nd series, vol. 53, pages 73–92. نسخة محفوظة 24 مارس 2017 على موقع واي باك مشين.
- Nobel Laureate Biography of Eduard Buchner at http://nobelprize.org نسخة محفوظة 01 يونيو 2017 على موقع واي باك مشين.
- Text of Eduard Buchner's 1907 Nobel lecture at http://nobelprize.org نسخة محفوظة 08 يوليو 2017 على موقع واي باك مشين.
- 1946 Nobel prize for Chemistry laureates at http://nobelprize.org نسخة محفوظة 06 ديسمبر 2017 على موقع واي باك مشين.
- Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR (1965)، "Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution."، Nature، 206 (4986): 757–761، doi:10.1038/206757a0، PMID 5891407.
- "Metabolism"، The Online Etymology Dictionary، مؤرشف من الأصل في 21 سبتمبر 2017، اطلع عليه بتاريخ 20 فبراير 2007.
- الرسالة الكاملية في السيرة النبوية
- Eknoyan G (1999)، "Santorio Sanctorius (1561-1636) - founding father of metabolic balance studies"، Am J Nephrol، 19 (2): 226–33، doi:10.1159/000013455، PMID 10213823.
- Kornberg H (2000)، "Krebs and his trinity of cycles"، Nat Rev Mol Cell Biol، 1 (3): 225–8، doi:10.1038/35043073، PMID 11252898.
- Krebs, H. A.؛ Henseleit, K. (1932)، "Untersuchungen über die Harnstoffbildung im tierkorper"، Z. Physiol. Chem.، 210: 33–66، doi:10.1515/bchm2.1932.210.1-2.33.
- Krebs H, Johnson W (01 أبريل 1937)، "Metabolism of ketonic acids in animal tissues"، Biochem J، 31 (4): 645–60، doi:10.1042/bj0310645، PMC 1266984، PMID 16746382.
- Kornberg H, Krebs H (1957)، "Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle"، Nature، 179 (4568): 988–91، doi:10.1038/179988a0، PMID 13430766.
- Krebs, Hans، "Nobel Foundation"، مؤرشف من الأصل في 15 أغسطس 2018، اطلع عليه بتاريخ 22 نوفمبر 2013.
- Robert K. Crane, D. Miller and I. Bihler. "The restrictions on possible mechanisms of intestinal transport of sugars". In: Membrane Transport and Metabolism. Proceedings of a Symposium held in Prague, 22–27 August 1960. Edited by A. Kleinzeller and A. Kotyk. Czech Academy of Sciences, Prague, 1961, pp. 439-449.
- Fischer, Emil، "Nobel Foundation"، مؤرشف من الأصل في 15 أغسطس 2018، اطلع عليه بتاريخ 02 سبتمبر 2009.
- Bartlett, Stirling (2003)، A Short History of the Polymerase Chain Reaction، ص. 3–6، ISBN 1-59259-384-4.
- Yamamoto, Yoshimasa (09 مايو 2002)، "PCR in Diagnosis of Infection: Detection of Bacteria in Cerebrospinal Fluid"، Clin Diagn Lab Immunology، 9 (3): 508–14، doi:10.1128/CDLI.9.3.508-514.2002، PMC 119969، PMID 11986253.
روابط خارجية
علم الكيمياء الحيوية |
- تاريخ علم الكيمياء الحيوية في موقع Bioexplorer.Net.
- U.S. Navy. Naval Medical School 1959 علم الكيمياء الحيوية. BUMED Office of Medical History
- علم الكيمياء الحيوية
- الكيمياء الحيوية للجميع
- بوابة علم الأحياء
- بوابة تاريخ العلوم
- بوابة الكيمياء
- بوابة جوائز نوبل
- بوابة الكيمياء الحيوية
- بوابة علم الأحياء الخلوي والجزيئي



